 精选
精选
一种检测癌细胞并确定其位置的无创测试方法
诸平
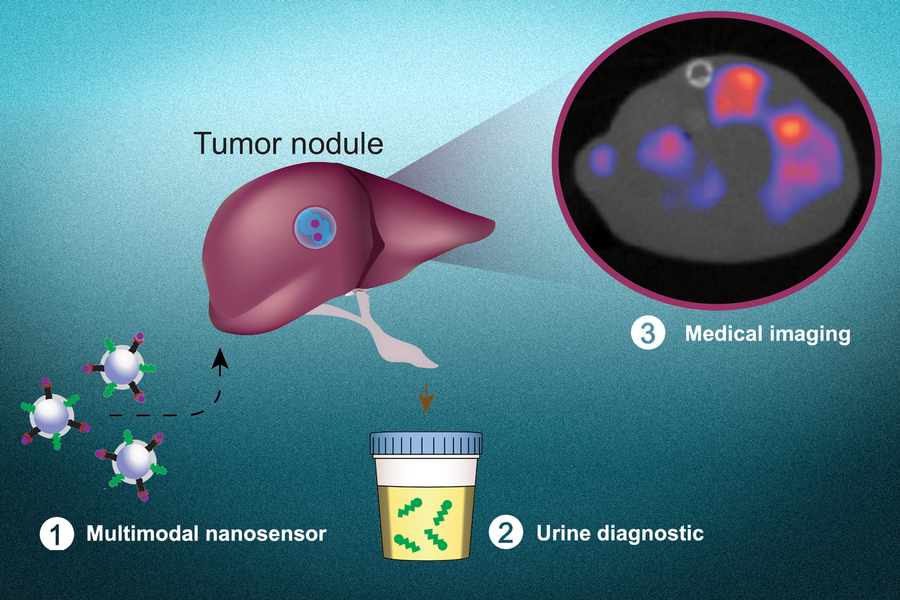
Fig. 1 Multimodal nanosensors (1) are engineered to target and respond to hallmarks in the tumor microenvironment. The nanosensors provide both a noninvasive urinary monitoring tool (2) and an on-demand medical imaging agent (3) to localize tumor metastasis and assess response to therapy. Credits: Image: Liangliang Hao
据美国麻省理工学院新闻办公室(MIT News Office)安妮·特拉夫顿(Anne Trafton)2021年7月15日报道,该校研究人员研究出诊断纳米粒子,可用于监测治疗后的肿瘤复发或进行常规癌症筛查。图1(Fig. 1)多模态纳米传感器 (1) 设计用于靶向和响应肿瘤微环境中的标志。纳米传感器提供无创尿液监测工具 (2) 和按需医学成像剂 (3),以定位肿瘤转移并评估对治疗的反应。
医生用来诊断癌症的大多数测试——例如乳房X光检查、结肠镜检查和CT扫描——都是基于成像的。最近,研究人员还开发了分子诊断技术,可以检测在血液或尿液等体液中循环的特定癌症相关分子。
麻省理工学院的工程师们现在创造了一种新的诊断纳米粒子,它结合了这两个特征:它可以通过尿液测试揭示癌蛋白的存在,它可以作为成像剂,精确定位肿瘤位置。原则上,这种诊断可用于检测身体任何部位的癌症,包括从原始位置转移的肿瘤。
麻省理工学院健康科学与技术、电气工程与计算机科学(John and Dorothy Wilson Professor of Health Sciences and Technology and Electrical Engineering and Computer Science at MIT)教授;麻省理工学院科赫综合癌症研究所(MIT’s Koch Institute for Integrative Cancer Research)成员、以及医学工程与科学研究所(Institute for Medical Engineering and Science)成员桑吉塔·巴蒂亚 (Sangeeta Bhatia) 说:“这是一种非常广泛的传感器,旨在对原发性肿瘤及其转移灶做出反应。它可以触发尿液信号,还可以让我们看到肿瘤的位置。”
在一项新研究中,桑吉塔·巴蒂亚和她的同事表明,该诊断可用于监测结肠癌的进展,包括转移性肿瘤向肺和肝脏的扩散。最终,他们希望它可以发展成为一种可以每年进行的常规癌症检测方法。
桑吉塔·巴蒂亚是该研究的通讯作者,该研究于2021年7月15已经在《自然材料》(Nature Materials)杂志网站上发表——Liangliang Hao, Nazanin Rohani, Renee T. Zhao, Emilia M. Pulver, Howard Mak, Olivia J. Kelada, Henry Ko, Heather E. Fleming, Frank B. Gertler, Sangeeta N. Bhatia. Microenvironment-triggered multimodal precision diagnostics. Nature Materials, Published: 15 July 2021, DOI: 10.1038/s41563-021-01042-y. https://www.nature.com/articles/s41563-021-01042-y
该论文的第一作者是麻省理工学院研究科学家郝亮亮(Liangliang Hao音译)。参与此项研究的科研人员除了来自MIT的之外,还有来自美国霍普金顿的珀金埃尔默公司(PerkinElmer, Hopkinton, MA, USA)、美国剑桥的霍华德·休斯医学研究所(Howard Hughes Medical Institute, Cambridge, MA, USA)、布里格姆妇女医院和哈佛医学院(Brigham and Women’s Hospital and Harvard Medical School)、麻省理工学院和哈佛大学的布罗德研究所(Broad Institute of Massachusetts Institute of Technology and Harvard)以及麻省理工学院科赫综合癌症研究所路德维希中心(Ludwig Center at Massachusetts Institute of Technology’s Koch Institute for Integrative Cancer Research)的研究人员。
定位肿瘤(Locating tumors)
在过去几年中,桑吉塔·巴蒂亚一直在研究开发癌症的诊断方法,该方法通过生成可以在尿液中轻松检测到的合成生物标志物(synthetic biomarkers)来发挥作用。大多数癌细胞会表达一种称为蛋白酶(proteases)的酶,这些酶通过切割细胞外基质的蛋白质来帮助它们逃离原来的位置。桑吉塔·巴蒂亚的癌症检测纳米颗粒被这些蛋白酶所切割的肽包覆。当这些粒子遇到肿瘤时,肽被切割并排泄在尿液中,这样它们就很容易被检测到。在肺癌动物模型中,这些生物标志物可以在早期检测出肿瘤的存在;然而,他们没有透露肿瘤的确切位置或肿瘤是否已经扩散到其起源器官之外。
在他们之前的努力的基础上,麻省理工学院的研究人员希望开发一种他们所谓的“多模式”诊断方法,它可以进行分子筛查(检测尿液信号)和成像,以准确地告诉他们原始肿瘤和任何转移的位置。
为了修改粒子,使其也可用于正电子发射断层显像(positron emission tomography imaging)简称 PET成像(PET imaging),研究人员添加了一种称为铜-64(64Cu) 的放射性示踪剂。他们还用一种肽包被,这种肽会被酸性环境(例如肿瘤中的微环境)吸引,以诱导颗粒在肿瘤部位积聚。一旦它们到达肿瘤,这些肽就会将自身插入细胞膜,在背景噪音之上产生强大的成像信号。
研究人员在两种转移性结肠癌小鼠模型中测试了这种诊断颗粒,其中肿瘤细胞迁移到肝脏或肺部并在其中生长。在用一种常用于治疗结肠癌的化疗药物治疗后,研究人员能够使用尿液信号和显像剂来追踪肿瘤对治疗的反应。
研究人员还发现,与通常用于PET成像的策略相比,使用纳米粒子输送铜-64更具有优势。PET示踪剂(PET tracer),称为氟脱氧葡萄糖(fluorodeoxyglucose)简称FDG,是一种放射性形式的葡萄糖,可被代谢活跃的细胞(包括癌细胞)吸收。然而,当暴露于 FDG 时,心脏会产生明亮的 PET 信号,该信号会掩盖来自附近肺部肿瘤的较弱信号。研究人员发现,使用酸敏感纳米颗粒在肿瘤环境中积累铜-64可以提供更清晰的肺部肿瘤图像。
迈向癌症筛查(Toward cancer screening)
如果批准用于人类患者,桑吉塔·巴蒂亚设想这种诊断方法可用于评估患者对治疗的反应程度,以及长期监测肿瘤复发或转移,尤其是结肠癌。
桑吉塔·巴蒂亚说:“例如,可以每六个月对这些患者进行一次尿液检测。如果尿液检测呈阳性,他们可以使用相同试剂的放射性版本进行后续成像研究,以显示疾病的传播位置。我们还相信,利用单一配方的两种测试模式可能会加快监管路径。”
从长远来看,她希望这项技术可以用作诊断工作流程的一部分,可以定期检测任何类型的癌症。
桑吉塔·巴蒂亚说:“我们的愿景是,您可以在筛查范式中使用它——单独或与其他测试结合使用——我们可以共同接触当今无法获得昂贵筛查基础设施的患者。每年您都可以进行尿检,作为一般检查的一部分。只有当尿检结果呈阳性时,您才会进行影像学检查,然后找出信号的来源。为了实现这一目标,我们在科学上还有很多工作要做,但从长远来看,这就是我们想要去的地方,也是我们的最终目标。”
由桑吉塔·巴蒂亚共同创立的公司Glympse Bio已经对早期版本的尿液诊断微粒进行了1期临床试验,并发现它们对患者是安全的。
该研究由来自美国国家癌症研究院科赫研究所的核心资助(Koch Institute Support (core) Grant from the National Cancer Institute)、美国国家环境健康科学研究所(National Institute of Environmental Health Sciences)、科赫研究所的马布尔癌症纳米医学中心(Koch Institute’s Marble Center for Cancer Nanomedicine)以及霍华德·休斯医学研究所(Howard Hughes Medical Institute)的资助。上述介绍仅供参考,欲了解更多信息敬请注意浏览原文或者相关报道。
Therapeutic outcomes in oncology may be aided by precision diagnostics that offer early detection, localization and the opportunity to monitor response to therapy. Here, we report a multimodal nanosensor engineered to target tumours through acidosis, respond to proteases in the microenvironment to release urinary reporters and (optionally) carry positron emission tomography probes to enable localization of primary and metastatic cancers in mouse models of colorectal cancer. We present a paradigm wherein this multimodal sensor can be employed longitudinally to assess burden of disease non-invasively, including tumour progression and response to chemotherapy. Specifically, we showed that acidosis-mediated tumour insertion enhanced on-target release of matrix metalloproteinase-responsive reporters in urine. Subsequent on-demand loading of the radiotracer 64Cu allowed pH-dependent tumour visualization, enabling enriched microenvironmental characterization when compared with the conventional metabolic tracer 18F-fluorodeoxyglucose. Through tailored target specificities, this modular platform has the capacity to be engineered as a pan-cancer test that may guide treatment decisions for numerous tumour types.
转载本文请联系原作者获取授权,同时请注明本文来自诸平科学网博客。
链接地址:https://m.sciencenet.cn/blog-212210-1295951.html?mobile=1
收藏


