美国纽约大学医学院Zhe S. Chen教授和Jing Wang教授首次实现了对急慢性疼痛感知信息的实时解码以及光遗传刺激反馈,从而达到了对疼痛的实时闭环调控与治疗。
北京时间2021年6月21日晚23时,国际学术期刊Nature Biomedical Engineering在线发表了这一研究成果。
纽约大学的张巧生博士为第一作者, 纽约大学神经所的Zhe S. Chen教授和Jing Wang教授为共同通讯作者。

急性及慢性疼痛长期以来困扰着许多成年人的生活。由于大脑对疼痛的调控机制异常复杂,对疼痛的诊断缺少有效的客观依据,进而导致当代社会上阿片类止疼药物的泛滥。而长期连续地药物治疗,不仅会降低止疼效果,还会带来药物成瘾以及过量使用导致死亡的一系列社会危机。因此,研究可替代药物的新疼痛治疗方法非常重要。近年来, 由于新型脑电记录技术和机器学习的长足发展,新兴的脑机接口技术给疼痛的诊断和治疗带来了新的思路。
纽约大学的研究团队通过在线采集大鼠前扣带回皮层(Anterior Cingulate Cortex, ACC)神经集群锋电位信号,利用无监督的相空间模型算法分析,首次实现了对急慢性疼痛感知信息的准确解码,进而通过光遗传刺激前额叶皮层(Prelimbic Prefrontal Cortex, PFC)的锥体神经元,激活自身的疼痛抑制环路,最终达到了对疼痛的实时闭环调控与治疗。
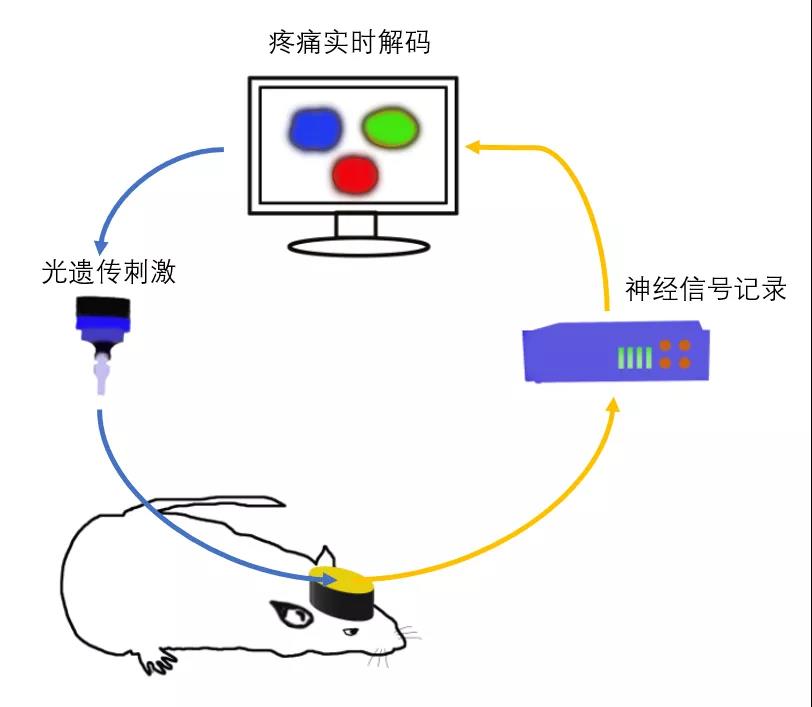
疼痛包含直觉的感觉层面以及疼痛导致的厌恶情感层面。和听觉和视觉系统不同,中枢神经系统的大脑没有特异的痛觉调控皮层。这给疼痛的解码带来了极大的挑战。急慢性疼痛会引起大脑复杂的多脑区联合调控,而前扣带回皮层在疼痛的调控方面发挥着至关重要的作用。
该研究将32通道的高生物相容性硅电极阵列植入到大鼠的ACC脑区,经过对高频神经信号的放大、滤波以及分类等预处理,神经集群锋电位的发放率特征被用于相空间模型的训练。研究发现无监督的状态空间模型能够准确地预测出大鼠的疼痛时间,在急性的热疼痛和机械刺激疼痛实验中,模型的在线神经解码准确率分别可以达到80%和60%。
Jing Wang教授课题组过去的研究表明,PFC脑区的激活可以激发内生性的疼痛抑制环路。该研究利用光遗传学技术,将含有光敏通道蛋白(Channelrhodopsin)基因的病毒载体转染到大鼠的PFC脑区的锥体神经元中,并植入一根直径200 微米的光纤。在热刺激疼痛脑机接口的实验中,脑机接口在线预测的疼痛状态后会实时触发对PFC脑区锥体神经元的光基因兴奋性调控,缓解了大鼠的疼痛状态。这反映在行为学上是大鼠的痛觉诱导缩腿延迟时间增加了,达到了和对照组手动触发的光刺激相似的治疗效果。
“传统的侵入性脑机接口技术主要集中在运动神经系统,我们的研究是在感官神经系统脑机接口研究领域的重大突破”,Zhe. S. Chen教授评价道。
论文的研究证明,实时脑机接口不仅可以用于疼痛的感觉调控,还可用于对疼痛中厌恶情绪的调控,在经典的条件偏好性检验中得到了很好的验证。在实验中,大鼠可以在两个互通的盒子里自由探索走动,其单腿分别接受相同强度的急性机械痛刺激。不同的是,当大鼠进入一个盒子中,研究人员打开脑机接口,即算法检测到疼痛后会触发PFC短暂的光刺激,而大鼠进入到另外一个盒子中,大鼠脑机接口处于关闭状态或随机触发PFC同等数量和强度的光刺激。
研究发现和对照盒子相比,大鼠更偏好于留在脑机接口处于打开状态的盒子中,表明该脑机接口对大鼠疼痛厌恶情绪的在线调控。此外,研究人员发现该脑机接口可以调控慢性疼痛中的自发性疼痛,这给慢性疼痛的治疗带来了希望。
该研究初步实现了一种可以用于急慢性疼痛调控的在线闭环脑机接口原型。“由于该脑机接口没有导致明显的副作用,此新技术为大脑疼痛机制的研究打开了一扇窗口,同时为急慢性疼痛的客观检测以及非药物性替代治疗带来新的曙光”,文章的第一作者张巧生博士评论道。
相关论文信息:
https://doi.org/10.1038/s41551-021-00736-7
转载本文请联系原作者获取授权,同时请注明本文来自小柯生命科学网博客。
链接地址:https://m.sciencenet.cn/blog-3423233-1292209.html?mobile=1
收藏


