嵌合抗原受体(chimeric antigen receptor, CAR)细胞疗法,是一种通过基因编辑技术来改造免疫细胞,从而有效的识别、攻击和消灭肿瘤细胞的特殊免疫疗法。近年来,鉴于已批准的CAR-T疗法在血液肿瘤中获得的良好疗效,针对不同CAR设计、不同CAR细胞疗法靶标和不同肿瘤类型等的临床试验数量出现了指数增长【1】。然而,CAR细胞疗法的严重甚至危及生命的毒性,如靶向非肿瘤效应(on-target, off-tumor effects)和细胞因子风暴,成为阻碍其广泛应用和发展的重要因素之一【1,2】。
此外,目前针对CAR细胞疗法毒性的报道大部分都是关于CD19 CAR-T和BCMA CAR-T这两种已经批准的疗法。因此,全面鉴定正在临床试验测试的和潜在的CAR细胞疗法的毒性和开发一个便于研究者进行快速检索的数据平台,将有利于加深研究者们对CAR细胞疗法的理解,极大的推动该疗法的进一步发展和应用,使更多肿瘤患者可以从中获益。
北京时间2021年10月21日晚23时,美国Texas A&M大学韩冷教授和上海交通大学医学院临床研究中心景莹副研究员合作在Cancer Cell上以Letter的形式发表题为“Expression of chimeric antigen receptor therapy targets detected by single-cell sequencing of normal cells may contribute to off-tumor toxicity”的研究。 该研究利用了两个独立的包含多种正常人类组织的单细胞RNA测序 (scRNA-seq) 数据集(human cell landscape, HCL【3】 和adult human cell atlas, AHCA【4】),从单细胞层面全面的评估CAR细胞疗法的单靶标和双靶标在多种组织中的不同细胞群中的表达/共表达水平,从靶向非肿瘤效应的角度来评估该CAR靶标的潜在毒性风险。作者们还开发了一个可供研究者对感兴趣的CAR细胞疗法单靶标和双靶标进行直接搜索的在线数据库。 该研究首次从多种正常组织的单细胞表达水平来全面的绘制CAR细胞疗法靶标的毒性图谱,将为CAR细胞疗法的设计提供新的参考和思路。
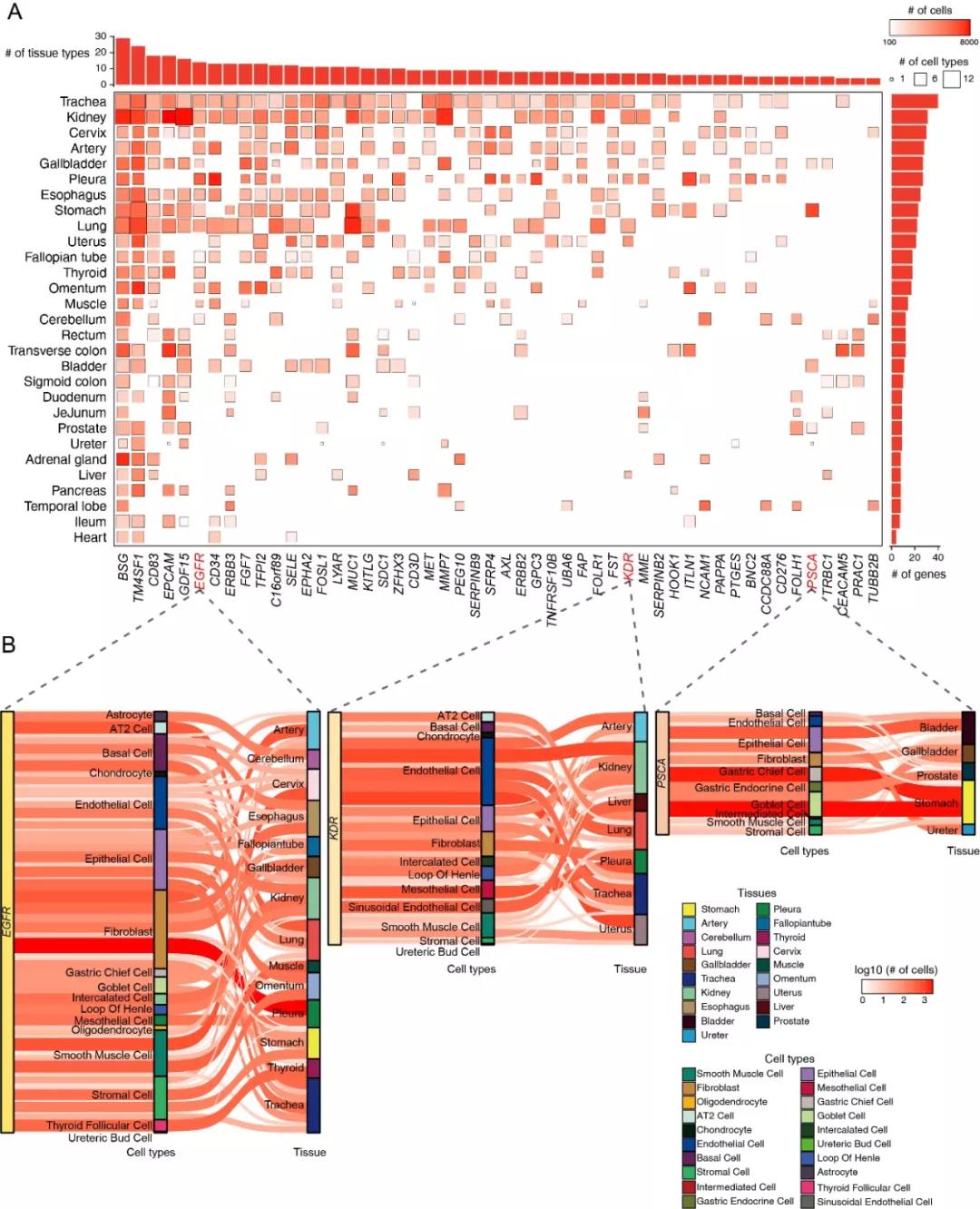
图1. CAR靶标基因在多种组织中的单细胞层面表达情况。(A) 前50潜在高毒性风险的CAR靶标在不同组织中的表达细胞数量热图。(B) 表达PSCA,EGFR,KDR的细胞在不同组织和细胞类型的分布情况。
该研究中,作者们分析了2个已经批准的和69个已经在临床试验中测试的CAR细胞疗法靶标以及以前的研究预测的相对安全的520个潜在CAR靶标【1】。通过分析两个独立的单细胞样本集的342,755和84,363个细胞中CAR靶标表达水平,作者们发现分别有92个(来自HCL)和88个(来自AHCA)靶标在超过三个正常组织中有超过100个和2%的细胞中表达,提示这些靶标的潜在靶向非肿瘤效应相关毒性风险高,并且该两个单细胞数据集鉴定到的高风险CAR靶标基因高度重合。值得注意的是,bulk层面的数据分析提示CAR靶标在某些组织低表达【1】,而作者们采用的单细胞分析方法却鉴定出这些CAR靶标在特定组织中部分细胞群中表达,例如,EGFR、KDR、PSCA等基因(图1)。
作者们还进一步分析了CAR logical ‘and’设计的双靶标中的两个基因在单细胞层面的共表达情况,鉴定出多个潜在的毒性风险双靶标。为了方便研究者们根据自己研究的特点来利用该研究结果,作者们开发了一个CAR靶标基因单细胞毒性平台(https://hanlab.tamhsc.edu/CARTSC/)。研究者可以直接浏览和搜索单个CAR靶标和CAR双靶标在多个组织中单细胞层面的表达水平,还能够根据自己的研究改变阈值来定义潜在高毒性风险的CAR靶标和组织。该研究将极大的促进和帮助研究者设计出毒性较低的CAR细胞疗法,也为医生和患者提前预判特定CAR细胞疗法出现毒性的风险组织提供了强有力的理论依据。
景莹副研究员(www.yingjinglab.com)为该文的第一作者和共同通讯作者,韩冷教授课题组刘源博士为该文的共同第一作者,韩冷教授为该文的通讯作者。叶幼琼,Yun Huang,Yubin Zhou,Michael R. Green,Gordon B. Mills等教授也对此文做出了大量贡献。
相关论文信息:
https://doi.org/10.1016/j.ccell.2021.09.016
景莹副研究员和韩冷教授近年来在免疫治疗领域发表了一系列原创性研究,如癌症免疫治疗中irAE的生物标志物(2020, Nature Communications)、癌症免疫治疗的irAE性别相关差异(2021,Journal of the National Cancer Institute)。此项工作是两位研究者及其团队在该领域的又一项成果。
韩冷教授研究组(https://ibt.tamu.edu/faculty/leng-han.html)一直致力于利用生物大数据研究癌症等复杂疾病的致病机理。其研究团队利用TCGA等大规模数据深入研究了癌症的发生机制和药物反应,以通讯作者身份在Cancer Cell, Nature Metabolism, Nature Immunology, Nature Communications, JNCI等杂志发表多篇论文, 并为Nature Biotechnology, Nature Metabolism, Trends series等杂志撰写评论及综述文章。课题组已培养出PI若干名。课题组长期招聘研究生及博士后,欢迎感兴趣的同学加盟或来函咨询 (leng.han@tamu.edu)。
参考文献
1.MacKay, M. et al. The therapeutic landscape for cells engineered with chimeric antigen receptors. Nat. Biotechnol. 38, 233–244 (2020). 2.Dougan, M., Luoma, A. M., Dougan, S. K. & Wucherpfennig, K. W. Understanding and treating the inflammatory adverse events of cancer immunotherapy. Cell 184, 1575–1588 (2021). 3.Han, X. et al. Construction of a human cell landscape at single-cell level. Nature 581, 303–309 (2020). 4.He, S. et al. Single-cell transcriptome profiling of an adult human cell atlas of 15 major organs. Genome Biol. 21, 1–34 (2020).
转载本文请联系原作者获取授权,同时请注明本文来自小柯生命科学网博客。
链接地址:https://m.sciencenet.cn/blog-3423233-1308976.html?mobile=1
收藏


