博文
专家点评Cell!耶鲁大学团队揭秘B细胞与T细胞合作抗肿瘤机制
||
北京时间2021年12月1日凌晨0时,美国耶鲁大学医学院Joseph Craft和Nikhil Joshi团队(第一作者为耶鲁大学医学院免疫系在读博士生崔璨, Can Cui)于Cell上发表了题为“Neoantigen-driven B cell and CD4 T follicular helper cell collaboration promotes anti-tumor CD8 T cell responses”的研究论文。
该研究通过在KRAS突变/P53缺失 (KP) 肺腺癌模型中引入B细胞与T细胞共识别抗原,发现B细胞对于诱导肿瘤抗原特异性的滤泡辅助性CD4 T细胞 (T follicular helper cells, 以下简称TFH细胞) 及抗肿瘤免疫应答有重要作用。TFH细胞分泌细胞因子白细胞介素-21 (interleukin-21, 以下简称IL-21),促进肿瘤浸润CD8 T细胞产生颗粒酶B (granzyme B), 进而杀伤肿瘤。

肿瘤微环境中存在大量包括B细胞和T细胞在内的免疫细胞。过去十余年中,多项研究表明B细胞和CD4 T细胞对抗肿瘤免疫反应起着至关重要的作用,与多种实体瘤临床预后及免疫治疗效果密切相关【1,2】。值得关注的是,这些与预后正相关的B细胞大多存在于肿瘤相关淋巴结 (tumor-draining lymph nodes) 与三级淋巴组织 (tumor-associated tertiary lymphoid structures)中。例如,2020年三篇Nature文章与一篇Cell文章报道了在大型临床队列研究样本及小鼠模型中,B细胞浸润及其相关T细胞免疫应答对抗肿瘤免疫起重要作用【3-6】。但是,对于这一临床现象的生物学机制,目前的认识还十分有限。探讨肿瘤微环境中抗原特异性B细胞及T细胞分化及其相互作用机制成为领域内的研究热点。
在最新这项研究中,作者首先分析了来源于The Cancer Genome Atlas (TCGA) 的肺腺癌临床队列,发现TFH细胞和生发中心B细胞 (germinal center B cell)与临床预后正相关,并通过分析单细胞测序数据,进一步阐明了肺癌肿瘤及淋巴组织B细胞及CD4 T细胞的基因表达特征。为深入理解这一临床现象的病生理机制,作者建立了肺腺癌小鼠模型KP-HELLO,在KRAS突变/P53缺失 (KP) 模型的基础上,引入了B细胞与T细胞共识别嵌合抗原 (conjugated B cell- and CD4 T cell-recognized neoantigens),由常用B细胞抗原Hen Egg Lysozyme (HEL), 与T细胞抗原LCMV GP33-43/GP61-80共同组成。与之对照,作者使用了已发表的KP-NINJA肺腺癌模型【7,8】,与KP-HELLO含有完全相同T细胞抗原LCMV GP33-43/GP61-80,但不含B细胞可识别抗原表位。通过流式细胞术,对比KP-HELLO与KP-NINJA模型免疫应答,作者发现B细胞抗原表位对于TFH细胞诱导有必要作用。通过构建和使用B细胞缺失 (uMT)与TFH细胞缺失 (CD4-Cre Bcl6fl/fl) 小鼠模型,及过继输入(adoptively transfer) 抗原特异性B细胞或CD4 T细胞以重建免疫系统的实验,作者发现肿瘤抗原特异性B细胞与TFH细胞对于抑制肿瘤生长均有重要作用。对肿瘤浸润CD8 T细胞的分析表明了这一抗肿瘤作用依赖于效应性CD8 T细胞,尤其是颗粒酶B的产生。
来自该课题组及其他既往研究发现,在慢性感染及肿瘤中,IL-21对于干性前体TCF1+CD8 T细胞 (stem-like CD8 T cells)向效应性CD8 T细胞分化作用非常关键【9-13】,而由TFH细胞分泌的最典型的功能性细胞因子为IL-21【14-16】,且二者均存在于肿瘤组织及相关淋巴结【17,18】。那么,是否IL-21是介导TFH细胞抗肿瘤作用的关键分子?为此,作者使用了IL-21-Katushka reporter小鼠,确认了IL-21的主要来源为TFH细胞。通过分析IL-21 受体缺失小鼠,作者发现,控制KP-HELLO肿瘤生长及效应性CD8 T细胞颗粒酶B的生成均依赖于IL-21通路。此外,作者构建并使用了B细胞缺失的IL-21 Katushka reporter小鼠 (uMT×IL21Kat),且分析了B细胞抗原缺失的KP-NINJA模型中IL-21的表达,阐明了B细胞识别抗原-B细胞-TFH细胞轴对于IL-21生成的重要作用 (图1)。
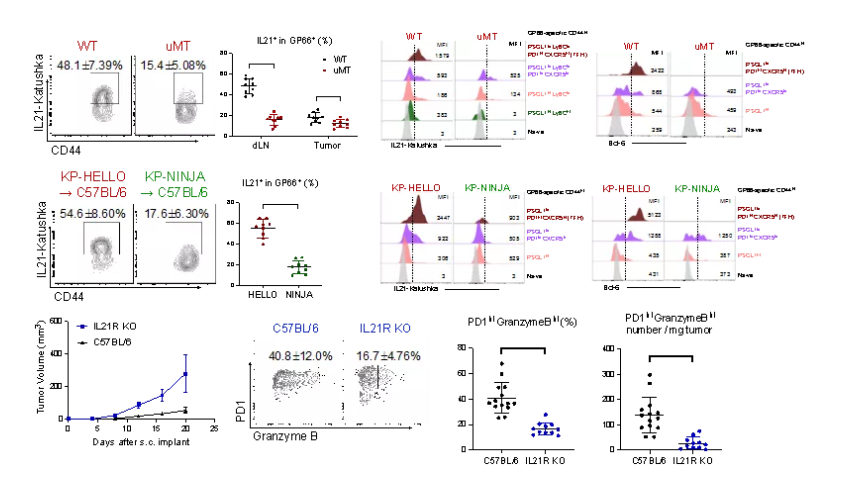
综上,此研究首次在肿瘤模型中分析了B细胞与TFH细胞相互作用的分子与细胞机制,揭示了B细胞与T细胞共识别抗原对诱导B细胞与TFH细胞合作的关键作用,证实了TFH细胞来源的细胞因子IL-21的重要抗肿瘤机制。这些发现对于加强现有免疫疗法治疗效果,设计新型肿瘤免疫疗法,如肿瘤疫苗,PD-1抗体和IL-21融合蛋白等,提供了借鉴价值 (图2)。

专家点评
王盛典(中国科学院生物物理研究所)
机体抗肿瘤免疫主要由肿瘤特异性CD8+ T细胞介导,CD4+ T细胞在抗肿瘤免疫中也发挥重要作用,主要是通过多种机制辅助CD8+ T细胞反应,传统认为CD4+ T细胞对CD8+ T细胞反应的辅助作用主要由CD4+ Th1细胞介导。滤泡辅助性CD4+ T细胞(TFH)主要介导B细胞反应,参与抗体反应。大量研究发现肿瘤患者体内的TFH细胞与患者的预后和长期生存具有很强的相关性,但是TFH细胞在机体抗肿瘤免疫中的作用尚不清楚。B细胞也是一种抗原递呈细胞,很多肿瘤有丰富的B细胞浸润,尤其是在肿瘤相关的三级淋巴结构中,但是,关于B细胞在机体抗肿瘤免疫中的作用研究很少。
12月1日,Cell杂志在线发表了耶鲁大学医学院Joseph Craft及Nikhil Joshi团队的研究论文“Neoantigen-driven B cell and CD4 T follicular helper cell collaboration promotes anti-tumor CD8 T cell responses”。该论文精妙地设计并建立了表达B细胞和T细胞识别的肿瘤新抗原的小鼠肿瘤模型,并结合相应的B细胞受体(BCR)和T细胞受体(TCR)转基因小鼠模型,分析肿瘤引流淋巴结和肿瘤组织中肿瘤抗原特异性B细胞和CD4+ T(TFH)细胞反应,研究它们在抗肿瘤CD8+ T反应中的作用,发现呈递肿瘤抗原的B细胞能促进肿瘤特异性TFH细胞的分化,通过TFH产生IL-21,增强抗肿瘤CD8+ T细胞反应,从而控制肿瘤生长。
该论文研究具有以下亮点和启示:
1. 本该研究首次证实了B细胞可识别肿瘤抗原,并发生活化,从而促进肿瘤特异性TFH细胞的增殖和分化,增强抗肿瘤CD8+ T细胞反应。目前肿瘤疫苗的设计主要集中于MHC I类抗原表位,有研究尝试加入MHC II类抗原表位,增强抗肿瘤免疫反应。基于该研究结果,加入能促进TFH细胞分化的B细胞识别的肿瘤抗原表位,将是肿瘤疫苗设计的一种新策略。
2. 2009年6月一期Science杂志并列发表三篇研究论文【11-13】,发现IL-21对慢性病毒感染中CD8+ T细胞的功能具有重要作用,因缺乏明确的机制,IL-21的这一作用没有引起关注。该论文研究可能为IL-21在慢性病毒感染中的这一作用提供了理论机制,并为慢性病毒感染和肿瘤中抗原特异性CD8+ T细胞功能衰竭研究提供新的思路。
3. CD4+ T细胞在抗肿瘤和病毒感染中的作用研究主要集中Th1细胞,其中最重要的发现是:在病毒感染模型中,记忆性CD8+ T细胞的形成依赖于CD4+ T 细胞的辅助,但机制不清楚。IL-21已被证实是促进干性记忆性CD8+ T细胞(stem-like/memory CD8+ T cells)的T细胞生长因子,因此,CD4+ T细胞对记忆性CD8+ T细胞形成的辅助作用,可能是通过TFH细胞介导。细胞因子在肿瘤免疫治疗中的应用主要集中于IL-2,但是IL-2是TFH分化最强的抑制剂。而且有研究证实:用IL-21培养扩增的肿瘤特异性T细胞进行肿瘤过继治疗,治疗效果显著优于用IL-2培养的终末分化的T细胞。该论文研究进一步表明:IL-21可能是比IL-2更有价值的肿瘤免疫治疗药物研发靶点。
伍拓琦(美国德克萨斯大学西南医学中心免疫系)
肿瘤免疫疗法,如免疫检验点抑制剂 (immune checkpoint blockade),对非小细胞肺癌在内的实体瘤治疗有着划时代影响,但仅有一小部分的病人在治疗后能够产生持久性的免疫应答。因此,研究肿瘤微环境中免疫细胞及炎症因子的相互作用,理解细胞分化机制,能够帮助我们研发更加有效的免疫疗法及提高现有治疗的疗效。迄今对抗肿瘤免疫应答的研究主要集中在CD8 T细胞。最近在黑色素瘤和肉瘤病人中的研究显示肿瘤浸润B细胞以及三级淋巴组织与免疫检验点抑制剂疗效正相关。然而B细胞和CD4 T细胞亚型如何影响CD8 T 细胞的抗肿瘤免疫反应了解仍然不多。
今日在线的Cell文章中,来自耶鲁大学Joseph Craft及Nikhil Joshi课题组的Can Cui等利用KRAS突变肺癌小鼠模型,研究了不同类型肿瘤抗原对于CD4 T细胞分化的特殊作用,深入探讨了B细胞和CD4 T细胞亚型——滤泡辅助性T细胞 (TFH) 相互作用对于产生细胞因子IL-21及诱导有效肿瘤免疫应答的意义,并验证了十余年间多篇文章所报道的CD4 T细胞来源的IL-21对于效应性CD8 T 细胞功能的关键作用【9-13】。
这一工作有以下几个亮点: 首先,B细胞最为人熟知的作用是产生抗体及维持体液免疫记忆。此工作在肿瘤相关淋巴组织中阐明了B细胞的另一重要作用,即作为肿瘤抗原的呈递细胞,诱导TFH细胞分化和IL-21分泌,进而维持效应性CD8 T 细胞的功能。其次,通过引入B细胞-T细胞共识别抗原,Can Cui等首次建立了研究B细胞和TFH细胞相互作用的肿瘤模型,为进一步探讨肿瘤抗原性质,细胞免疫机制,以及开发免疫治疗潜在药物靶点提供了新的平台。笔者认为由此可延伸的研究包括:1)该文所用的肺癌小鼠模型是否会生成与肿瘤病人中细胞组成和解剖结构类似的三级淋巴组织?这种三级淋巴组织所需的信号是什么?2)B细胞,滤泡辅助性T细胞,以及CD8 T 细胞在活体内相互作用的动态是怎样的?发生相互作用的位置是在淋巴结、肺内三级淋巴组织、还是肿瘤组织内部?
相关论文信息:
https://doi.org/10.1016/j.cell.2021.11.007
参考文献
1,Sautes-Fridman, C., Petitprez, F., Calderaro, J. & Fridman, W. H. Tertiary lymphoid structures in the era of cancer immunotherapy. Nat Rev Cancer 19, 307-325, doi:10.1038/s41568-019-0144-6 (2019).
2,Sharonov, G. V., Serebrovskaya, E. O., Yuzhakova, D. V., Britanova, O. V. & Chudakov, D. M. B cells, plasma cells and antibody repertoires in the tumour microenvironment. Nat Rev Immunol 20, 294-307, doi:10.1038/s41577-019-0257-x (2020).
3,Helmink, B. A. et al. B cells and tertiary lymphoid structures promote immunotherapy response. Nature 577, 549-555, doi:10.1038/s41586-019-1922-8 (2020).
4,Cabrita, R. et al. Tertiary lymphoid structures improve immunotherapy and survival in melanoma. Nature 577, 561-565, doi:10.1038/s41586-019-1914-8 (2020).
5,Petitprez, F. et al. B cells are associated with survival and immunotherapy response in sarcoma. Nature 577, 556-560, doi:10.1038/s41586-019-1906-8 (2020).
6,Lu, Y. et al. Complement Signals Determine Opposite Effects of B Cells in Chemotherapy-Induced Immunity. Cell 180, 1081-1097 e1024, doi:10.1016/j.cell.2020.02.015 (2020).
7,Damo, M. et al. Inducible de novo expression of neoantigens in tumor cells and mice. Nat Biotechnol, doi:10.1038/s41587-020-0613-1 (2020).
8,Fitzgerald, B. et al. A mouse model for the study of anti-tumor T cell responses in Kras-driven lung adenocarcinoma. Cell Rep Methods 1, doi:10.1016/j.crmeth.2021.100080 (2021).
9,Zander, R. et al. CD4(+) T Cell Help Is Required for the Formation of a Cytolytic CD8(+) T Cell Subset that Protects against Chronic Infection and Cancer. Immunity 51, 1028-1042 e1024, doi:10.1016/j.immuni.2019.10.009 (2019).
10,Xin, G. et al. A Critical Role of IL-21-Induced BATF in Sustaining CD8-T-Cell-Mediated Chronic Viral Control. Cell Rep 13, 1118-1124, doi:10.1016/j.celrep.2015.09.069 (2015).
11,Yi, J. S., Du, M. & Zajac, A. J. A vital role for interleukin-21 in the control of a chronic viral infection. Science 324, 1572-1576, doi:10.1126/science.1175194 (2009).
12,Elsaesser, H., Sauer, K. & Brooks, D. G. IL-21 is required to control chronic viral infection. Science 324, 1569-1572, doi:10.1126/science.1174182 (2009).
13,Frohlich, A. et al. IL-21R on T cells is critical for sustained functionality and control of chronic viral infection. Science 324, 1576-1580, doi:10.1126/science.1172815 (2009).
14,Poholek, A. C. et al. In vivo regulation of Bcl6 and T follicular helper cell development. J Immunol 185, 313-326, doi:10.4049/jimmunol.0904023 (2010).
15,Crotty, S. Follicular helper CD4 T cells (TFH). Annu Rev Immunol 29, 621-663, doi:10.1146/annurev-immunol-031210-101400 (2011).
16,Weinstein, J. S. et al. STAT4 and T-bet control follicular helper T cell development in viral infections. J Exp Med 215, 337-355, doi:10.1084/jem.20170457 (2018).
17,Connolly, K. A. et al. A reservoir of stem-like CD8 T cells in the tumor-draining lymph node maintains the ongoing anti-tumor immune response. bioRxiv, 2021.2001.2027.428467, doi:10.1101/2021.01.27.428467 (2021).
18,Schenkel, J. M. et al. Conventional type I dendric cells maintain a reservoir of proliferative tumor-antigen specific TCF-1(+) CD8(+) T cells in tumor-draining lymph nodes. Immunity, doi:10.1016/j.immuni.2021.08.026 (2021).
https://m.sciencenet.cn/blog-3423233-1314678.html
上一篇:香港科大王吉光团队开发MetaNet预测肿瘤转移的器官亲和性
下一篇:四川大学黄灿华团队报道氧化还原蛋白CypA介导结直肠癌耐药的分子机制