博文
《自然》:李明实验室揭示一种免疫抗癌新机制
 精选
精选
||
北京时间2022年4月20日晚23时,美国纪念斯隆凯特琳癌症中心李明教授实验室,在《自然》杂志发表题为“Programme of self-reactive innate-like T cell-mediated cancer immunity”的研究论文,揭示了一种免疫抗癌新机制。
周骏博士、张晛博士为论文共同第一作者,李明教授为通讯作者。

癌症免疫监测 (Cancer immunosurveillance) 主要依赖传统 (conventional) CD8 T细胞识别肿瘤新生抗原 (Neoantigen) 进而杀伤癌细胞。然而癌细胞能通过上调具有免疫抑制功能的PD-1配体(PD-L1)与传统CD8 T细胞中的PD-1受体相互作用,使T细胞的效用功能 (effector function) 减少,甚至丧失,从而诱导T细胞耗竭 (T cell exhaustion)。近十年,利用靶向抗体抑制PD-1或PD-L1来恢复传统T细胞效用功能的免疫疗法已经在临床上取得一定的成效,并因此荣获2018诺贝尔生理医学奖。至此,研发更多针对传统T细胞的检查点抑制剂 (Checkpoint blockade) 成为肿瘤免疫疗法的主导思路。
然而,尽管研究人员和临床肿瘤专家对免疫检查点抑制疗法抱有很大的希望,其疗效却往往受制于肿瘤新生抗原量。因此不是所有类型的癌症都适用,并且只有少部分患者能受惠于该疗法。利用单细胞转录组测序技术,许多团队发现在小鼠模型与癌症患者的肿瘤组织中其实充斥着种类繁多的肿瘤浸润T细胞。然而,除了高表达PD-1的CD8 T细胞外,我们对于其他T细胞在癌症免疫监测中的作用却知之甚少。
在最新这项研究中,研究团队首先在小鼠乳癌模型(PyMT)发现一种缺乏PD-1却高表达自然杀伤细胞(Natural Killer Cell)受体的类先天性杀伤型T细胞(Killer Innate-like T cell, ILTCK)。虽然ILTCK和传统 CD8 T细胞都表达T细胞受体(T cell receptor),前者的激活却不依赖树突细胞(Dendritic Cell),此特性使其更接近先天性淋巴细胞(Innate lymphoid cell)。不同于传统 CD8 T细胞,ILTCK不表达PD-1和其他免疫抑制受体,因此不会进入细胞耗竭状态,反而对肿瘤细胞有更强大的细胞毒性(cytotoxicity)。其次,大部分的传统 T细胞识别肿瘤新生抗原,而ILTCK识别肿瘤原生抗原,并且具有显著的组织驻留性(tissue residency)。
研究团队发现ILTCK并非分化于初始(naïve)CD8 T细胞,而是独立于传统T细胞的另一细胞谱系。在T细胞分化过程中,绝大部分能够识别宿主原生抗原的T细胞通常能被有效地移除进而避免自体免疫疾病。然而ILTCK识别自体原生抗原的特性却是该细胞谱系分化的关键信号,但此分化机制能够永久抑制ILTCK中T细胞受体的下游信号传递。因此,广泛存在的ILTCK并无法引发自体免疫疾病,反而能够在原生抗原遍布的肿瘤内免于细胞耗竭。
李明团队进一步揭示白细胞介素15(Interleukin-15, IL-15)为癌细胞激活ILTCK的关键因子。研究人员发现正常组织几乎不表达IL-15,然而癌症细胞上调该信号。在癌症细胞内敲除IL-15大幅降低肿瘤浸润ILTCK数量及其效用功能,导致肿瘤快速生长。反之,在ILTCK内增强IL-15信号传递能够有效地抑制肿瘤发生。因此,IL-15是一种新型的危险素(alarmin):ILTCK透过监测该信号的上调进而识别并歼灭机体中潜在的癌症细胞。
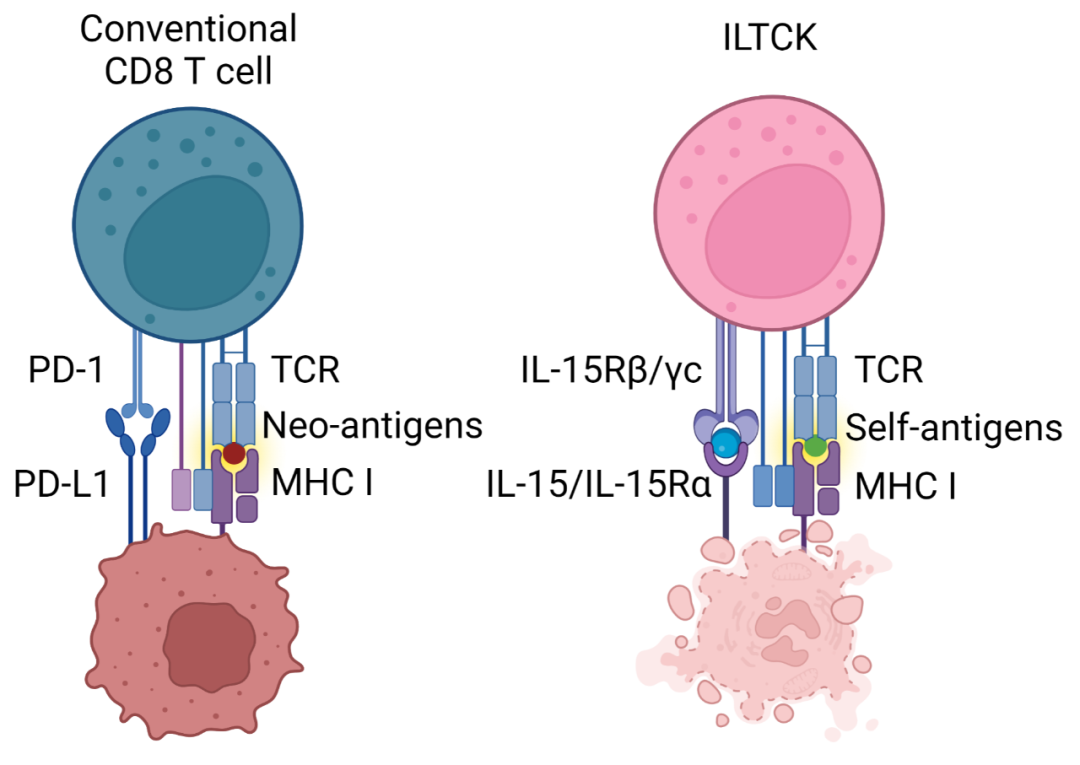
图1。左:CD8 T细胞耗竭肿瘤免疫逃逸。右:IL-15信号激活ILTCK杀伤癌症细胞。
ILTCK的发现为肿瘤免疫疗法提供了一个新的选择。此类细胞在组织驻留性和抗细胞耗竭的能力上都优于传统CD8 T细胞(图一)。现有的T细胞输入疗法,如CAR-T等,大部分选择传统 T细胞作为基底。虽然在治疗血癌上颇有成效,但传统T细胞的弱组织驻留性和易于耗竭的弱点使该疗法对实体肿瘤束手无策。因此,ILTCK作为基底的T细胞输入疗法或许能更有效的抑制实体肿瘤。
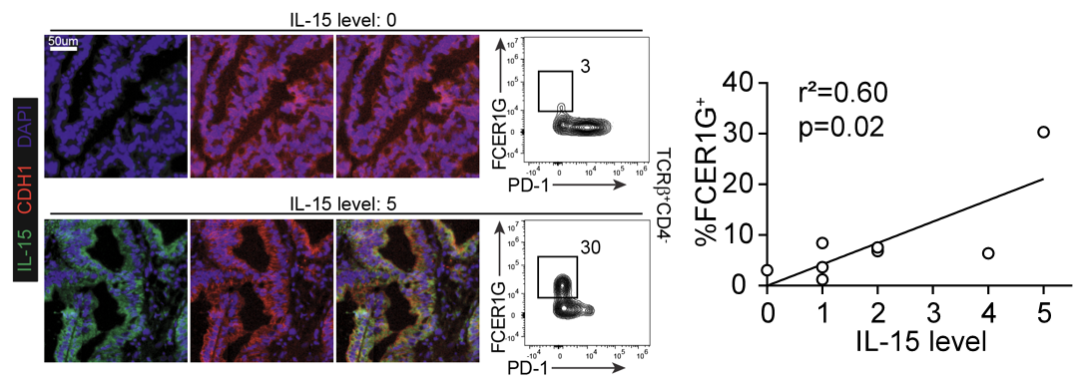
图2。大肠癌患者肿瘤中类似于小鼠ILTCK的T细胞数量与癌症细胞的IL-15表达量之间的关系呈显著正相关。
最后,虽然此研究大部分着重于小鼠模型,作者们在大肠癌患者的组织中也发现类似于ILTCK的T细胞 (图二)。ILTCK的临床转化将成为该研究团队的下一个研究重点。
相关论文信息:
https://doi.org/10.1038/s41586-022-04632-1
https://m.sciencenet.cn/blog-3423233-1334912.html
上一篇:《细胞》:长得像,DNA相近,一定是近亲吗?
下一篇:《细胞—代谢》:闪波/邵孟乐/伍一博等揭示脂肪前体细胞功能异质性及其决定机制