博文
《自然》:斯坦福大学李进/李钦等揭示RNA编辑在炎症性疾病遗传风险中的关键作用
||
北京时间2022年8月3日晚23时,美国斯坦福大学遗传系李进(Jin Billy Li)教授和李钦博士以及合作者在Nature上发表文章“RNA editing underlies genetic risk of common inflammatory diseases”,发现由于遗传因素引起的双链RNA编辑水平的降低,是导致炎症性疾病遗传风险升高的重要因素。

哺乳动物的先天性免疫系统对病毒感染有异常重要的作用。MDA5就是宿主细胞质中存在的双链RNA 感受器,用来抵抗来自病毒的双链RNA,进而产生抗病毒所需的干扰素(IFN,interferon)。然而宿主自身存在的大量双链RNA如何避免被MDA5识别,从而引起不必要的自免疫反应呢?宿主中大量表达的ADAR1蛋白就是这个问题的答案。ADAR1是RNA编辑蛋白,会结合双链RNA并把腺苷(adenosine)编辑成肌酐(inosine)(A-to-I RNA editing)【1】。正常情况下,ADAR1会编辑宿主自身的双链RNA,从而避免被MDA5识别。ADAR1 RNA编辑的核心功能,直至近年才由斯坦福大学的李进教授及合作者们揭示【2】。不具备ADAR1编辑能力的突变体小鼠无法存活超过胚胎期13.5天,并表现出由干扰素免疫应答导致的多器官炎症反应。如果把MDA5基因同时敲除,突变体小鼠几乎恢复得和野生型一样。这项研究阐释了ADAR1编辑的主要作用是标记内源的双链RNA为“自我”,从而避免引发由MDA5介导的干扰素免疫应答和炎症反应(图1)。
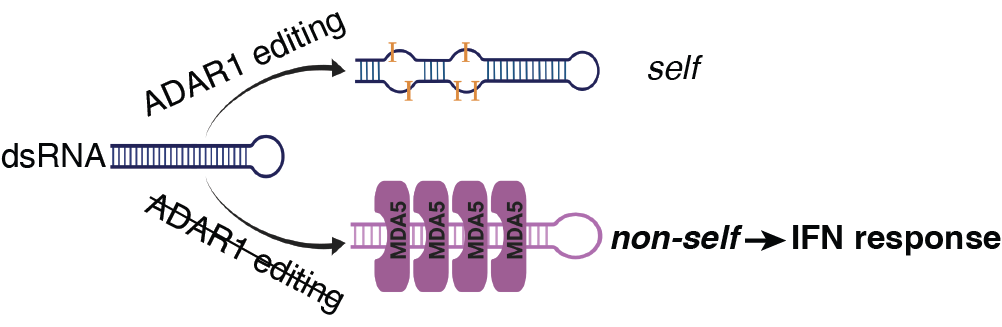
图1.ADAR1-dsRNA-MDA5通路
在人类中,ADAR1功能丧失突变(LOF mutation)或者MDA5功能获得突变(GOF mutation)会导致一些罕见的自身免疫性疾病,比如Aicardi-Goutières综合症(AGS)。类似于ADAR1突变体小鼠,AGS病人变现出剧烈的炎症反应,证明ADAR1-dsRNA-MDA5通路在人类和小鼠中的功能是高度保守的。然而,绝大部分人群的ADAR1和MDA5基因都是正常的,对于ADAR1-dsRNA-MDA5通路在常见疾病中可能扮演的角色一直缺乏系统的认知。
在这项最新研究中,首先,为了搞清楚常见的遗传变异(genetic variation)如何在人体内影响双链RNA的编辑水平,作者在人类组织转录组表达数据库GTEx中开展了顺式RNA编辑性状座位分析(cis-edQTL,cis RNA editing quantitative trait loci,图2)。在49个不同的人体组织中,作者共鉴定了超过3万个对RNA编辑水平有顺式调控作用的edQTL,其中近1/3具有组织特异性。作者发现遗传变异通过改变RNA二级结构,ADAR1结合位点,RNA编辑三联体基序等方式来影响附近的双链RNA的编辑水平。
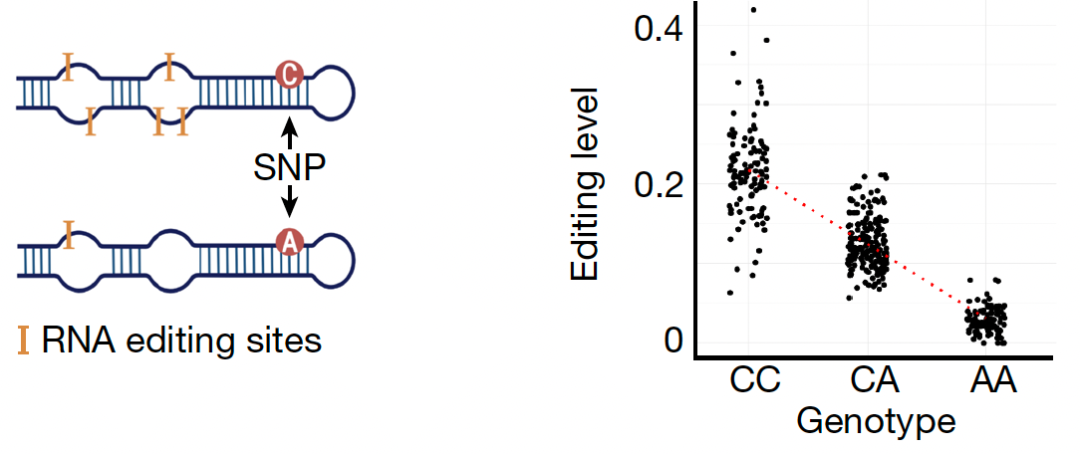
图2. 顺式RNA编辑性状座位
接下来,作者通过与大量人类疾病全基因组关联分析研究(GWAS)数据的联合分析,发现edQTL高度富集于自身免疫性疾病GWAS,例如银屑病、炎性肠病、风湿性关节炎、多发性硬化症、系统性红斑狼疮和I型糖尿病等(图3)。一些非自身免疫,但是和免疫功能有紧密关联的疾病(例如冠心病、肌萎缩侧索硬化症和帕金森综合症)也出现了edQTL的显著富集。有趣的是,edQTL的富集水平在不同的疾病的器官和组织间存在明显差异,尤其以免疫组织和疾病关联组织为最高。

图3.edQTL在炎症性疾病GWAS中的富集
edQTL在GWAS中的高度富集为RNA编辑在炎症性疾病中扮演的关键角色提供了有力的遗传学证据。但是,人体里有数万个可被ADAR1编辑的双链RNA,究竟哪些才是激活MDA5介导的免疫反应的关键底物?哪些又和疾病的发生有密切关联?针对这个问题,作者对17类炎症性疾病和edQTL展开了共定位(colocalization)分析,精确地鉴定了194个与炎症性疾病有高度因果效应的双链RNA,命名为免疫原性双链RNA(immunogenic dsRNA)。
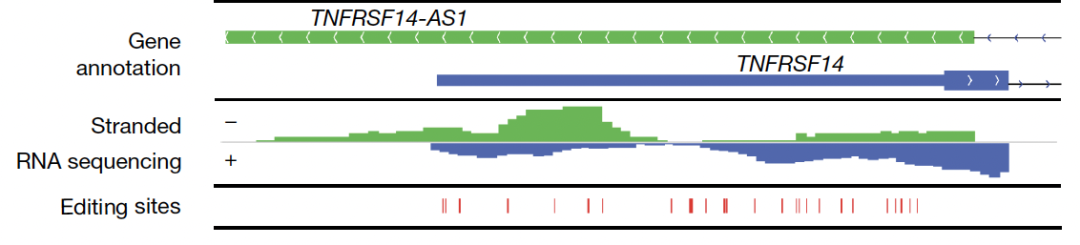
图4. 顺式天然反义转录本双链RNA
人类转录组包含数以百万计的RNA编辑位点,其中95%以上位于反向重复序列(inverted repeats),特别是灵长类独有的Alu重复序列。作者惊讶的发现,27-59%的免疫原性双链RNA与反向重复序列无关,而是源于顺式天然反义转录本(cis-NATs,cis natural antisense transcripts,图4)。在之前的研究中,这种由cis-NATs形成的双链RNA因为非常罕见,并未引起人们的重视。cis-NATs可以在同一基因位点进行反义转录和正义转录,从而形成完美碱基配对的分子间(intermolecular)双链RNA。由于和某些病毒在细胞内转录复制形成的双链RNA具有高度的结构相似性,cis-NATs双链RNA很有可能是MDA5的理想底物。作者通过实验验证发现,cis-NATs双链RNA需要经过ADAR1的超编辑(hyper editing)来抑制免疫原性,否则未编辑的双链RNA将被MDA5识别并引发细胞水平的干扰素免疫应答(图5)。
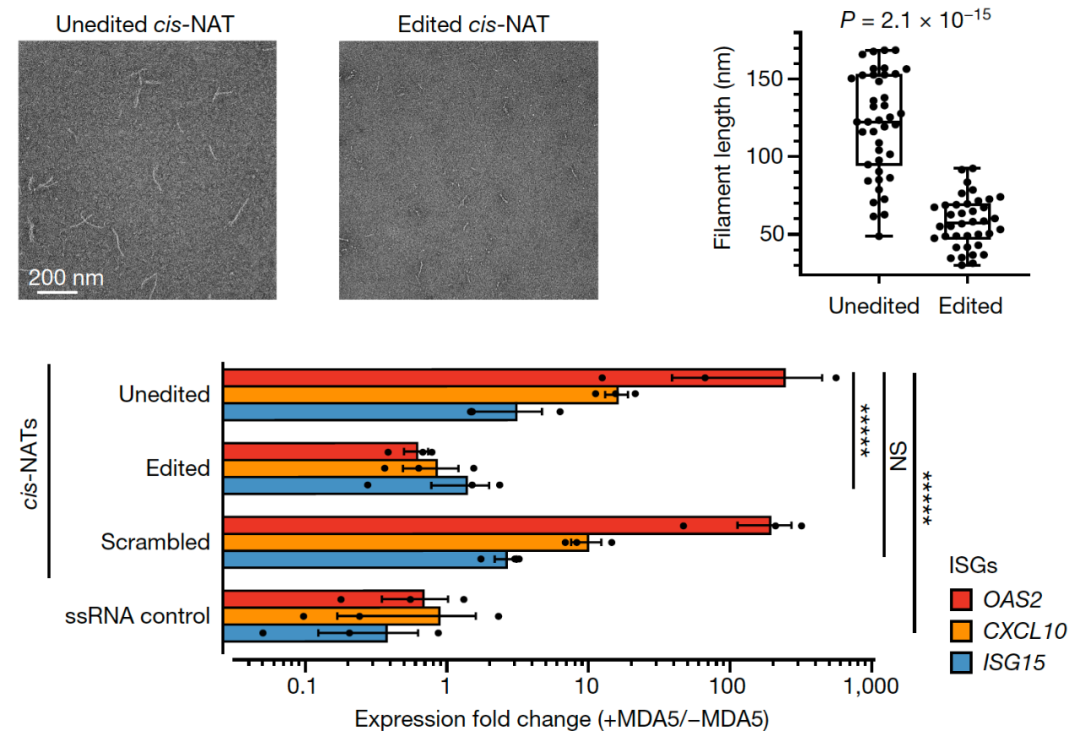
图5. 顺式天然反义转录本双链RNA具有高度免疫原性
遗传变异是如何通过改变免疫原性双链RNA的编辑水平来影响炎症性疾病的风险呢?小鼠和人类的遗传学证据指出,当双链RNA的编辑水平不足时会激发MDA5介导的干扰素免疫应答(图1)。据此,作者提出了如下假设:炎症性疾病的GWAS遗传变异对免疫原性双链RNA编辑的效应并不是随机的,而应具有明显的方向性。具体来说,遗传变异的两组等位基因中,保护等位基因(protective alleles)维持甚至升高目标免疫原性双链RNA的编辑水平,而风险等位基因(risk alleles)则相对的降低编辑水平。如此一来,富集了炎症性疾病GWAS遗传变异的个体体内将积累过多的、编辑不足的免疫原性双链RNA,进而激活MDA5并引发干扰素免疫应答,提高患病风险(图6)。

图6. 遗传变异通过改变免疫原性双链RNA编辑水平引发免疫反应的模式图
为了验证这一假设,作者在全基因组水平无差异的分析了24种疾病的GWAS遗传变异对不同人体组织的免疫原性双链RNA编辑水平的影响。在多个自身免疫性疾病/炎症性疾病中,作者发现了压倒性的方向性效应,既风险等位基因和免疫原性双链RNA编辑水平降低显著相关,且在疾病相关组织中表现得尤为明显。作为对照,这一方向性效应在和免疫无关的疾病/性状中并不显著。
为了进一步在疾病组织中寻找证据,作者对数百个采集自风湿性关节炎、多发性硬化症、系统性红斑狼疮以及冠心病患者的样本进行了等位基因特异性RNA编辑(ASED,allele-specific editing)分析。作者发现在病人样品中,风险等位基因的特异性RNA编辑水平相较于保护等位基因有着显著降低。更重要的是,RNA编辑水平降低和干扰素免疫应答水平升高呈现显著的正相关关系(图7)。这些发现和ADAR1-dsRNA-MDA5通路的分子机理完全吻合。

图7. 等位基因在疾病组织中的对RNA编辑水平的方向性效应
综上所述,本文作者基于完善的ADAR1-dsRNA-MDA5免疫通路,通过人类遗传学研究方法,发现了由遗传变异导致的双链RNA编辑水平下降是引发自身免疫病/炎症性疾病的一个重要机制(图8)。这些常见遗传变异在自身免疫病/炎症性疾病病人体内会同时降低至少数百个免疫原性双链RNA的编辑水平,从而激发了由MDA5介导的干扰素免疫应答,最终引起慢性炎症反应。这一发现为自身免疫病/炎症性疾病的筛查、诊断和治疗提供了新的思路,提示在疾病相关组织和细胞中抑制MDA5的异常激活是一个极具潜力的新靶点。

图8. RNA编辑水平降低是引发炎症性疾病遗传风险的关键机制之一
这项工作由斯坦福大学李进教授实验室的李钦博士主导,得到了斯坦福大学Stephen Montgomery教授实验室和Jonathan Pritchard教授实验室,复旦大学麻锦彪教授实验室以及其他合作者的大力支持。
相关论文信息:
https://doi.org/10.1038/s41586-022-05052-x
参考文献
1.Tan, M. H., et al. (2017). "Dynamic landscape and regulation of RNA editing in mammals." Nature 550(7675): 249-254. 2.Liddicoat, B. J., et al. (2015). "RNA editing by ADAR1 prevents MDA5 sensing of endogenous dsRNA as nonself." Science 349(6252): 1115-1120. 3.Crow, Y. J., et al. (2015). "Characterization of human disease phenotypes associated with mutations in TREX1, RNASEH2A, RNASEH2B, RNASEH2C, SAMHD1, ADAR, and IFIH1." Am J Med Genet A 167A(2): 296-312.
https://m.sciencenet.cn/blog-3423233-1349920.html
上一篇:《自然》:曹义海/杨云龙等发现寒冷通过激活棕色脂肪抑制实体瘤生长
下一篇:《自然—材料》:李松团队报道瞬时核变形启动表观遗传状态并促进细胞重编程