博文
《自然—细胞生物学》:施威扬/鲍志戎团队合作绘制人类胚胎器官发生时期单细胞图谱
||
北京时间2023年3月17日凌晨0时,中国海洋大学施威扬团队与美国纪念斯隆凯特琳癌症研究所鲍志戎团队合作在Nature Cell Biology上发表文章“A single-cell transcriptome atlas profiles early organogenesis in human embryos”。
该研究构建了人类胚胎在器官发育初期(4~6周)的单细胞转录组和空间转录组图谱,深度刻画了各个器官最初的特异的祖先状态,并发现了发现未知细胞类型、相互作用关系和人特异性的空间分布模式,以及脊椎动物中保守的阶段调控机制。

人类胚胎在2.5周时完成原肠胚的形成,4周时主要胚胎器官和组织类型开始分化。从原肠形成到器官发生的过程,最显著的标志是早期祖细胞分化多样性急剧增加,大多数发育缺陷也是此时开始出现。在脊椎动物中,对胚胎发育的研究主要集中于小鼠和斑马鱼等模式动物,但由于技术困难和伦理限制,它们在人类胚胎中的保守程度尚不清楚。虽然目前人类胚胎发生后期的单细胞数据已经通过系统地或以器官特异性的采样方式获得,但细胞多样性大幅扩张的关键时间窗口仍有待探索。
在这篇文章中,研究者们收集了8个捐赠的胚胎进行单细胞测序和空间转录组分析,设计了基于已知知识的半监督迭代聚类算法,形成属于18个发育系统的313个亚类。通过从157篇文献中总结细胞类型信息,将其中近70%的类注释到细胞类型的水平,类型的空间位置符合预期。为了提高细胞采样率,研究者们将胚胎解剖为头部、躯干、内脏和肢体等主要部分(图1b),最终从22个胚胎解剖部位获得了185,140个高质量细胞,并根据细胞类型(图1a)、解剖部位(图1b)和发育阶段(图1c)不同的降维聚类方法对细胞进行分群。进一步分析发现,超过98%的细胞来自注释的细胞类型所属的解剖部位(图1b),在鉴定到的313个亚类中,213个能够归类到已知的细胞类(图1d)。上述分析结果表明,研究者们对胚胎的单细胞测序结果能够反映胚胎的真实细胞组织。

图1:早期人类胚胎的单细胞转录组图谱
为了阐明解剖部分以外的组织细胞空间分布,研究者们对CS13的一个胚胎的两个矢状切面(一个中心面和一个非中心面)进行了空间转录组( spatial transcriptome,ST)测序(图2a),这两个切片分别展示了中胚层和外胚层的形态结构(图2b),分析ST测序数据,研究者们发现检测到的细胞类型与H&E染色结果中能够识别的组织结构定位一致(图2a,2b)。具体来说,在心脏中,心房和心室心肌细胞从颅向尾侧排列,心内膜在内,心外膜在外(图2c)。对脑组织而言,脑泡在口尾轴和背腹轴上均以预期方向出现(图2d)。上述分析表明,本文scRNA-seq和ST数据相互佐证,提供了一个包含空间位置信息的人类胚胎细胞类型图谱。
接下来,研究者们进一步探讨了ST是否可以更好地理解以前未确定的发育系统。在这个发育阶段的头部中胚层含有7个体节,但其细胞类型尚不清楚。从ST结果中,研究者们发现头部中胚层5种未定义的细胞类型在ST中有丰富的表达(图2e),并且它们出现在体节发育区域,并沿前后轴和DV轴有明显的分布。这五种未定义的细胞类型彼此之间具有显著的差异表达基因(图2e)。总之,研究者们通过scRNA-seq和ST测序结果,发现了头部中胚层中新的细胞类型,及其潜在的功能。
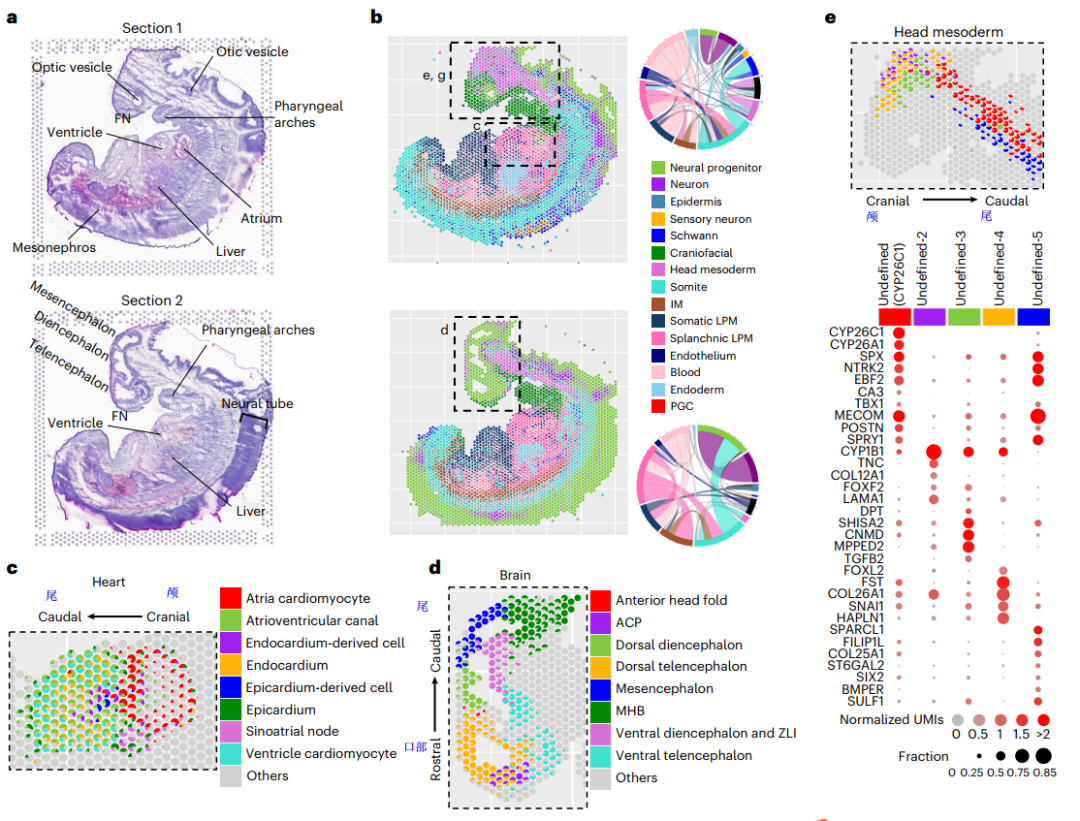
图2:CS3胚胎的空间转录组图谱
轴的形成模式是胚胎发生过程中一个重要而普遍的过程,因为每个器官通过不同的机制来形成体轴。为了研究人类胚胎不同体轴的发育过程,研究者们在scRNA-seq和ST的数据中标注了相关细胞类型,并在小鼠的原位染色结果中定位了每个发育阶段前肢间质中的细胞类型,最终在人类胚胎CS12、CS13-14和CS15-16前肢的PD轴和AP轴上分别定义了6、10和15个空间域(图3a)。细胞类型的空间位置RNA速率分析结果与前人报道的谱系追踪结果相匹配(图3b,3c)。为了验证测序结果,研究者们比较了原位染色实验和ST测序结果,发现分析获得的HOXA基因的空间表达情况与已知的表达模式十分相似(图3d)。上述分析结果表明,研究者们的ST测序结果能够反映胚胎发育过程中细胞类型真实的空间分布情况。
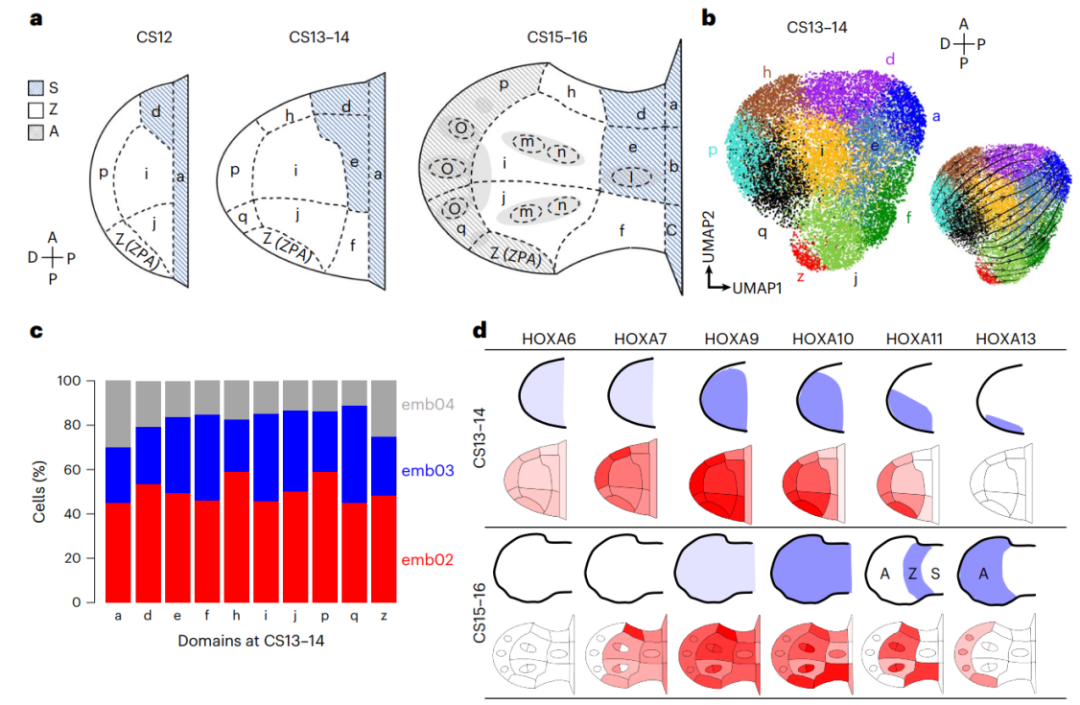
图3:胚胎肢芽的空间结构域
进一步基于HOX基因的表达,研究者们重建了后脑和脊髓神经祖细胞的AP轴(图4a),并鉴定到除HOX基因外,表达水平存在AP轴梯度的21个基因(图4b)。其中,已知的CYP26C1基因参与了维甲酸梯度的建立,而维甲酸梯度的建立能够沿AP轴激活一些HOX基因的表达。值得关注的是,这21个基因包括位于HOX基因簇中的5个长链非编码RNA (lncRNA),分别是HOTAIRM1、RP11-357H14.17、RP11-834C11.4、RP11-834C11.6和FLJ12825。除了HOTAIRM1之外,这些lncRNAs都是人类基因组所独有的,表明神经管AP轴发育模式中的存在人类特异性的调控网络(图4c)。
更重要的是,研究者们发现与小鼠相比,MSX2在人腹侧的表达明显扩增(图4e)。MSX2在人体内的表达与其在小鼠中的同家族基因MSX3相似,后者在人类基因组中缺失,这表明MSX2在人dp2-4中补偿了MSX3的功能(图4e)。研究者们进一步验证了仅由ST定义(独立于scRNA-seq)的dp4中MSX2的表达,发现dp4的标志基因ASCL1和GBX2与MSX2共表达,但dp1的标志基因ATOH1或顶板的标志基因LMX1A与MX2不存在共表达(图4g)。综上,研究者们认为即使在神经管等广泛保守的发育系统中,发挥关键作用的转录因子在不同物种之间也存在显著差异的表达模式。
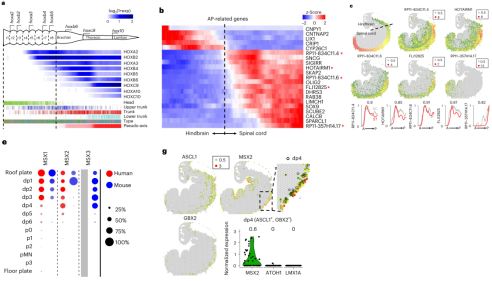
图4:神经管的空间模式
脊椎动物胚胎发生各阶段均有特征性的发育事件,但目前尚不清楚是否存在可能控制阶段过渡的保守性调节机制。因此,研究者们分析了测序数据中系统性基因的表达变化,并与其他脊椎动物模型的数据进行了比较,发现LIN28A可能具有潜在的调控阶段转变的作用。
在分析早期人类胚胎中的短暂性基因变化时,发现96%的细胞类型中LIN28A表达从CS12-14到CS15-16胚胎急剧下降2倍(图5a)。同样,在小鼠胚胎的相应阶段(E9.5-10.5和E11.5), Lin28a在90%报告的细胞类型中也显示出2倍的下降(图5b)。结合在更广泛的时间窗口中,其他脊椎动物胚胎的测序数据,研究者们观察到LIN28A表达的保守模式:LIN28A在原肠胚形成之初显著上调,在斑马鱼/青蛙的早期器官发生时达到峰值,在孵化时或在小鼠/人的E11.5/ CS15-16时下降(图5d)。上述结果表明,LIN28A在脊椎动物胚胎发生中展示出一种保守的系统动力学。
考虑到LIN28A的上调和下调分别与阶段1到阶段2和阶段3到阶段4的转变一致(图5f),研究者们进一步挖掘了LIN28A在阶段转变中的潜在作用。在已知LIN28A76调控的四个主要过程中,有三个出现在发育系统从阶段1到阶段2和从阶段3到阶段4的转变过程(图5g)。此外,LIN28A可能通过直接结合mRNA来调节系统转变的相关基因,而不是通过已被充分研究的let-7依赖通路(图5h)。综上所述,脊椎动物胚胎发生的阶段性转变是通过一种保守机制通过LIN28A进行调控的。
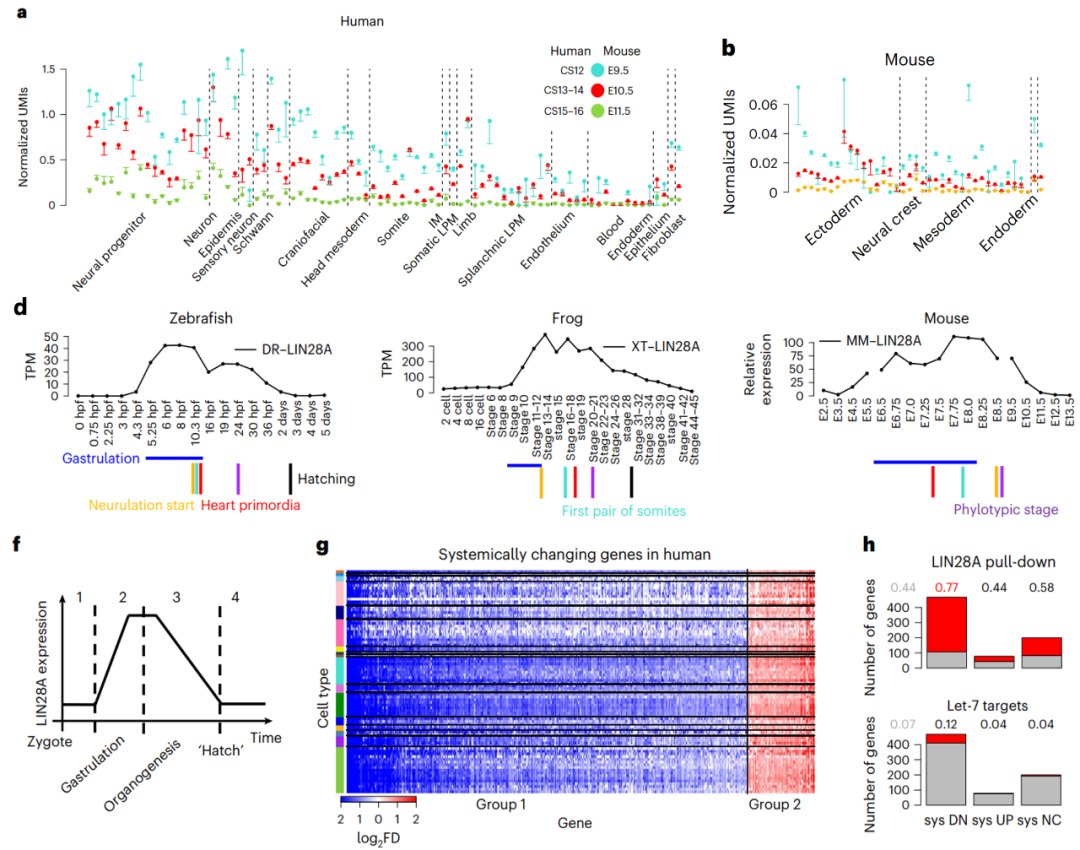
图5:在脊椎动物胚胎发生中的系统时间调控
由于取样的限制,本文的数据集提供了目前人类器官发生的最早时间点的单细胞图谱,也是不同器官发育轨迹的根源时间点。此外,研究者们整合了人类后期胚胎发育后期阶段(10-19周龄)的scRNA-seq数据(图6a,b),并重建了眼睛中细胞类型的轨迹(图6c,6d)。目前尚缺少人类胚胎发育中期的数据,随着对胚胎发育研究的时间分辨率不断提高,人们可以最终系统地推断出胚胎中器官特定的发育轨迹。
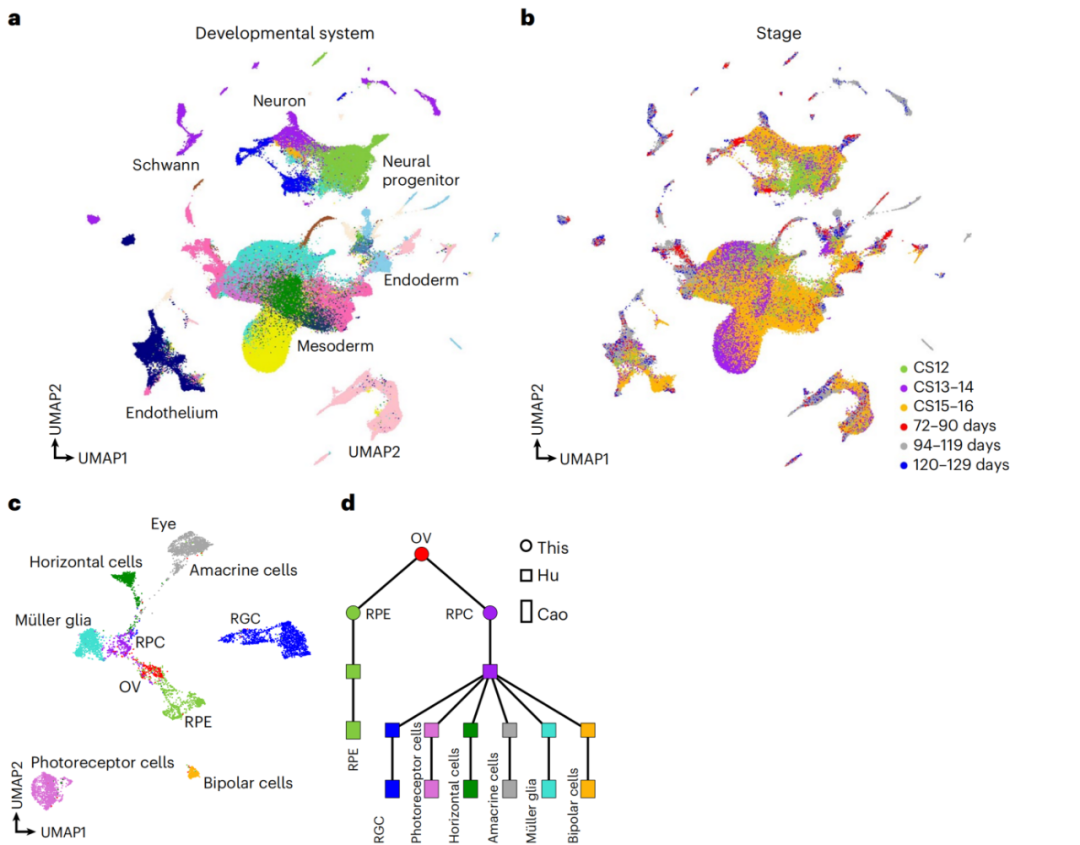
图6:人胚胎发育前后期数据整合
总结来说,该研究结合单细胞转录组和胚胎切片的空间转录组测序,刻画了人胚胎器官发生特定时期的细胞类型和空间模式、发育进程的系统性时间调节和潜在的人类特异性调节方式。结合其他脊椎动物的数据,为理解进化过程、寻找出生缺陷因素提供了线索,也为人体器官发生谱系的分析提供了基础。
相关论文信息:
https://doi.org/10.1038/s41556-023-01108-w
https://m.sciencenet.cn/blog-3423233-1380772.html
上一篇:《自然—植物》:中科院分子植物卓越中心陈晓亚实验室发现控制棉酚对映异构体生物合成的关键蛋白
下一篇:《细胞—干细胞》:北京大学邓宏魁团队建立更加快速高效的人体细胞化学重编程体系