博文
真实化学反应(或相变)的自发性与G判据
|
本文拟探讨如何将G判据与真实化学反应(或相变)的自发性问题相结合.
G判据
G判据是指在恒温、恒压及环境不提供有效功的前提下,
①如果ΔrGm<0,则化学反应(或相变)自发;
②如果ΔrGm=0,则化学反应(或相变)处于平衡;
③如果ΔrGm>0,则化学反应(或相变)非自发.
G判据是现阶段解决化学反应(或相变)自发性问题时,应用最多的理论.
需指出“恒温、恒压及环境不提供有效功的前提下”进行的化学反应(或相变)均为准静态过程,只能通
过范特霍夫平衡箱实现.
2. 化学反应(或相变)
真实化学反应(或相变)通常在敞口反应器内进行,p=pe=101.325kPa,同时可将化学反应(或相变)近似处理为封闭体系, 化学反应(或相变)结束时,系统温度由T1升至T2.
上述化学反应(或相变)的热力学过程示意图参见如下图1.
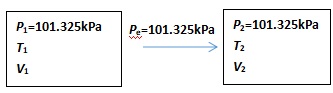
图1.敞口反应器内化学反应(或相变)示意图
为将G判据应用于真实化学反应(或相变)自发性问题的解决,需将图1过程做进一步处理,参见如下图2.
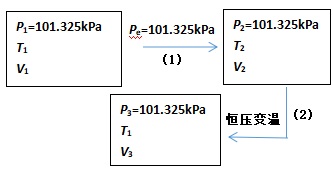
图2. 敞口反应器内化学反应(或相变)后期处理示意图
同图1相比,图2增加了“恒压变温”过程(简单pVT变化),最终使体系回复到初始的温度与压力. 通常将图2过程[(1)+(2)]合称等温、等压过程,此时图2过程满足了G判据的应用条件.
3. G判据的应用
图2中始态与终态的压强及温度均分别相等,参见如下图3.
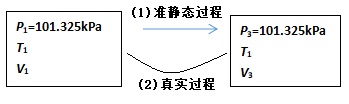
图3. G判据应用示意图
图3中(1)准静态过程是指“恒温、恒压及环境不提供有效功前提下,发生的化学反应(或相变)”,严格满足G判据的应用前提; 图3中(2)真实过程是指敞口反应器内进行的化学反应(或相变),同时增加了一个“恒压变温”过程(简单pVT变化).
由图3可知:(1)准静态过程与(2)真实过程的始、末态分别相同.
需明确:同一个化学反应(或相变),分别经(1)准静态过程、(2)真实过程实现,其自发性不发生改变. 此时可将G判据应用于真实化学反应(或相变)的自发性问题解决.
另需强调,由准静态过程计算得到的化学反应(或相变)的热量、体势变及有效功均是虚拟值.
4. 结论
⑴G判据可应用于解决敞口反应器内化学反应(或相变)自发性问题;
⑵由准静态过程计算得到的化学反应(或相变)的热量、体势变及有效功为虚拟值.
https://m.sciencenet.cn/blog-3474471-1352818.html
上一篇:化学反应(或相变)准静态过程与真实过程的异同
下一篇:混合熵的计算