博文
[转载]代谢学人--Science:免疫 vs 代谢
|||
代谢学人
Science:免疫 vs 代谢
撰文 | 申芸佳 朱丽君 刘爽 曹玉香 李国强
编辑 | 孟美瑶
校对 | 刘爽

背景介绍
影响生理和疾病的感染是人类最强的进化压力因素之一。宿主免疫系统和防御反应往往会以牺牲其他生理系统为代价来优先发挥作用。因此,与非传染性疾病相关的遗传变异如果能提高人群在感染过程中的生存率,则可能在进化中得以保留。例如,人类血红蛋白HBB和载脂蛋白APOL1的基因变异会增加镰状细胞性贫血和慢性肾病的风险,但分别对疟疾和锥虫感染有很强的防御作用。这些研究强调了“进化权衡”的概念,即自然选择不能同时优化两个特征,这会导致对一个特征的适应能力增加,而另一个特征的适应能力下降,最终可能会增加疾病风险。
不断变化的环境也放大了与进化权衡相关的疾病风险,导致所谓的“不匹配”疾病,即一种性状原本的优点在新环境中就会变得有害。例如,有人提出我们的基因遗传与高热量、高脂肪和高精制糖的现代饮食之间的不匹配导致如2型糖尿病(T2D)、心脏病和脂肪肝等慢性代谢疾病的高流行。然而,尽管进化不匹配理论可以解释影响免疫和代谢的慢性疾病,但人们对这一理论在人群中显著的性别偏差却知之甚少。值得注意的是,与绝经前女性相比,男性更容易患上常见的代谢疾病。同样,根据病原体的不同,一些传染病也表现出强烈的性别偏差,在男性或女性中观察到的预后较差。总的来说,生理系统的固有性别差异决定了男性和女性同一种疾病的不同进展。
近期在Science上发表的一篇题为“An evolutionary trade-off between host immunity and metabolism drives fatty liver in male mice”的研究中,研究人员发现BCL6(转录因子B细胞淋巴瘤6)在青春期使肝脏基因表达雄性化(小编注:基因表达雄性化是指某些基因仅仅在雄性中高度表达,使其转录产物在雄性器官或者组织中富集,而在雌性中表达水平低或者不表达)。但是在摄入能量过剩的情况下,BCL6会导致雄性出现明显的脂肪肝和葡萄糖不耐受。肝脏BCL6缺失即可逆转这些表型,但在感染期间显著降低了雄性小鼠的存活率,从而在宿主防御和代谢系统之间建立了性别依赖的平衡,证实一些性别偏向的疾病是根源于免疫和新陈代谢之间的进化权衡。

敲黑板啦!
1、HFD和感染在小鼠中引起强烈的性别依赖性表型;
2、BCL6维持肝脏的雄性化,保证感染后的存活但损害了新陈代谢;
3、性别依赖性高脂血症与宿主的防御反应有关;
4. 性别依赖的GH信号控制着BCL6的表达和感染存活。
研究结果
1.HFD和感染在小鼠中表现出强烈的性别差异性表型
先前的研究发现,饲养在热中性温度(30℃)下的小鼠更容易受到高脂肪饮食的影响,并且受感染风险增加。因此,研究人员探究了在热中性条件下C57BL/6J雄性小鼠与雌性小鼠5的代谢和宿主防御机制之间的潜在权衡(图1A)。结果显示,尽管在喂食高脂肪饮食(HFD)时,雌雄小鼠的体重和脂肪重量都有相同程度的增加(图1B、C),但只有雄性小鼠出现了严重的脂肪肝和明显的脂肪变性(图1D-1F和辅图1A)。另外,研究人员在饲喂标准食物的小鼠中研究了在亚致死剂量(小编注:亚致死剂量是指尚未出现死亡但能引起行为、生理、生化和组织等方面的某种效应的毒物剂量)的大肠杆菌(菌株O111:B4)感染期间,性别对宿主存活率的影响。结果显示,雄鼠对大肠杆菌感染的易感性远低于雌鼠,存活率和体重保存率明显高于雌鼠(图1G,辅图1B、C)。虽然两种不同性别的小鼠脾脏细菌计数相当(图1H),但是雄性小鼠的存活率显著高于雌性小鼠,表明雄性可能存在独特的免疫权衡。在内毒素脂多糖(LPS)刺激下,也观察到雄性的存活率更高(图1I)。总的来说,上述研究结果揭示了长期能量摄入过剩后雄性小鼠较易出现肝脏脂肪积累,并且雄性小鼠在感染细菌后宿主存活率较高,而雌性小鼠与之相反。

图1 HFD和感染在小鼠中引起强烈的性别依赖表型

辅图1 SD和HFD对肝脏脂滴和大肠杆菌感染存活率的影响
2.BCL6维持肝脏的雄性化,保证感染后的宿主存活但损害了新陈代谢
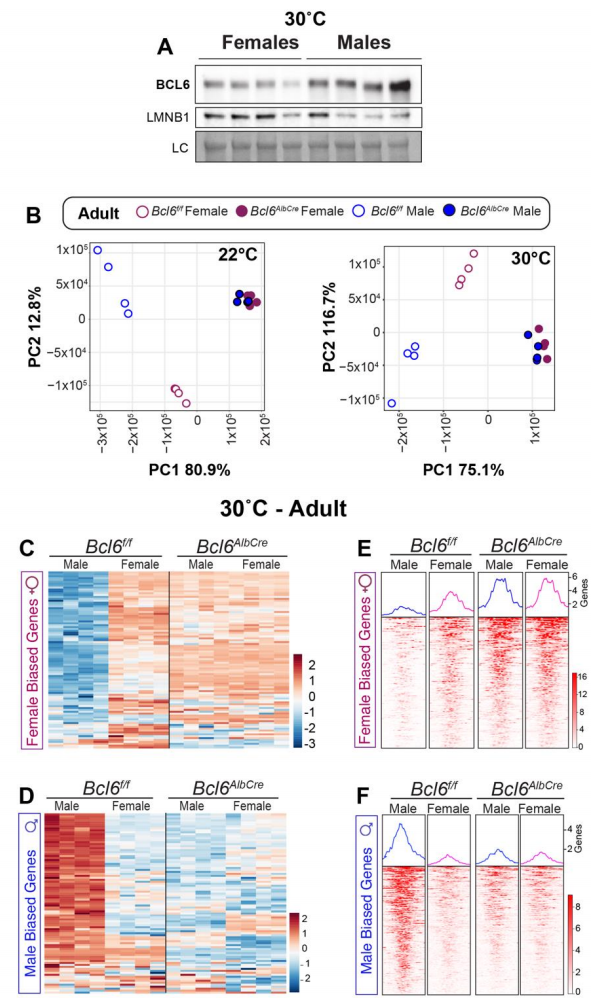
在寻找有可能介导这些性别差异现象的性别依赖性肝脏因子的相关文献中,由于转录抑制因子B细胞淋巴瘤6蛋白(BCL6)在肝脏脂质代谢中的功能和其在雄性肝脏中高度富集,成为了研究人员的首选因子。研究人员发现,在22℃和30℃条件下,BCL6偏向在雄性中表达,Bcl6转录产物和蛋白在雄性肝细胞和肝脏中高度表达(图2A、B和辅图2A)。而Bcl6肝脏特异性缺失(Bcl6AlbCre)(图2B)使成年雄性肝脏雌性化,并消除其雄性倾向的基因特征(图2C、D,辅图2B-D)(小编注:科学家们很久之前就意识到性别差异会影响基因表达水平。2006年,杨侠等人报道了小鼠组织基因特异性表达和性别二态性的基因调控现象。研究人员对小鼠多个体细胞组织中的23574个转录本进行了分析,发现在肌肉,脂肪,肝脏中均存在大量的性别二态性表达基因。具体表现为部分基因在不同性别中表达具有显著差异,具有性别偏向。Xia Yang et al. Genome Res.2016. 本文中的基因表达雌性特征和雄性特征就是指同一基因在不同性别表达的差异。如在雄鼠中,原先在肝脏中高表达,在雌性肝脏中低表达的基因表达降低,反之升高,则认为是雄性肝脏雌性化)。通过染色质免疫沉淀测序(ChIP-seq)对乙酰化组蛋白3赖氨酸27 (H3K27ac)的活性增强子和启动子进行分析,结果也揭示了BCL6在维持性别依赖的肝脏染色质乙酰化和雄性偏向的H3K27ac峰方面的重要作用(图2C、2D和辅图2E、2F)。综上,BCL6可能通过其性别依赖性的表达,介导了上述细菌感染之后的性别差异结果(小编注:2018年的文献报道,BCL6 promoter与H3K37ac有关)。
拓展阅读
Bcl6基因及其表达产物
Bcl6是一种原癌基因,编码95kDa的Kruppel型锌指蛋白。Bcl6表达于正常的滤泡生发中心B细胞和其相关的淋巴瘤。在滤泡性淋巴瘤、弥漫大B细胞淋巴瘤、Burkitt淋巴瘤以及结节性淋巴细胞为主的Hodgkin淋巴瘤中,可以检测到Bcl6的表达。当脾脏边缘带淋巴瘤向弥漫大B细胞淋巴瘤转变时可伴有Bcl6阳性表达。血管免疫母细胞性T细胞淋巴瘤中也能检测到较多细胞阳性。另外应注意,很多正常T细胞也可表达Bcl6。
而该基因的表达产物BCL6(B-cell lymphoma 6 protein)作为一种转录抑制因子,对B细胞生发中心的发育和功能维持起着重要的作用。在生发中心的B细胞中,当 BCL6 蛋白高表达时,会抑制p53肿瘤抑制因子基因的表达,保护B细胞不受由 DNA 破坏导致的细胞自杀的影响,从而使B细胞迅速增殖,逃避生长检查点的控制,并能承受较高水平的DNA损伤,BCL6的表达失控将会直接导致B细胞淋巴瘤的产生,因此BCL6被认为是弥漫性大B细胞淋巴瘤的治疗靶标。
参考文献:
[1] Rebecca J Leeman-Neill,et al.Expert Opin Ther Targets.2018.Feb;22(2):143-152.

图2 BCL6维持肝脏的雄性化,保证感染后的存活但损害了新陈代谢
辅图2 敲除肝脏BCL6基因,减少肝脏脂肪,提高糖耐量
在确定了BCL6在肝脏基因特征中的雄性化作用后,接下来研究人员评估了BCL6是否对维持HFD和感染条件下的性别特异性结果具有重要作用。结果显示,敲除肝脏Bcl6基因后,雄性小鼠的脂肪肝形态学特征消失,但不改变总脂肪量或体重增加的百分比(图2E、F,辅图3A、B)。Bcl6AlbCre雄性小鼠的肝脏重量、肝脏甘油三酯(TAGs)、脂质积累和脂滴大小均减小(图2G-2I),这与之前Bcl6通过抑制脂肪酸氧化阻止脂肪分解的研究结果保持一致。此外喂食标准饮食(SD)的Bcl6AlbCre小鼠中,肝脏甘油三酯(TAGs)也下降(辅图3C)。敲除雌性肝脏中含量较低的BCL6也会降低肝脏甘油三酯(TAGs),但效果较轻微(图2G-2I)。在喂食HFD或SD的雄性小鼠中,肝脏BCL6的缺失显著改善了葡萄糖稳态,并消除了该代谢参数的显著性别差异(图2J和辅图3D)。但是与Bcl6AlbCre雄性小鼠的代谢状态改善形成鲜明对比的是,在大肠杆菌感染或LPS处理后,它们的存活率急剧下降到对照组雌性的水平(图2K和辅图3E),而脾脏内的病原体清除不受影响(图2L)。因此,雄性小鼠肝脏中较高的BCL6含量对感染期间提高宿主存活率至关重要,但在摄入能量过剩期间会导致脂肪肝和葡萄糖不耐受,这表明肝脏的脂质处理和宿主防御反应之间存在很强的关联。

辅图3 BCL6的缺失降低了肝脏TAGs含量,提高了热中性饮食条件下的葡萄糖耐量
3.性别依赖性高脂血症与宿主的防御反应有关
先前的研究发现,在人类和大鼠的脓毒症中,均观察到在遭受细菌感染后,出现高脂血症。本文也发现,在30℃下喂养SD的雌性小鼠低存活率与极高的血浆甘油三酯密切相关。但是由感染引起的高脂血症仅在热中性条件下可见(图3A和辅图4A)。同样,感染的Bcl6AlbCre雄性小鼠的存活率下降与血液循环中TAGs浓度的大幅上升有关,这与感染的对照组雌鼠相似(图3B、C,辅图4B)。研究人员发现被感染的Bcl6AlbCre雄鼠血浆中甘油三酯增加,因此研究人员接着探究在包装和清除极低密度脂蛋白(VLDLs)及甘油三酯(TAGs)方面发挥重要作用的基因是否受BCL6的调控。结果显示,在三个候选基因中,肝脏的Apoc3基因(其编码产物抑制TAG清除)在Bcl6AlbCre小鼠中急剧增加,而ApoB和ApoA1则没有变化(图3D和辅图4C)。肝脏BCL6 ChIP-seq数据分析显示,BCL6直接结合到Apoc3位点上抑制其表达(图3E)。因此,正如所预测的那样,在未感染的雄性中,肝脏中BCL6缺失后,血浆中的APOC3会增加。但是这在Bcl6AlbCre雌性中并不明显,尽管Apoc3转录产物增加,但它们未能表现出高的APOC3水平(图3F)。以上这些结果表明,在雌性肝脏中APOC3包装成脂蛋白的过程中,转录后的因子发挥了作用。然而,用LPS处理的野生型雌性表现出血液循环中APOC3和TAGs明显增加(图3G),这与APOC3在维持血浆TAGs含量中的重要作用相一致。这一研究结果支持了Scholl及其同事的假设,即脂蛋白脂肪酶(LPL)对血浆TAGs的清除减少加剧感染引起的高脂血症(小编注:APOC3是LPL的抑制剂,循环中APOC3升高时LPL活性降低,抑制血浆ATGs的清除,导致高脂血症)。 为了确定血浆高TAGs是否直接导致雌性动物感染后存活率低,研究人员构建了ANGPTL4敲除(KO)小鼠,由于LPL活性增加,这些小鼠血浆中的TAGs降低(图3H),并且与WT小鼠相比其存活率和体重增加,使感染的Angptl4−/−雌性小鼠血浆中TAGs含量正常化之后,其存活率和体重恢复到WT水平(图3H和辅图4D)。Angptl4−/−雄性小鼠也显示出TAGs含量的下降,并保持对感染的抵抗力(辅图4E和4F)。相反,使用LPL合成抑制剂poloxamer 407 (P407)增加血浆TAGs含量,也使感染后的雄性小鼠存活率下降 (图3I)。以上研究结果表明,感染结果中的显著性别差异与血液循环中的TAGs含量密切相关。
拓展阅读
极低密度脂蛋白
极低密度脂蛋白(VLDL),是由肝脏利用乳糜颗粒残粒、胆汁酸、脂肪酸、糖和蛋白质的中间代谢物与肝脏内合成的载脂蛋白组成的一种脂蛋白。大小为30-80nm,含有甘油三酯、胆固醇、胆固醇酯和磷脂。其中,甘油三酯(TG)约占60%,胆固醇(TC)约占20%,载脂蛋白约占10%,其他成份约10%。
VLDL是机体运输内源性甘油三酯的主要形式,肝细胞可以利用葡萄糖为原料合成甘油三酯,也可利用食物及脂肪组织动员的脂肪酸合成甘油三酯,然后甘油三酯与载脂蛋白B100,载脂蛋白E以及磷脂、胆固醇等结合而形成极低密度脂蛋白。
正常的VLDL一般没有致动脉粥样硬化的作用。但当机体内VLDL水平显著升高时,血浆中的甘油三酯、胆固醇水平也随之升高。在高胆固醇血症病人体内,VLDL颗粒相对较小,且富含载脂蛋白B,这种VLDL具有很强的致动脉粥样硬化的作用。因此,VLDL也被称之为致动脉粥样硬化因子。
参考文献:
[1] Sadao Takahashi, et al. Curr Opin Lipidol. 2021 Aug 1;32(4):219-225.

图3 性别依赖性高脂血症与宿主的防御反应有关

辅图4 大肠杆菌感染后肝脏BCL6调节血浆TAGs
4.性别依赖的生长激素信号控制着BCL6的表达和宿主感染后的存活率
接下来,研究人员又探究了哪些因素使BCL6能够控制雄性小鼠的肝脏基因程序。雄性偏向基因的出现与青春期相一致,在雄鼠8周龄时变得明显(图4A和辅图5A)。对青春期前的雄性进行手术阉割(GDX)后发现,肝脏中女性偏向性基因的表达增强(辅图5B),大肠杆菌感染后存活率急剧下降,同时伴随着血浆TAGs的升高(辅图5C和5D),肝脏BCL6水平下降,这些症状可通过睾酮(T)治疗部分恢复(辅图5E)。来自垂体前叶的生长激素(GH)的脉冲式分泌在雄性中是独特的,由高峰和延长的低谷组成;这种模式是小鼠肝脏基因雄性偏向表达所需要的。随后,研究人员通过对200个性别偏向基因集进行分析,最终确认了GH的持续输注能使雄性肝脏雌性化(图4B和辅图5F)。另外,研究人员还发现GH处理强烈抑制肝脏BCL6蛋白和转录产物的表达(图4C)。尽管在原代肝细胞中GH的饱和水平(小编注:本文实验过程中使用了300ng/ml重组小鼠GH,而正常小鼠的GH水平不超过10 ng/ml,因此给与300 ng/ml时相当于是饱和水平)也抑制了Bcl6,但睾酮(T)和雌二醇(E)没有效果,这表明在体内诱导Bcl6的表达恢复不是性激素的直接作用(图4D和辅图5E)。意料中的是,持续输注生长激素会干扰正常生长激素分泌,降低肝脏BCL6含量,进而降低雄性宿主感染后的存活率(图4E)。正如Waxman团队所示,肝脏GH信号的主要效应器STAT5与Bcl6基因结合并抑制其表达,这在GH和Bcl6水平之间提供了直接的分子联系(图4F)。
为了进一步证明上述发现,研究人员构建了一个小鼠模型,该模型携带人类生长激素受体突变体(GHRd3,外显子3缺失),能够模拟生长激素信号的持续表达,并在人类中对T2D的发展具有显著的缓解作用(小编注:文献表明在T2D人群中GHRd3突变可以缓解T2D的进程)(约4倍)。这种变异使雄性小鼠的肝脏雌性化,并被认为在人类食物短缺时期赋予进化优势(小编注:根据文献报道,在热量限制的情况下,GHRd3雄性小鼠体重小于WT小鼠。推测这里的食物短缺时进化优势在于体型而不是热量需求)。实验结果表明,这种常见的GHR变异减弱了肝脏的BCL6功能(图4G和辅图5G)。与青春期开始或阉割后明显的肝脏基因变化相反,在重新分析Maggi及其同事的数据集后,研究人员未能在雌激素受体α(Esr1)肝脏KO小鼠中发现任何明显的性别偏向基因特征变化(小编注:既往文献表明肝脏雌激素受体在肝脏代谢性别二态性中扮演重要角色)(辅图5H)。已知GHRd3变体具有抵御营养压力的能力,综合分析本文研究,提示非脉冲式GH-BCL6信号轴为雌性创造了一种平衡,在感染期间存活率下降,而在禁食状态下存活率提高。饥荒期间女性的存活率超过男性,这在一定程度上支持了这一观点。在雄性小鼠中,肝脏脉冲式GH-BCL6轴(小编注:在雄性个体中,GH呈脉冲式释放,促进BCL6表达进而维持肝脏的雄性化,保证感染后的宿主的存活但损害了新陈代谢;在雌性个体中,GH释放的脉冲振幅较低,没有延长的基线,BCL6呈现低表达,改善了新陈代谢但损害了感染后宿主的存活)的建立对感染的保护性防御至关重要,能够同时促进大量的肝脂肪积累和热量过量时的葡萄糖耐受(图4H)。尽管这一途径在人类中的性别差异有待记录,但研究人员已经注意到垂体功能低下和生长激素水平低的患者会发展成脂肪肝,并且在生长激素治疗后会改善。基于哺乳动物代谢程序的保守特征,研究人员推测,目前男性脂肪肝的流行可能源于较老的宿主防御机制,这一机制是由交配和社会地位所需的攻击性行为导致的病原体暴露增加而共同进化而来的。上述研究结果证明,对感染和饮食压力的适应塑造了性别二态性途径,从而促成了现代性别偏向性疾病。
拓展阅读
生长激素与性别
在大鼠和小鼠中,垂体生长激素GH的分泌方式具有性别依赖性,雄性的生长激素是由脑垂体以高度脉动的方式分泌的,表现出生长激素峰值的规律性,大约每2.5小时出现一次,中间有稳定的基线浓度,持续时间明显长于雌性小鼠。雌性的生长激素分泌更为频繁,血浆激素脉动之间没有长时间的无生长激素间隔,周期长度减少到平均1.4小时,并显著增加了总体平均生长激素浓度。即雌性GH的连续分泌比雄性明显,具有更频繁的高峰。文献表明,肝脏中男性生长激素的基线期是驱动两性基因表达的关键时期,而男性生长激素的特异性脉冲式释放具有较长的基线期,因此男性的肝脏中的这种GH释放模式促进雄性基因的偏向表达。
BCL6可以直接与转录因子STAT5结合,激活STAT5发挥作用,而转录因子STAT5在GH的转录应答中起着显著的作用,并与GH对肝脏基因表达的性别依赖性作用有关。在雄性大鼠肝脏中,肝脏STAT5活性周期以动态的、脉动的方式直接响应每一个连续的血浆GH脉冲;而在雌性大鼠肝脏中,STAT5活性持续在低水平上响应循环GH的更频繁(接近连续)刺激。特别是STAT5b,需要维持90%的雄性偏向基因的表达,并抑制雄性小鼠肝脏中60%的雌性偏向基因,从而使BCL6在肝脏中显示出性别偏向效应。

图4 性别依赖的GH信号控制着BCL6的表达和感染存活

辅图5 手术阉割和持续输注生长激素对肝脏基因表达、BCL6水平和生存的影响
总结
对感染和饮食压力的适应增加了哺乳动物的生理和疾病风险。这种适应如何影响性别偏向性疾病的研究还不够充分。本研究结果显示,性别依赖的肝脏基因程序为雄性小鼠在致命细菌感染期间提供了强大的生存优势。转录因子B细胞淋巴瘤6 (BCL6),在青春期使肝脏基因表达雄性化,是这一优势的关键。然而,在摄入能量过量的情况下,BCL6蛋白会导致雄性小鼠出现明显的脂肪肝和葡萄糖不耐受。肝脏中特异性敲除BCL6逆转了这些表型,但在感染期间显著降低了雄性存活率,因此在宿主防御和代谢系统之间建立了性别依赖的平衡。该研究为目前一些性别偏向的疾病根源于古老的免疫和新陈代谢之间的进化权衡提供了强有力的证据。
原文链接:https://www.science.org/doi/10.1126/science.abn9886
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1368171.html
上一篇:代谢学人--Nature:U,执行A计划!线粒体UCP1/AAC机制大揭秘
下一篇:Nature Aging:m6A解开衰老之谜