本文介绍的是俄克拉何马大学斯蒂芬森生物医学工程学院Wei R. Chen教授对光疗响应的肿瘤微环境免疫调节进行的系统性综述,发表在《Journal of Innovative Optical Health Sciences》期刊2023年第3期。
Immune modulations of the tumor microenvironment in response to phototherapy
光疗响应的肿瘤微环境免疫调节
Trisha I. Valerio, Coline L. Furrer, Negar Sadeghipour, Sophia-Joy X. Patrock, Sayre A. Tillery, Ashley R. Hoover, Kaili Liu and Wei R. Chen
研究背景
癌症是全球范围内威胁人类健康的重大疾病。目前,传统的癌症治疗包括手术、化疗和放疗。然而,肿瘤细胞异于正常细胞的代谢形式形成了特有的免疫抑制的肿瘤微环境(Tumor Microenvironment, TME)。因此,许多类型的癌症可以通过逃脱宿主的免疫反应而抵抗常规疗法。所以,克服TME的免疫抑制往往作为癌症治疗中最重要的愈后因素。光疗,特别是光热疗法(Photothermal Therapy, PTT)与纳米医学相结合的模式已经被证实能够很好的抑制肿瘤生长,同时逆转肿瘤免疫抑制微环境增强抗肿瘤疗效。
内容简介
本文对光疗响应的肿瘤微环境免疫调节进行了系统性的综述,主要分别介绍了TME中肿瘤相关免疫细胞的组成成分以及他们如何限制抗肿瘤疗效;分别讨论了目前针对TME的治疗方法的优势和局限性以及光疗诱导的免疫调节;分别探讨了不同肿瘤模型中T淋巴细胞和B淋巴细胞的调节能力以及免疫调节与肿瘤患者生存率之间的相关性。这些研究对于构建临床高效抗肿瘤治疗策略具有重要意义。
图文导读
1.肿瘤微环境和相关免疫细胞的关系

图1:肿瘤微环境以及肿瘤细胞和免疫细胞之间的相互作用
在TME中,肿瘤细胞和免疫细胞是处于不断交流的状态。TME呈现出pH值偏酸性、缺氧、营养缺乏等特点,而这些特点正是促进TME免疫抑制特性的主要原因。此外,肿瘤细胞与癌症相关成纤维细胞(cancer associated fibroblasts, CAFs)能够分泌相关细胞因子和趋化因子促进肿瘤细胞的生长,抑制免疫细胞的活性以及招募免疫抑制细胞。在这些免疫抑制细胞中,如M2极化的巨噬细胞、髓源性抑制细胞(myeloid derived suppressor cells,MDSCs)、调节性T细胞(T regulatory, Treg)以及肿瘤相关中性粒细胞(tumor associated neutrophils,TANs)不仅能够通过抑制表达免疫抑制受体直接抑制抗肿瘤免疫反应,还能够通过释放相关细胞因子和趋化因子等途径间接抑制抗肿瘤免疫反应。除此之外,这些免疫抑制细胞还能够通过抑制DC细胞、NK细胞、细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的功能等多种机制促进肿瘤的生长和转移。
2. 肿瘤浸润淋巴细胞
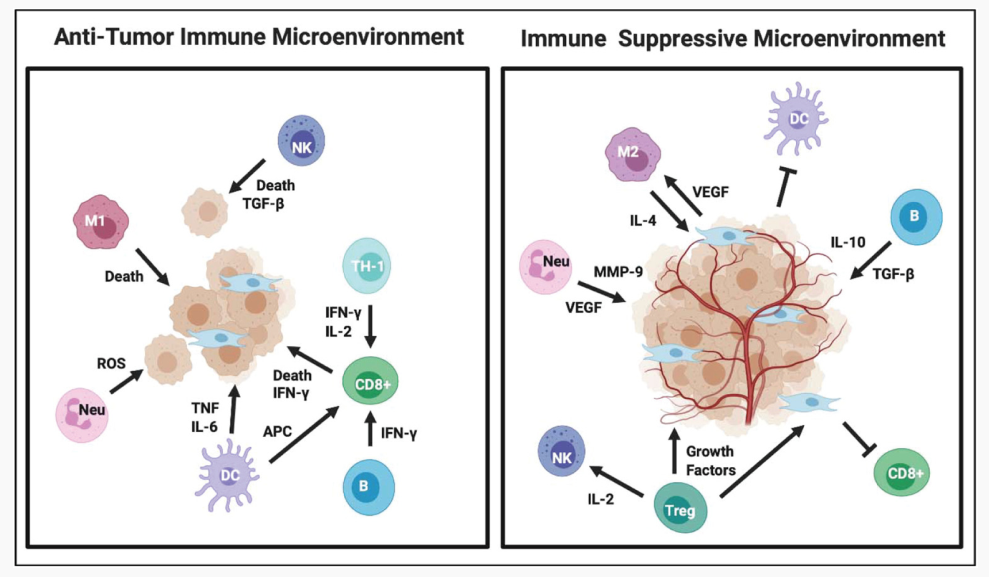
图2. TME中的免疫细胞可以抑制肿瘤形成(anti-TME)也能够促进肿瘤发生(pro-TME)。根据环境和肿瘤类型的不同,TME中的免疫细胞可以是致瘤性的或抗致瘤性的
肿瘤浸润淋巴细胞是在TME中浸润的,且对不同的治疗做出响应的主要的免疫细胞。他们主要分为三类:T细胞、B细胞、NK细胞。当某些肿瘤细胞开始经受CTL诱导的细胞凋亡时,凋亡的肿瘤细胞会产生特异性的肿瘤相关抗原。这些抗原被抗原呈递细胞(antigen-presenting cells APCs)如巨噬细胞和DC细胞内化和呈递。此外,肿瘤相关抗原能够促进APCs成熟并迁移至淋巴结,最终在生发中心将抗原呈递给初始T细胞(naive T cells)。
3. 光动力学治疗(Photodynamic Therapy, PDT)诱导的抗肿瘤反应
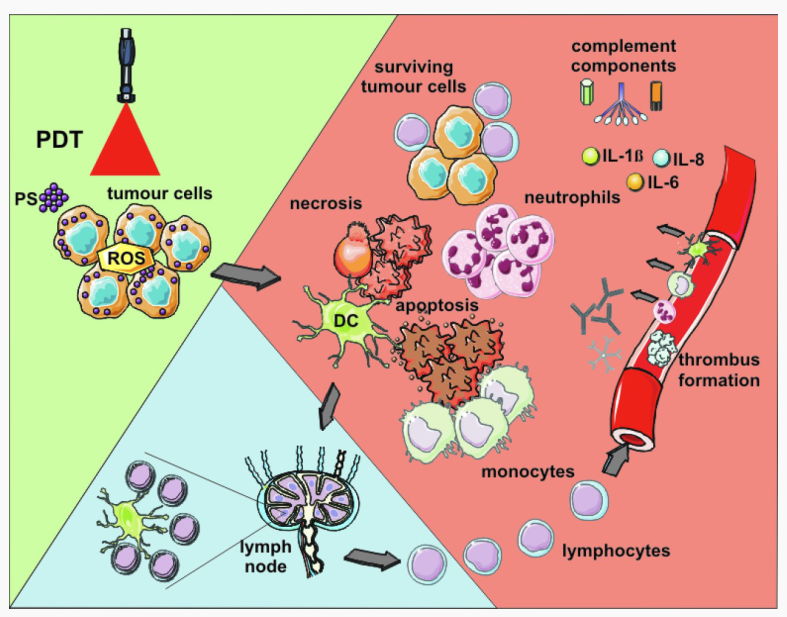
图3. PDT诱导的抗肿瘤反应
肿瘤组织中的光敏剂(Photosensitizer)通过光介导激活并在TME中产生ROS,产生的ROS导致肿瘤细胞主要通过凋亡和坏死的方式死亡。PDT的过程中还会对微血管造成损害从而限制氧气和营养的供应,进一步加强对肿瘤组织的破坏。随后,促炎细胞因子大量分泌,中性粒细胞、巨噬细胞以及DC细胞的快速募集等级联激活导致了肿瘤细胞的死亡。包括DC细胞在内的吞噬细胞对正在死亡的肿瘤细胞和肿瘤细胞碎片进行吞噬,同时迁移到淋巴结分化为APCs。肿瘤抗原呈递后肿瘤敏感的淋巴细胞进行增值扩充。最后,这些淋巴细胞迁移到肿瘤部位并消除残留的肿瘤细胞。
4. 基于纳米材料的光疗
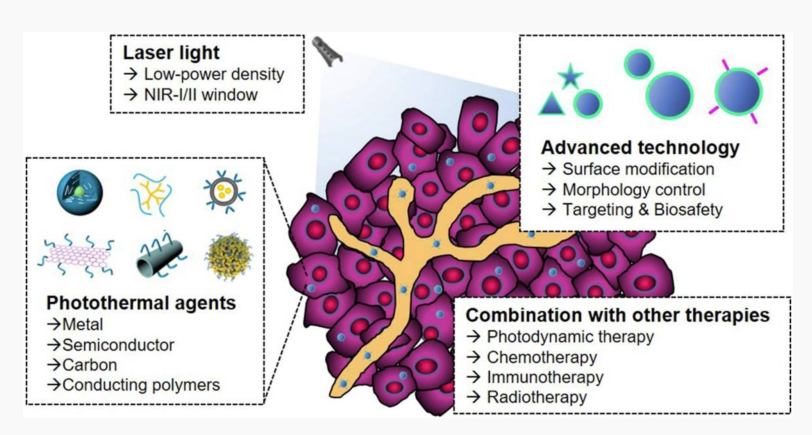
图4. 针对癌症治疗的纳米消融光免疫疗法的组成部分
包括脂质体、水凝胶、胶束、无机以及有机纳米粒子在内的许多材料都已被用于纳米医学的应用。纳米医学基于其广泛的药物和材料的可用性而能够增强药物的递送效率和及时性以及溶解度和生物相容性。因此,纳米医学应用于癌症治疗能够利用其特性针对TME制定有效的策略。纳米载体可以携带多种药物、如酶和抗体。纳米载体的药物递送能够增强免疫抗肿瘤反应并调节TME,从而使治疗更有效。同时,纳米载体还为如靶向光疗等一系列治疗与成像的结合提供了新的治疗选择。这些联合疗法能够进一步调节TME,从而有效地控制肿瘤生长,增强抗肿瘤免疫。当纳米材料与免疫治疗联合使用时,基于纳米材料的PTT的有效性可以得到改善,并且能够原位产生抗肿瘤疫苗,增强抗肿瘤疗效。
5. 激光免疫疗法
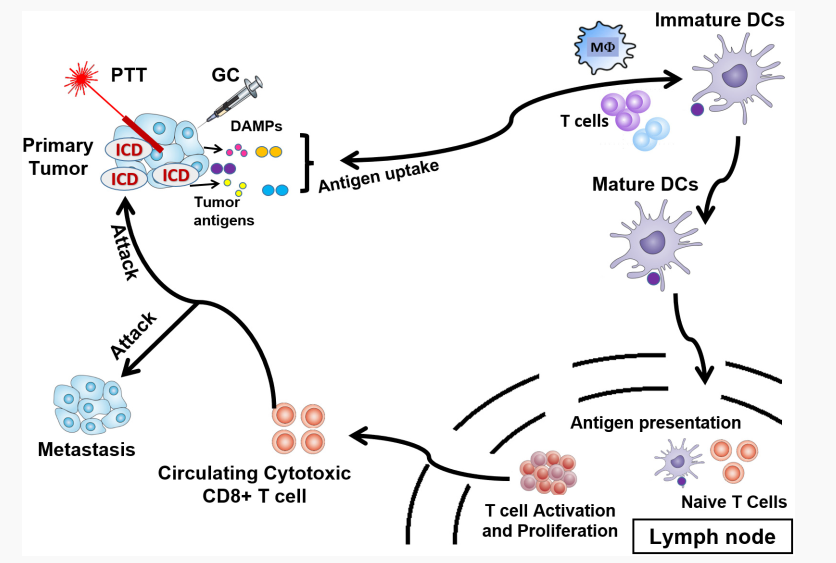 图5. 激光免疫治疗诱导系统性抗肿瘤免疫,用于转移瘤的治疗
图5. 激光免疫治疗诱导系统性抗肿瘤免疫,用于转移瘤的治疗
激光免疫治疗(laser immunotherapy, LIT)是一种结合了PTT和免疫治疗的协同疗法。LIT通过将肿瘤激光照射和局部免疫刺激相结合,杀死原位肿瘤细胞并诱导系统性的抗肿瘤免疫,用于转移性癌症的治疗。LIT通常还会与其他疗法联合使用,特别是与纳米药物的结合,利用其高效的药物递送效率和近红外光吸收特性提高LIT的疗效。纳米药物、热消融和免疫疗法的协同治疗策略已被证明是安全有效的抗肿瘤治疗新方法。
6. 光疗与T细胞激活

图6. PTT对免疫细胞活性的影响
为了克服因为免疫抑制的TME引起的对免疫治疗造成局限性,研究者们探究了免疫治疗与PTT的协同疗法。例如,Chen等使用PLGA纳米粒子负载吲哚菁绿(indocyanine green, ICG)进行PTT以增强经过静脉注射的CAR-T细胞以及其他免疫细胞的肿瘤浸润。如图6(a)-( c)所示,瘤内注射PLGA-ICG纳米粒子并进行PTT后,单核细胞和DC细胞的肿瘤浸润显著增加。同样地,在TME中T细胞表面标志物CD3,CD4,CD8蛋白的表达也显著增加(图6(d)-(f))。最后如图6(g)所示,包括CCL5,CCL2/3/4,CXCL1以及CXCL13在内的代表免疫细胞招募的趋化因子在PTT后均显著升高。
7. 光疗与B细胞激活
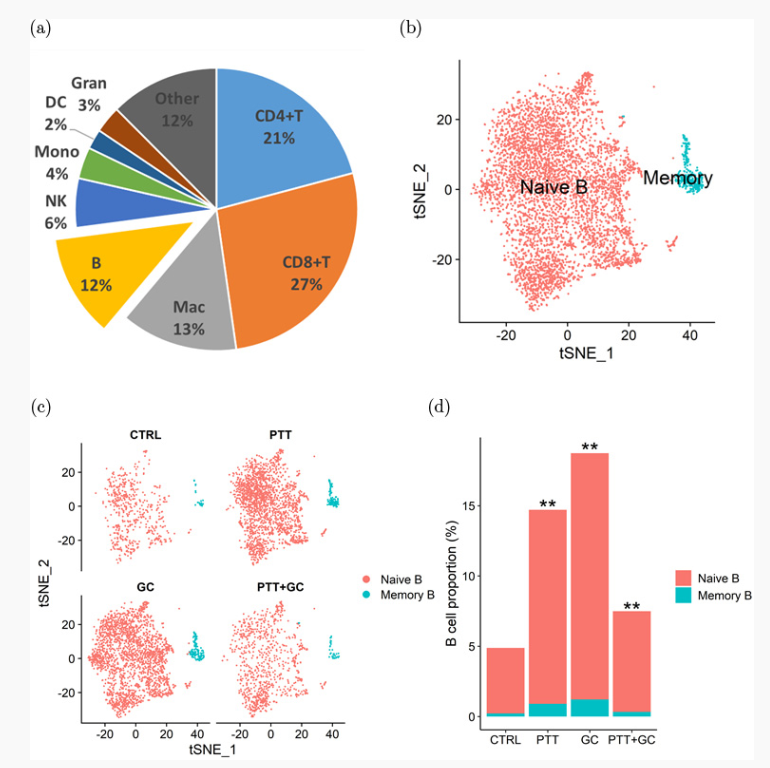 图7. PTT与B细胞的不同亚型和功能
图7. PTT与B细胞的不同亚型和功能
为了研究TME中B细胞的亚型和功能,Liu等人利用scRNA-seq技术鉴定了四种不同处理(Control,GC,PTT,及PTT+GC)后TME中B细胞的不同亚型和活性。如图7(a)所示,48%的TILs为CD4阳性或CD8阳性,而B细胞占比仅12%。在收集的49380个CD45阳性免疫细胞中,发现了5477个初始B细胞和342个记忆B细胞,并根据不同B细胞亚型编码标记的基因表达进行了分类(图8(B))。如图8(c)和8(d)所示,经过GC、PTT和PTT + GC处理的组中肿瘤浸润免疫细胞中的B细胞比例显著增加,表明这些实验处理能够影响B细胞在TME中的浸润比例。
通讯作者简介

Wei R. Chen,俄克拉何马大学斯蒂芬森生物医学工程学院教授。长期从事肿瘤光学免疫治疗方面的研究,是激光免疫疗法这一治疗转移性癌症新方法的共同发明者。发表学术论文160多篇,获得9项美国专利和多项国际专利。获州、联邦机构以及基金会等700多万美元的资助。Wei R. Chen教授于2010年在UCO建立了跨学科生物医学教育与研究中心,并担任该中心主任至2020年。2008年获得美国年度教授奖,2011-2012年美国富布赖特演讲/研究奖的获得者,俄克拉何马州卓越基金会颁发的卓越教学奖章获得者。
转载本文请联系原作者获取授权,同时请注明本文来自王珍科学网博客。
链接地址:https://m.sciencenet.cn/blog-3534623-1391163.html?mobile=1
收藏


