博文
肥胖容易自身免疫性疾病的原因
 精选
精选
|
肥胖和自身免疫疾病
自身免疫疾病是指机体对自身抗原发生免疫反应而导致自身组织损害的疾病。自从Donath 与Landsteiner提出此概念以来,许多疾病相继被列为自身免疫性疾病,常见的如类风湿性关节炎、干燥综合症、红斑狼疮、皮肌炎、甲亢、糖尿病、结肠炎等。值得提出的是,自身抗体的存在与自身免疫性疾病并非两个等同的概念,自身抗体可存在于无自身免疫性疾病的正常人特别是老年人,如抗甲状腺球蛋白、甲状腺上皮细胞、胃壁细胞、细胞核DNA抗体等。有时,受损或抗原性发生变化的组织可激发自身抗体的产生,如心肌缺血时,坏死的心肌可导致抗心肌自身抗体形成,但此抗体并无致病作用,是一种继发性免疫反应。因此,要确定自身免疫性疾病的存在一般需要根据:①有自身免疫反应的存在,②排除继发性免疫反应之可能,③排除其他病因的存在。
令人信服的流行病学证据表明,超重或肥胖与发生自身免疫性疾病的风险之间存在很强的关联(1)。从免疫学的角度来看,与这种关联相关的细胞和分子机制包括营养和能量感应途径对T淋巴细胞的过度刺激。个体的免疫代谢状态是调节免疫自我耐受性的核心,免疫耐受性抑制自我反应以避免自身免疫。脂肪组织是一种免疫活性器官,通过产生脂肪细胞因子影响全身免疫反应,反过来,免疫细胞通过产生促炎和抗炎细胞因子影响脂肪细胞稳态和代谢(2)。这意味着肥胖引起的代谢超负荷会影响免疫代谢,从而改变对自身免疫性疾病的易感性。
The link between obesity and autoimmunity | Science
免疫适应是对营养状况的反应:营养不良会损害免疫力,导致对感染和疫苗接种的反应效率低下。相反,营养过剩有利于先天性和适应性免疫细胞的慢性激活,随后出现(低度)全身炎症。这些现象通过细胞内营养和能量感应途径以及含有蛋白质3(NLRP3)的NACHT,LRR和PYD结构域炎症小体的参与而发生,这是由过量的葡萄糖和脂质诱导的代谢应激的传感器,特别是在巨噬细胞中(2,3)。
肥胖是自身免疫性疾病的危险因素,如1型糖尿病(T1D)和多发性硬化症(MS)(4,5)。增加 多发性硬化症风险的环境和生活方式因素包括吸烟、日晒、维生素 D 低、EB 病毒感染和高体重指数 (BMI)。对年轻肥胖个体的前瞻性纵向研究发现,青春期和成年早期(但不是在 MS 发病时)患 多发性硬化症的风险增加了 1.6 至 1.9 倍;这种与肥胖的关联也在人白细胞抗原(HLA)–DRB1*15:01易感等位基因的携带者中得到证实,该等位基因负责将髓鞘自身抗原呈递给自身反应性T细胞(5)。同样,出生时较高的BMI与儿童较高的T1D易感性有关。事实上,T1D的发病率几乎随着出生体重的增加而线性增加(出生体重每增加100g,发病率增加1.7%)(4)。
从机制上讲,有人认为,身体肥胖的增加会促进细胞内营养和能量感应途径[例如雷帕霉素的机制靶标(mTOR)]的过度激活,随后外周组织中的代谢超负荷,包括参与效应和调节免疫反应的常驻免疫细胞(6).例如,在肥胖的初治多发性硬化症患者中,发现脂肪细胞因子瘦素(与BMI成比例分泌以抑制食物摄入)以及升高的循环营养素可以增强炎症免疫反应。高水平的瘦素和营养物质导致T细胞中mTOR的组成性过度激活,随后T细胞受体(TCR)介导的信号传导失调。T细胞中过度活跃的mTOR模仿强烈的超生理TCR刺激,这种刺激不允许转录叉头盒P3(FOXP3)基因,其表达对于诱导和维持抗炎CD4CD25FOXP3调节性T细胞(T+++注册) (2,6)。通过瘦素过度生产,肥胖会损害抗炎胸腺 T 的增殖注册及其与CD4CD25的外周分化+−传统T (Tconv) 细胞前体 (7)。肥胖也会促进 T 的转化传统细胞转化为致病性炎症性T辅助性T(TH1) 和 TH17个细胞,从而增加免疫自我耐受性改变的风险(见图)。
总体而言,营养和瘦素诱导的mTOR过度激活抑制外周Treg增殖和抑制功能,增强肥胖相关的TH1 和 TH17细胞分化,具有较高的多发性硬化相关髓鞘损伤风险(2,7)。此外,最近的一份报告表明,肥胖小鼠转换了经典的TH2-特应性皮炎的免疫反应主要为以 T 为特征的严重疾病H由过氧化物酶体增殖物激活的受体γ(PPAR-γ)转录因子活性降低引起的17驱动型炎症(8)。PPAR--在脂肪组织中的表达对于脂肪组织驻留Treg的发育和功能也是必需的。表明脂肪组织生物学与免疫耐受之间存在涉及 Treg的双向联系, (2,7)。
由于每日禁食和进食周期引起的生理营养素和瘦素波动决定了mTOR活性的振荡,这些振荡在肥胖中因食物摄入过多而损失。因此,在具有正常BMI和进食和禁食生理周期的个体中,自我耐受性的维持和延续与Treg中mTOR活性的振荡有关.这似乎是 Treg所必需的扩增和功能足以抑制致病性 TH1 和 TH17细胞,因此自身免疫(2,6,7)。
值得注意的是,mTOR是氨基酸,葡萄糖和脂质代谢十字路口的关键细胞内节点。此外,与营养和代谢相关的生长因子,如瘦素,胰岛素和胰岛素样生长因子1(IGF-1),激活免疫细胞中的mTOR信号传导,从而影响全身和细胞内免疫代谢,从而影响炎症和自身免疫(2,6)。脂肪组织还分泌炎性细胞因子,如白细胞介素-1 (IL-1)、肿瘤坏死因子-α (TNF-α)、IL-6、IL-17 和干扰素-γ (IFN-γ),以及瘦素,导致对外周组织损伤和自身免疫的敏感性更高。因此,我提出代谢工作量 - 由营养素,脂肪细胞衍生的生长因子和脂肪细胞因子诱导 - 可能代表通常食用致胖西方饮食的人的自身免疫性疾病的加速器。
在小鼠和人类中已经证明,适应性和先天免疫细胞可以直接影响导致肥胖和肥胖相关代谢异常的病理生理事件(2)。这也可能有助于减少Treg在肥胖人群中观察到的数字。脂肪组织和免疫系统之间存在解剖学和功能串扰。事实上,原发性淋巴器官(骨髓和胸腺)和次级淋巴器官(淋巴结)通常嵌入脂肪组织中并被脂肪组织包围。这种连续性允许T细胞,Treg、B细胞、树突状细胞和巨噬细胞归巢到脂肪组织。此外,脂肪细胞可以表达免疫样行为(2)。例如,脂肪细胞可以使用与先天免疫细胞相同的核结合寡聚化结构域1(NOD1)病原体传感系统清除细胞内细菌(9)。Treg 的变化在肥胖中观察到的数量和功能也可能影响对感染和癌症的易感性(2)。事实上,严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染与自身抗体的产生有关,在肥胖个体中更为严重(10)。此外,肥胖人群的癌症免疫治疗反应优于BMI较低的患者(2)。
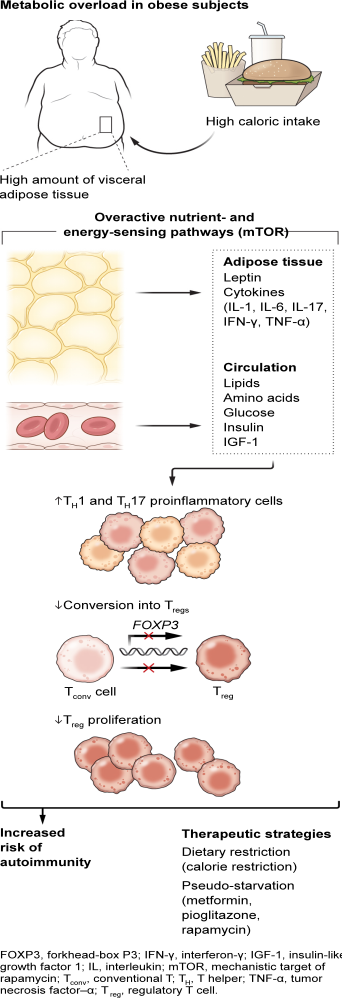
肥胖症免疫代谢改变可能导致自身免疫
在肥胖人群中,通过循环和脂肪组织衍生因子过度刺激免疫细胞营养和能量感应途径(例如增加mTOR活性)会扭曲免疫细胞分化。这会增加促炎 T H1和 TH17细胞的数量,降低Treg数量,这增加了失去自我免疫耐受的风险。免疫代谢策略可能有助于恢复体内免疫平衡。
多基因肥胖(由多种遗传变异和环境因素引起的肥胖易感性)也被认为是一种自身免疫样疾病,T细胞对未知的脂肪细胞抗原作出反应并触发随后不受控制的食物摄入,尽管其机制仍有待完全阐明(11)。值得注意的是,从肥胖小鼠中分离的CD4 T细胞可以通过将体重增加注射到正常体重,免疫缺陷的受体中来转移“肥胖记忆”(11)。因此,肥胖似乎与发生自身免疫的易感性更高有关,不仅因为脂肪组织会增强自身炎症反应,还因为肥胖本身具有自身免疫样特征。+
一种有希望的可能性是通过免疫代谢干预来操纵免疫耐受和自身免疫:减少食物和/或卡路里摄入量。虽然禁食可以调节免疫反应和缓解自身免疫性疾病症状的想法大多被驳回,但过去20年的研究提供了证据,支持行为改变和营养策略的治疗潜力,如饮食,热量限制(CR)和不同的禁食方案(2,12).轻度热量限制,间歇性禁食和生酮饮食在自身免疫小鼠模型中均显示出有益的效果,包括实验性自身免疫性脑脊髓炎(EAE),实验性类风湿性关节炎和实验性结肠炎(2,12)。我建议“饥饿”致病性炎症TH1 和 TH17个细胞可以更好地控制局部和全身炎症。类似地,热量限制允许Treg的增殖在小鼠和人类中通过促进它们的产生,增殖和功能,从而控制自身免疫(2,7,12)。
由于坚持饮食改变并不总是可能的,因此提出的替代方法是“假饥饿”,即调节免疫代谢的药物模仿禁食(13)。一个典型的例子是mTOR抑制剂雷帕霉素。此外,二甲双胍是AMP活化蛋白激酶(AMPK)的激活剂,用于治疗2型糖尿病和超重个体,不仅可以控制葡萄糖耐量,还可以通过AMPK介导的mTOR抑制具有抗炎作用(13)。二甲双胍通过限制单核细胞浸润到中枢神经系统 (CNS) 并下调炎症细胞因子、诱导性 NO 合酶、细胞粘附分子、基质金属蛋白酶-9 和趋化因子在 T 中的表达来减弱 EAE 诱导H17 细胞 (14).在对患有代谢综合征的多发性硬化患者的研究中也观察到了这些影响(15)。
多发性硬化症(IFN-β或醋酸格拉默)的一线药物治疗与二甲双胍联合使用,可显著改善疾病并减少中枢神经系统病变。这些影响与循环瘦素和TH1 和 TH17降低多种炎性细胞因子和外周Treg数量增加有关(15). 同样,具有抗糖尿病作用的PPAR-γ激活剂吡格列酮也通过增加胰岛素敏感性和降低循环葡萄糖和瘦素水平,为治疗多发性硬化患者的免疫细胞提供假饥饿的代谢信号(15)。在EAE中,吡格列酮治疗控制了病程,减少了CNS浸润,减少了炎性细胞因子的产生和TH1 和 TH17 分化 (15).此外,有趣的是,经典的抗炎和免疫抑制药物如水杨酸和甲氨蝶呤可以通过激活AMPK将假饥饿的代谢信号传递给免疫细胞(13),以及它们的经典作用机制。总体而言,赋予假饥饿的代谢信号可能对下调自身炎症反应有价值。
值得注意的是,在热量限制期间,T细胞将其转录特征重新编程为抗炎特性,限制组织损伤并延长小鼠和人类的寿命(7,12)。此外,热量限制诱导肠道微生物群广泛适应影响局部和全身免疫代谢的抗炎代谢物的产生(12)。与脂肪细胞衍生的瘦素相互作用的分子可以根据代谢状态以各种方式调节免疫功能。例如,具有食欲刺激活性的神经内分泌介质(如生长素释放肽和神经肽Y)与瘦素的作用相反,不仅对饱腹感而且对外周免疫反应都有相反的作用,因为它们会阻止TH1 和 TH17分泌多种细胞因子并抑制EAE(2)。其余的研究领域包括单一营养素(即脂质、碳水化合物和蛋白质)如何影响免疫自我耐受性的分子解剖,以及热量限制是肥胖相关自身免疫的有效治疗方案的时间窗口。
References
1
1. Lerner, P. Jeremias, T. Matthias, Int. J. Celiac. Dis 3, 151 (2015).
2. P. de Candia et al., J. Exp. Med. 3, 218 (2021).
3. Christ et al., Cell 172, 162 (2018).
4. A. March, D. J. Becker, I. M. Libman, Front. Endocrinol. 22, 12 (2021).
5. K. Hedström et al., Neurol. Neuroimmunol. Neuroinflamm. 8, e912 (2020).
6. M. H. Do et al., J. Exp. Med. 217, e20190848 (2020).
7. P. de Candia, C. Procaccini, C. Russo, M. T. Lepore, G. Matarese, Immunity 55, 1981 (2022).
8. S. P. Bapat et al., Nature 604, 337 (2022).
9. G. Caputa et al., Cell Metab. 34, 747 (2022).
10. E. Y. Wang et al., Nature 595, 283 (2021).
11. J. Zou et al., Cell. Mol. Immunol. 15, 630 (2018).
12. O. Spadaro et al., Science 375, 671 (2022).
13. L. A. O’Neill, D. G. Hardie, Nature 493, 346 (2013).
14. Y. Sun et al., J. Neuroimmunol. 292, 58 (2016).
15. L. Negrotto, M. F. Farez, J. Correale, JAMA Neurol. 73, 520 (2016).
https://m.sciencenet.cn/blog-41174-1382744.html
上一篇:如何撰写学术论文?《科学》访谈
下一篇:嗅觉障碍测试的诊断价值