博文
Cell:葡萄糖代谢与抗病毒免疫——乳酸通过MAVS调控天然免疫
|
天然免疫过程中I型干扰素(IFN)的产生在机体抗病毒感染以及肿瘤免疫监视过程中均发挥至关重要的作用。当病毒入侵机体或细胞内异常的核酸物质暴露时,体内相应的上皮细胞或免疫细胞通过其模式识别受体 (PRRs,pattern recognition receptors)(主要包括RLRs、STING 和TLRs等)结合相关模式分子(PAMPs,pathogen-associated molecular patterns),启动一系列免疫级联反应,产生I型干扰素(IFN)和其他细胞因子,帮助机体清除病原或者激活肿瘤免疫系统。
RNA病毒或细胞内异常存在的短链RNA通常被细胞内的RLRs(RIG-I-like receptors)探测识别,RLRs进而发生构象改变并被招募到线粒体外膜,与关键蛋白MAVS形成中央平台,继续传递信号给下游分子,促使TBK1和IKK激酶活化并磷酸化转录因子IRF3和NF-κB ,最终导致下游IFN和其他关键因子的表达。基于I型IFN在机体抗病毒免疫和抗肿瘤免疫反应中的重要作用,近年来,相关领域的科学家深入探索RLRs信号通路的调控机制,并发掘出一系列调节该通路的关键分子。然而,机体代谢过程往往是各种生命信号的最终执行者。细胞的能量代谢是否参与RLRs信号通路的调控,成为本领域一个未曾可知的重要科学问题。
糖代谢是细胞内能量代谢的最主要方式。葡萄糖进入细胞后,在己糖激酶(Hexokinase,HK)等的催化作用下通过糖酵解代谢成丙酮酸。丙酮酸既可以进入线粒体参与三羧酸 (TCA) 循环和氧化磷酸化,亦可在无氧条件下由乳酸脱氢酶 (LDH) 催化产生乳酸。近年来,尽管已有一些证据表明,细胞内糖代谢与机体内一些免疫细胞如巨噬细胞、T细胞的功能调控密切相关,但糖代谢是否参与先天免疫RLRs信号通路和I型干扰素(IFN)表达的调控还尚未报道。
乳酸曾被认为是糖代谢过程无用的副产物,后续研究中发现乳酸在诸多分子机制的调控中起重要的调节作用,包括调控巨噬细胞极化、辅助T细胞分化以及肿瘤细胞免疫监控的调节。到目前为止,没有确定乳酸的直接蛋白质靶标,乳酸是否通过直接蛋白质靶向参与其他细胞内信号转导和生物学分子机制仍有待确定。视黄酸诱导基因I样受体(retinoic-acid inducible gene I -like receptor)可介导干扰素(IFN)的生产,作为先天免疫的重要组份对病毒清除和癌症免疫监视等方起关键作用。然而,乳酸对调节免疫细胞功能发挥的作用,以及乳酸是否参与RLR信号介导IFN的机理仍然不清楚。
2019年5月30日,美国Wake Forest大学林慧观教授团队(共同一作为张维娜和王桂华博士)在Cell上发表文章Lactate Is a Natural Suppressor of RLR Signaling by Targeting MAVS,首次揭示了糖代谢过程中的代谢物——乳酸在先天免疫RLR信号通路中的抑制作用。张维娜博士现为国家生物医学分析中心副研究员,王桂华博士现为华中科技大学同济医学院附属同济医院副教授、副主任医师。
本项工作中,研究人员通过一组代谢组学的数据发现细胞内糖酵解的中间代谢物在细胞内RLRs信号激活的过程中动态下调,提示糖酵解可能影响RLRs信号激活。进一步研究发现糖酵解过程能够显著抑制RLRs信号通路的激活和IFN的表达,而抑制糖酵解则促进IFN的产生并更有效地控制病毒复制。通过采用一系列改变细胞中糖代谢模式的具体策略,研究人员最终鉴定出乳酸-这一葡萄糖无氧酵解的最终产物,是IFN的直接抑制子。有趣的是,乳酸抑制IFN生成的效应只有在RNA病毒或胞内RNA刺激时有效,对于胞内DNA或者LPS等刺激诱导IFN的过程并无影响。通过进一步的机制探索发现,乳酸能够直接靶向结合MAVS,影响其线粒体正确定位,进一步干扰其与RIG-I 形成复合物并阻止下游通路的激活和IFN的诱导表达。LDHA是介导糖代谢过程中丙酮酸生成乳酸的关键酶,研究人员通过利用小分子抑制剂及LDHA基因敲除小鼠,分别在细胞和整体水平证实了这一结果。
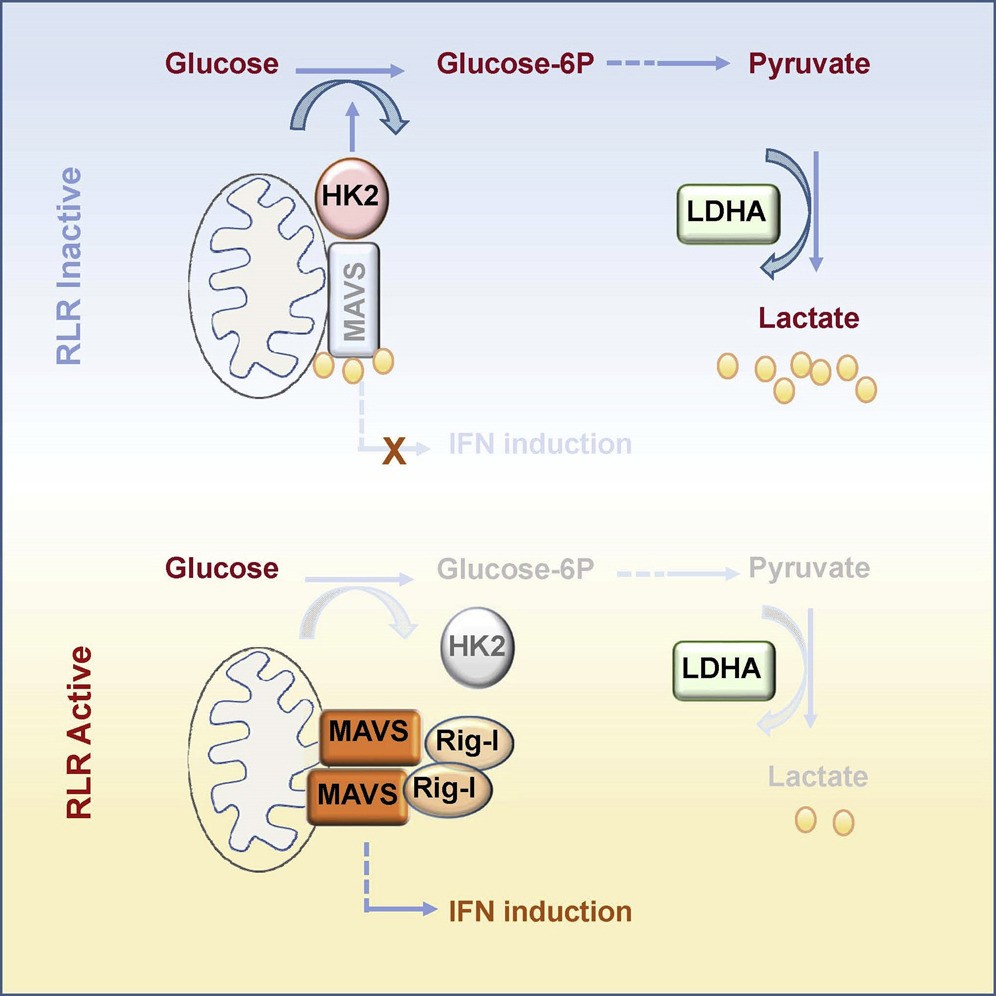
以上研究工作首次提出细胞内糖代谢参与调控RLRs信号通路以及I型IFN的诱导产生,是机体能量代谢参与调控先天免疫的重要创新。曾经的“代谢废物”-乳酸,尽管近年来被发现在多种免疫细胞的分化或功能调控中发挥着重要作用,但其在细胞内的作用位点始终未被解析。本项研究发现了一个细胞内乳酸的感应分子-MAVS,通过结合并靶向MAVS,乳酸在调控RLRs信号通路以及I型IFN的诱导产生中发挥重要作用。众所周知,大多数癌细胞即使在有氧条件下也依然“钟情”酵解过程,产生大量乳酸,以利于癌细胞的生存和增殖被称为“Warburg 效应”。鉴于I型IFN在激活肿瘤免疫中发挥着不可或缺的作用,“狡猾”的肿瘤细胞通过“Warburg 效应”产生大量乳酸,使其周围能够产生IFN的细胞成为“无能细胞”,进一步促进肿瘤区域的免疫抑制。
为揭示RLRs信号激活过程中机体糖酵解水平下降的具体原因,研究人员发现糖酵解第一个关键的限速酶HK活性在RLRs激活早期明显下降。同MAVS一样,HK也是线粒体外膜蛋白。经过进一步实验探索,研究人员发现在生理情况下MAVS能够结合HK2,并对维持HK的活性至关重要。而当细胞接受到胞内RNA刺激激活RLRs信号时,激活的RIG-I通过CARD结构域“捕获”MAVS,激活下游分子,产生干扰素。此时,寡聚化的MAVS与HK2解离,HK活性下降,进而导致糖酵解被抑制。
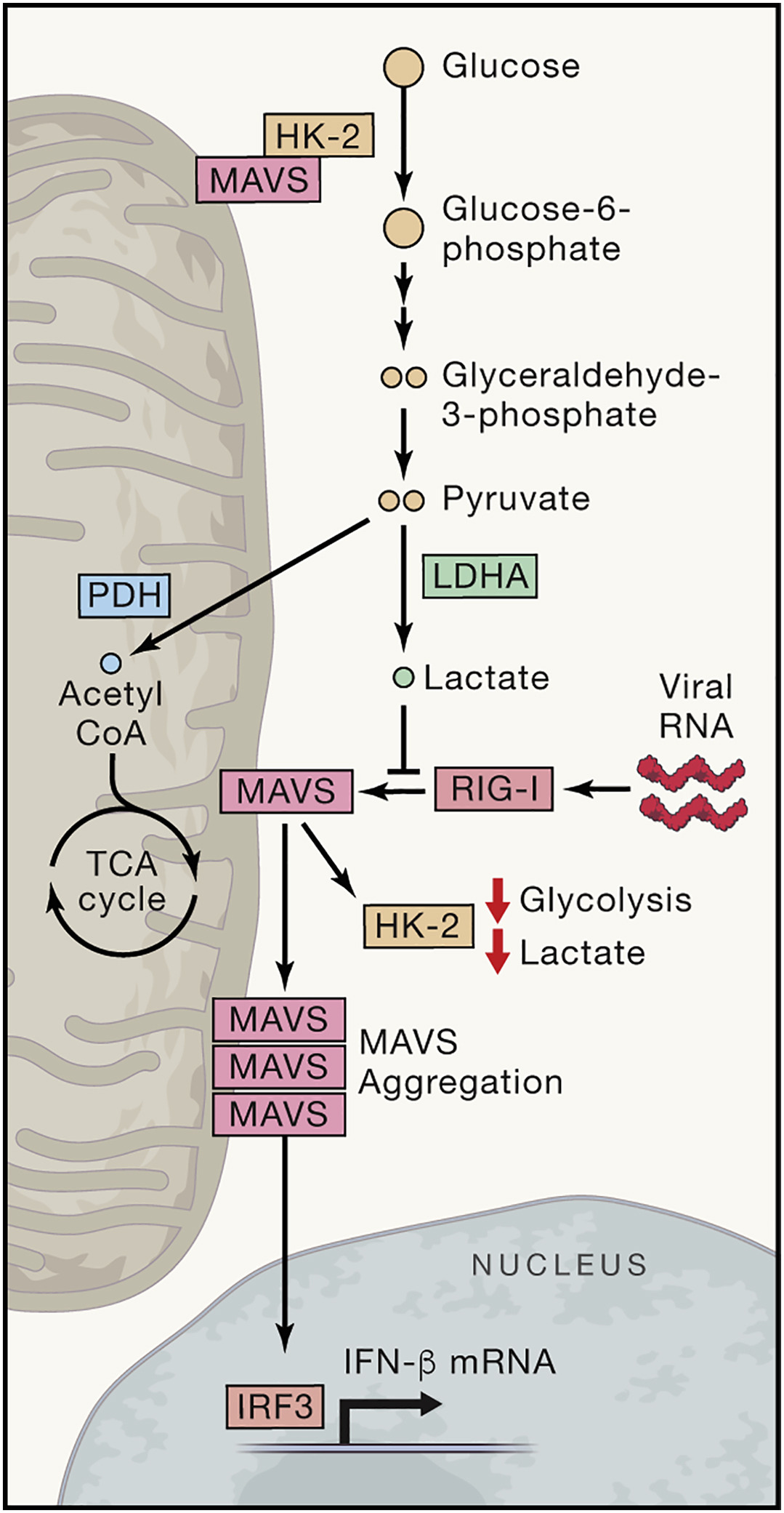
总之,该研究工作首次揭示了机体糖代谢过程和先天免疫RLRs信号通路的重要交互调控,鉴定出此过程中乳酸在细胞内的感应分子-MAVS。此外,发现先天免疫的关键接头蛋白MAVS能够结合糖酵解重要限速酶-HK2,且该结合在RLRs通路激活时被RIG-I破坏。通过靶向抑制乳酸生成过程,能够有效促进I型IFN产生和RNA病毒清除。以上发现为病毒感染引发的相关疾病和基于代谢紊乱的肿瘤防治提供了理论依据和潜在的分子靶标,具有十分重要的意义。
原文链接:https://doi.org/10.1016/j.cell.2019.05.003
亮点:Highlights
•Lactate inhibits RLR-mediated interferon production
•This regulation occurs through direct sensing of lactate by MAVS
•MAVS associates with hexokinase, but this association is disrupted by RIG-I
•Targeting LDHA enhances type I IFN production and viral clearance
摘要:RLR-mediated type I IFN production plays a pivotal role in elevating host immunity for viral clearance and cancer immune surveillance. Here, we report that glycolysis, which is inactivated during RLR activation, serves as a barrier to impede type I IFN production upon RLR activation. RLR-triggered MAVS-RIG-I recognition hijacks hexokinase binding to MAVS, leading to the impairment of hexokinase mitochondria localization and activation. Lactate serves as a key metabolite responsible for glycolysis-mediated RLR signaling inhibition by directly binding to MAVS transmembrane (TM) domain and preventing MAVS aggregation. Notably, lactate restoration reverses increased IFN production caused by lactate deficiency. Using pharmacological and genetic approaches, we show that lactate reduction by lactate dehydrogenase A (LDHA) inactivation heightens type I IFN production to protect mice from viral infection. Our study establishes a critical role of glycolysis-derived lactate in limiting RLR signaling and identifies MAVS as a direct sensor of lactate, which functions to connect energy metabolism and innate immunity.
关键词Keywords: lactate; glucose metabolism; RLR signaling; interferon; MAVS
专家述评: Viral infection causes the host to activate an antiviral response that, in part, is dependent on mitochondrial antiviral signaling protein (MAVS) to stimulate type I interferons. Zhang et al. (2019) demonstrate that glucose-generated lactate interacts with MAVS to suppress type I interferons. This study links glucose metabolism to antiviral responses. https://www.sciencedirect.com/science/article/pii/S0092867419306282
参考文献:
Weina Zhang, Guihua Wang, Zhi-Gang Xu, Haiqing Tu, Fuqing Hu, Jiang Dai, Yan Chang, Yaqi Chen, Yanjun Lu, Haolong Zeng, Zhen Cai, Fei Han, Chuan Xu, Guoxiang Jin, Li Sun, Bo-Syong Pan, Shiue-Wei Lai, Che-Chia Hsu, Jia Xu, Zhong-Zhu Chen, Hong-Yu Li, Pankaj Seth, Junbo Hu, Xuemin Zhang, Huiyan Li, Hui-Kuan Lin, Lactate Is a Natural Suppressor of RLR Signaling by Targeting MAVS, Cell, Volume 178, Issue 1, 2019, Pages 176-189.e15
Joshua S. Stoolman, Navdeep S. Chandel, Glucose Metabolism Linked to Antiviral Responses, Cell, Volume 178, Issue 1, 2019, Pages 10-11
https://m.sciencenet.cn/blog-446272-1357969.html
上一篇:代谢酶:谷草转氨酶GOT2与肿瘤微环境&病毒感染
下一篇:乳酸在肿瘤中的作用Lactate: A Metabolic Driver in the Tumour Landscape