博文
《细胞—干细胞》:赖良学/戴祯/Miguel A. Esteban/潘光锦团队合作在猪体内再生人源中肾
||
肾脏移植是针对终末期肾脏疾病(ESKD)的首选治疗手段,但由于供体肾源严重短缺,大量的患者仍无法进行肾脏移植。目前,全球每年约120万人死于肾衰竭,500万患者接受肾透析。
为了解决这一问题,科学家们将目光转向了再生医学领域,希望借助生物工程技术来发掘新的器官来源。
中国科学院广州生物医药与健康研究院的赖良学研究员、戴祯研究员、Miguel A. Esteban研究员以及潘光锦研究员经过多年的不懈努力,协同攻关,在世界范围内首次成功利用人多能干细胞在猪体内再生了人源中肾。这也是世界范围内首次报道的人源功能性实质器官异种体内再生。
北京时间2023年9月7日晚,《细胞—干细胞》以封面形式在线报道了这一研究成果。这也将是人类借助生物工程技术解决供体器官短缺这一世界难题的重要一步。

基于胚胎补偿技术的器官异种体内再生是再生医学领域的新兴方法。通过在大动物体内培育患者自身细胞来源的器官,理论上其将具有更为全面的细胞类型以及更为完善的器官结构及功能;同时也将能够有效的避免异种器官移植乃至同种异体器官移植中所存在的免疫排斥等问题[1]。基于以上优势,该策略已被视为未来用于解决供体器官短缺的最为理想方案。
大量基于啮齿类动物的研究证明了借助胚胎补偿技术实现器官异种体内再生的可行性[2]。近两年,也有团队报道成功利用人源多能干细胞在猪体内再造了人源血管内皮及肌肉组织[3, 4]。然而到目前为止,能否在异种大动物体内再生机构更为复杂人器官仍是一个未知数。
作为人体泌尿系统最为主要的器官,肾脏具有更为复杂的结构及功能,并有着相较于其他实质脏器更为特殊的发育过程。这些特殊性无疑将极大程度上增加针对肾脏进行异种体内再造的难度。因而,基于胚胎补偿技术的肾脏异种体内再造仍是一项艰巨的挑战。
细胞所处的多能状态会影响供体细胞在异种体内的嵌合能力和分化潜能[5]。同时,由于异种体内宿主细胞的竞争以及其在异种体内生存环境的压力,供体细胞将会大量凋亡流失,因而其生存能力也将直接决定异种嵌合能否成功[6]。鉴于肾脏具有复杂的结构及发育进程,针对其进行器官异种体内再生时需要重塑多种细胞谱系。这也就意味着用于进行肾脏异种体内再生的人多能干细胞(hPSCs)需要具有更高的分化潜能,更强的竞争能力及抗凋亡能力。
在前期研究中,赖良学课题组与潘光锦课题组合作发现过表达促增殖基因MYCN及抗凋亡基因BCL2能够有效地增强人诱导多能干细胞(hiPSCs)在异种胚胎中的竞争优势及生存能力[7]。同年,Miguel A. Esteban团队成功地开发了可用于高效获取人类早期胚胎样干细胞的培养体系—4CL[8]。结合两者优势,合作团队利用4CL培养体系对过表达MYCN/BCL2基因的hiPSCs进行培养,获得了具有更高嵌合能力,更强竞争及增殖能力的新型hiPSCs,并将其命名为4CL/N/B细胞。通过对4CL/N/B细胞进行单细胞测序及多项体外胚胎水平检测(细胞凋亡情况、与宿主建立功能连接情况以及分化情况),研究人员证实该细胞不仅具有与早期胚胎阶段极为相似的表达谱,更为完善的多能性基因表达,也在猪胚胎中表现出更强的存活能力以及分化潜能。
嵌合胚胎需在体外培养至囊胚阶段再进行移植。体外培养期间,嵌合胚胎的培养基同时影响着猪胚胎及人供体细胞的发育。同时,供体细胞的注射时期及注射数量均会影响嵌合胚胎的质量进而影响体内嵌合水平。因此在获得理想的人源供体干细胞后,研究人员又对胚胎补偿技术体系进行了全方位的优化,基于体外嵌合胚胎的数据,研究人员最终确定了较为理想的胚胎补偿技术体系,即在桑葚到早期囊胚时期注射人源供体细胞,注射数量控制在3-5个,重构嵌合胚胎在移植前需利用4CL培养基与猪胚胎培养基PZM等比例混合的培养基培养,从而提高阳性囊胚发育率,获得适于器官异种体内再生的高质量重构嵌合胚胎。
构建器官缺陷动物模型的方案通常是敲除单一的器官发育关键基因。但如肾脏等结构及功能复杂的器官,经历前肾、中肾、后肾三个发育阶段,同时受多种基因调控[9]。因而,单一基因敲除可能无法实现器官的全发育阶段缺失,不足以构建理想的器官缺陷猪模型。为了构建肾脏生态位空缺更为充足的器官缺陷猪模型,研究人员首先利用缺失输尿管芽分支关键基因SIX1的猪胎儿成纤维细胞进行体细胞核移植。之后,借助碱基编辑器CBE,结合胚胎显微操作技术,敲除了后肾间质发育关键基因SALL1,借此成功构建了SIX1/SALL1双基因敲除的肾脏缺陷猪模型。基于该策略获得的肾脏缺陷猪模型中肾发育缺陷、后肾完全缺失,具有更为充足的器官生态位空缺,为人体肾脏的在猪体内的发育创造了适宜的生态环境。
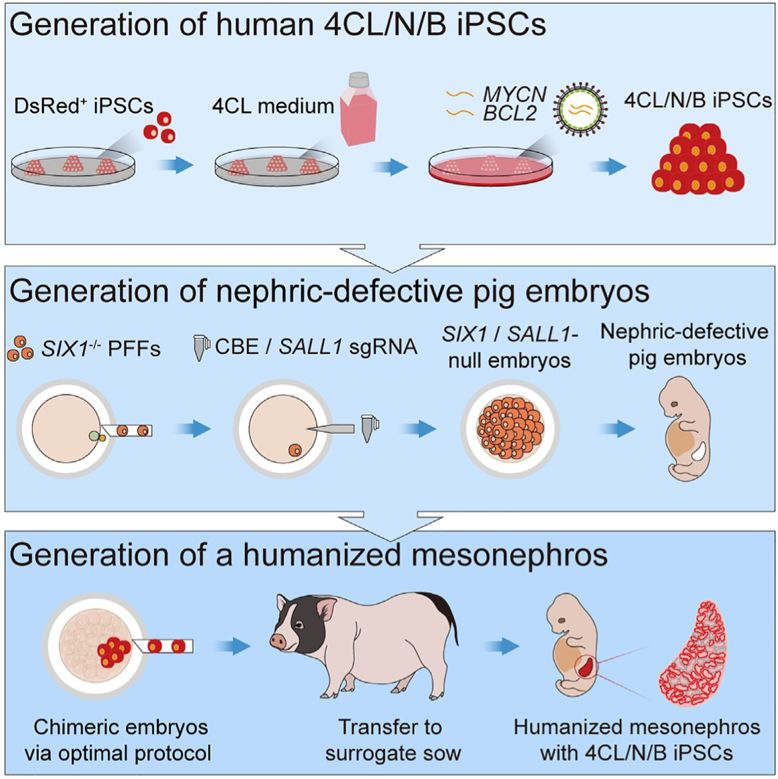
将高分化潜能、强竞争及抗凋亡能力的人源多能干细胞与优化的胚胎补偿技术体系、新型双基因修饰肾脏缺陷猪模型的组合在一起,研究人员经过集体攻关,最终成功实现了人源化中肾的异种体内再生。研究人员严格依照伦理要求,分别在怀孕25天和28天终止妊娠,共获得25日龄中肾嵌合胎儿2只,28日龄中肾嵌合胎儿3只。经体视荧光检测,这些嵌合胎儿的肾脏区域均存在大量红色荧光。
通过免疫荧光染色进一步检测显示,嵌合胎儿中肾内的确存在大量人源细胞组成的中肾小管。经统计,嵌合胎儿中肾内人源细胞占比最高可达70%,人源细胞参与形成的中肾小管所占比例最高可达58%。基于qPCR的分子水平检测结果表明,人源细胞在嵌合胎儿中的占比最高可达万分之一。更为重要的是,针对肾脏发育关键功能性基因SIX1,SALL1,PAX2及WT1的免疫荧光染色结果表明,人源供体细胞能够分化成为具有肾脏功能的细胞,说明伴随着胚胎发育,肾脏缺陷猪胎儿体内的人源供体细胞将能够支持人源肾脏生成。同时,研究人员也对嵌合胎儿的神经及生殖嵴特异性marker基因进行免疫荧光染色,结果显示4CL/N/B细胞并未参与嵌合胎儿生殖嵴形成,只有极少量的4CL/N/B细胞参与了神经系统的发育。
综上,该研究借助具有高分化潜能,强增殖及抗凋亡能力的早期胚胎样人源多能干细胞在多基因修饰的器官缺陷猪模型体内再生了人源中肾。进而在世界范围内首次证明了借助胚胎补偿技术实现实质性功能器官异种体内再生的可行性。这一重要突破不仅为人源器官异种体内再生奠定了重要的理论及技术基础。也将对未来解决供体器官短缺这一世界级难题具有重要价值。
中国科学院广州生物医药与健康研究院博士后王教伟、谢文广,副研究员栗楠、李文娟以及博士研究生张智帅为该论文的共同第一作者。中国科学院广州生物医药与健康研究院赖良学研究员、戴祯研究员、Miguel A. Esteban研究员以及潘光锦研究员为共同通讯作者。
本研究由中国科学院战略先导项目、国家重点研发计划等基金资助。
相关论文信息:
https://doi.org/10.1016/j.stem.2023.08.003
参考文献
1. Rashid, T., T. Kobayashi, and H. Nakauchi, Revisiting the flight of Icarus: making human organs from PSCs with large animal chimeras. Cell Stem Cell, 2014. 15(4): p. 406-409. 2. Zheng, C., E.B. Ballard, and J. Wu, The road to generating transplantable organs: from blastocyst complementation to interspecies chimeras. Development, 2021. 148(12). 3. Das, S., et al., Generation of human endothelium in pig embryos deficient in ETV2. Nat Biotechnol, 2020. 38(3): p. 297-302. 4. Maeng, G., et al., Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos. Nat Biomed Eng, 2021. 5(8): p. 805-814. 5. De Los Angeles, A. and J. Wu, New concepts for generating interspecies chimeras using human pluripotent stem cells. Protein Cell, 2022. 13(4): p. 234-238. 6. Masaki, H., et al., Inhibition of Apoptosis Overcomes Stage-Related Compatibility Barriers to Chimera Formation in Mouse Embryos. Cell Stem Cell, 2016. 19(5): p. 587-592. 7. Zhu, Y., et al., Generating functional cells through enhanced interspecies chimerism with human pluripotent stem cells. Stem Cell Reports, 2022. 17(5): p. 1059-1069. 8. Mazid, M.A., et al., Rolling back human pluripotent stem cells to an eight-cell embryo-like stage. Nature, 2022. 605(7909): p. 315-324. 9. Smyth, I.M., et al., Development of the Kidney, in Fetal and Neonatal Physiology. 2017. p. 953-964.e4.
https://m.sciencenet.cn/blog-3423233-1401875.html
上一篇:《细胞—干细胞》:吴军/于乐谦团队建立新一代人类“类囊胚”并探索母胎对话
下一篇:《细胞—代谢》:季节性光照时间会调节小鼠的外周时钟和能量代谢