博文
《细胞报告》:杨章华/莫玮团队首次报道一个内源左旋核酸识别的精确调控机制
||
2024年5月15日,浙江大学医学院附属邵逸夫医院/良渚实验室的杨章华/莫玮团队在Cell Reports上发表了题为“A ZBP1 isoform blocks ZBP1-mediated cell death” 的研究成果。
该研究报道了ZBP1的两个同源异构体相互竞争左旋核酸,从而调控左旋核酸激活的固有免疫与细胞死亡,为靶向ZBP1的免疫抑制和程序性细胞死亡调控提供了新的思路和策略。
厦门大学细胞应激生物学国家重点实验室博士研究生蔡治煜和吴璞琦为该论文的共同第一作者。杨章华研究员和莫玮教授为该论文的共同通讯作者。

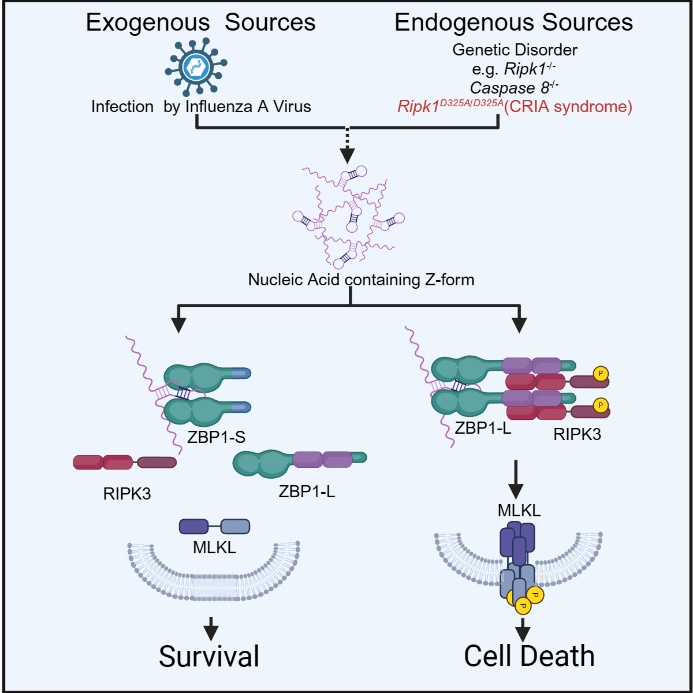
左旋核酸是一类具有特殊空间特征的稀有核酸类型,具有高能荷、不稳定的特征。经典的生物学理论背景下,它被认为是天然无法稳定存在的。然而,事实并非如此。近期,大量工作报道了,在不同的病理状况下,左旋核酸都能够在细胞中出现,并诱导固有免疫反应的激活,甚至细胞程序性死亡。目前已经发现左旋核酸出现的病理场景包含内源性左旋核酸场景(表观遗传失控导致的内源性逆转录病毒重激活、遗传突变导致的核酸编辑酶识别无能、线粒体拓扑异构酶的功能缺陷等)和外源性左旋核酸场景(流感病毒感染、痘苗病毒感染(VACV)、单纯疱疹病毒感染(HSV)、鼠巨细胞病毒感染(MCMV)和新型冠状病毒感染等)。
生物体如何对这种稀有的核酸类型的出现做出响应呢?因为从病毒到高等哺乳动物的生物体中,存在一系列的左旋核酸结合蛋白,它们具有经典的左旋核酸识别结构域“Zα结构域“,能够特异性识别左旋核酸,并介导下游的生物学事件。在哺乳动物中,只有两个能够表达出含有Zα功能域蛋白的基因,ZBP1和ADAR1。ADAR1作为能够识别左旋核酸的核酸编辑酶,主要发挥的是左旋核酸数量控制的功能。ZBP1作为能够识别左旋核酸并介导下游固有免疫活化,激活程序性细胞死亡的蛋白,是哺乳动物中唯一能够响应左旋核酸的固有免疫感受器蛋白。ZBP1具有三类主要的功能结构域,其中包括:N端执行左旋核酸识别功能的Zα结构域;居于中间的RHIM结构域,具有与程序性细胞死亡相关蛋白RIPK1\RIPK3结合并传递信号的能力;C段结构域,能够直接与IRF3和TBK1相互作用,激活一型干扰素信号通路。对于病毒感染相关的外源性左旋核酸场景,ZBP1介导的细胞死亡和固有免疫激活能够抑制病毒的复制,促进免疫细胞的招募,有助于病毒的清除和个体的存活。从宿主的角度出发,这是有利的生物学事件,而从病毒的角度来看,这是一个非常致命的机制,因此,病毒进化出一系列的机制拮抗ZBP1介导的程序性细胞死亡。单纯疱疹病毒蛋白ICP6和ICP10、鼠巨细胞病毒病毒M45通过它们的RHIM结构域,抑制ZBP1通过其RHIM结构域将死亡信号传递给下游蛋白。痘苗病毒蛋白E3L通过其Zα结构域,抑制ZBP1对于左旋核酸的识别,从而抑制程序性细胞死亡。
外源性左旋核酸介导的细胞死亡和炎症能够被病毒蛋白所调控,那么内源左旋核酸介导的细胞死亡如何受到精确的调控呢?表观修饰酶SETDB1 通过转录抑制作用,可以抑制内源性逆转录病毒来源的左旋核酸的产生。核酸编辑酶ADAR1可以通过Zα结构域识别并消除内源性左旋核酸。程序性细胞死亡关键蛋白RIPK1可以通过RHIM结构域阻止ZBP1将死亡信号传递给下游RIPK3。综上所述,已有的发现揭示了控制左旋核酸产生的机制和识别激活后的信号负调控,关于细胞内源针对左旋核酸识别的精确调控机制却所知甚少。
在哺乳动物体内,ZBP1有不同的同源异构体,其中有两个比较典型,一个同时含有左旋核酸的识别结构域(Zα)和死亡信号传递结构域(RHIM),后文中将其称为ZBP1-L,一个只含有左旋核酸识别结构域(Zα),后文中将其称为ZBP1-S。两者在多组织中均有表达,并且都受到干扰素的诱导表达调控,但是从转录水平上来看,ZBP1-S对于干扰素刺激响应更加敏感。研究人员通过过表达和敲降实验,发现ZBP-S能够抑制左旋核酸-ZBP1-L信号通路的激活,并且通过左旋核酸结合功能突变实验证实了该抑制作用依赖于ZBP1-S的左旋核酸结合结构域。最后,在CRIA(cleavage-resistant RIPK1-induced autoinflammatory)综合征细胞模型中发现,ZBP1-S的缺陷使得细胞发生自发的坏死性凋亡,而这种坏死性凋亡来源于左旋核酸-ZBP1-L信号通路的异常激活,进一步说明了ZBP1-S对于左旋核酸-ZBP1-L信号通路的负调控功能,并为CRIA综合征的靶向治疗提供了新的思路和策略。
该研究首次报道了一个内源左旋核酸识别的精确调控机制,并在一个全新的病理场景下阐述了该调控机制的重要性,展现了一个基因两个转录本翻译的不同蛋白相互拮抗,共同维持细胞内左旋核酸信号环境稳态的精密调控机制,不禁让人感叹微观世界的大智慧,细胞信号调控的太极图!
莫玮团队近年的工作围绕左旋核酸感应和调控,发现其在炎症相关疾病中的病理作用,相关成果发表于Nature(2020)、Neuron(2023)等杂志。诚邀各领域的优秀人才加入与合作,共同致力于神经退变、自身免疫以及肿瘤免疫的研究;岗位包括博士研究生,博士后,科研助理以及特聘研究员。如有兴趣,请联系莫玮教授(E-mail: weimo@zju.edu.cn)或杨章华研究员(E-mail: zhanghuayang@zju.edu.cn)。
相关论文信息:
https://doi.org/10.1016/j.celrep.2024.114221
https://m.sciencenet.cn/blog-3423233-1435169.html
上一篇:《自然》:蒋轶/徐华强/杨德华合作破解去甲肾上腺素转运体二聚化和抗抑郁药识别的分子密码
下一篇:《自然—生物医学工程》:曹罡/戴金霞团队合作开发新型空间组学技术MiP-seq