博文
芬太尼的成瘾由两条不同的神经通路负责
|
神经科学家发现,阿片类药物芬太尼的成瘾属性由两条不同的神经通路负责:一条介导奖励,另一条促进寻求缓解戒断症状。
芬太尼是一种强效且快速起效的阿片类药物。《自然》杂志上,Chaudun等人报道了对芬太尼促进成瘾机制理解的重要进展。
2022年,在美国与药物过量相关的10.8万例死亡中,大约有四分之三是由阿片类药物引起的。美国的阿片类药物流行病是一出三幕悲剧。25年前,由于不负责任地开处用于止痛的阿片类药物,导致大量人群形成了阿片类药物成瘾,此后海洛因开始作为滥用药物占据主导地位。最后,合成阿片类药物芬太尼逐渐取代了海洛因,进一步增加了总体死亡率2。尽管在美国以外的地方并未见到同样的增长,但阿片类药物是全球最致命的药物类别,与不使用这些药物的人相比,使用者的死亡风险高出十倍3。
鉴于其对公共卫生的影响,科学家们对阿片类药物引起成瘾的机制的理解仍然存在令人惊讶的空白。促进药物使用的两种效应分别是主观的奖励感和消除不适感时的解脱感,前者通过正向强化促进服药行为,后者通过负向强化促进行为。释放多巴胺的神经元位于大脑腹侧被盖区(VTA),被认为是这一现象的关键。另一种效应是在戒断期间最明显看到的解脱感,通过广泛激活涉及厌恶或“反奖励”系统的神经回路进行介导4。
但是,阿片类药物是如何产生这些效应的呢?对于它们与奖励相关的作用,一个流行的假设是它们激活了表达在VTA局部抑制性神经元上的µ-阿片受体(µORs),这些神经元释放神经递质GABA。这些GABA神经元的失活导致了同一区域细胞体的多巴胺神经元的解抑。然而,也有其他机制被提出,多巴胺神经元在阿片类奖励中的作用仍有争议5–7。关于阿片类药物如何介导负向强化,人们了解得更少。
为了解决这些问题,Chaudun及其同事绘制了小鼠对单独注射芬太尼或几天后注射阿片阻断剂纳洛酮以引发芬太尼戒断时的反应的神经活动图。单独注射芬太尼时,一种称为cFOS的蛋白质——神经元活动的标记物——在VTA及其多巴胺神经元投射的区域——伏隔核(统称为中脑边缘多巴胺通路)中表达。相比之下,引发戒断时在称为中央杏仁核的结构中诱导了cFOS表达,这是参与压力和厌恶的大脑网络中的一个关键节点。
为了确定这些大脑区域的激活与芬太尼相关行为之间是否存在因果关系,作者人为地减少了(敲减)了他们通过cFOS映射所识别的大脑区域中µORs的表达。正如预期的那样,他们发现在VTA和伏隔核中敲减µORs后,反映正向强化的行为减少了,而在中央杏仁核中敲减则特别减少了逃避跳跃,这是小鼠在经历戒断时看到的行为之一。
然后,作者使用一种称为纤维光度学的成像技术检查了介导这两种现象的神经通路。这测量了神经元钙水平的增加,作为神经细胞活动的指标。团队确认了由芬太尼引起的VTA中多巴胺神经元的激活以及随后多巴胺释放到伏隔核是由µOR表达的GABA神经元在基础条件下对其邻近多巴胺神经元施加的抑制被移除所致。
未先前暴露于芬太尼的小鼠注射纳洛酮并未受影响。相比之下,在依赖芬太尼的动物中,纳洛酮引起了GABA神经元的反弹活动,并伴随着多巴胺神经元活动的减少——有效地抑制了奖励通路。小鼠还学会了按压杠杆以选择性地抑制通过表达抑制性光敏蛋白和激光传递而处于“光遗传学”控制下的VTA GABA神经元的活动。当注射了芬太尼时,这种行为大部分被阻止,表明芬太尼产生了相同的效果。这与之前对海洛因的研究结果一致8。这些数据强烈支持激活中脑边缘多巴胺通路对于阿片类药物的正向强化效应是必要的这一观点。
鉴于在中央杏仁核中敲减µORs特别减少了戒断引发的逃避跳跃,作者接下来调查了这一区域的神经元是如何促进负向强化的。首先,他们发现中央杏仁核中大多数表达µORs的神经元也表达酶PKCδ,但不表达肽激素生长抑素。这一点值得注意,因为中央杏仁核中的PKCδ表达神经元促进厌恶9,10,并且参与类似成瘾的行为11,12。此外,在依赖芬太尼的动物中,纳洛酮引发的戒断促进了表达µORs(但不表达生长抑素)的中央杏仁核神经元的激活,并暂时增加了它们的钙活动。在他们的最后一组实验中,作者展示了小鼠避开了一个它们接受中央杏仁核中µOR-表达神经元的人工刺激的腔室。小鼠还学会了按压杠杆以关闭这些神经元的光遗传学刺激,有效地缓解了自己的不适。这些观察结果强烈表明,这群神经元的活动构成了阿片类戒断中负向强化的基础。
总的来说,这些数据显示,芬太尼诱导的正向和负向强化是由不同的神经元群体介导的。VTA中的多巴胺神经元的活动在正向强化中起关键作用,而中央杏仁核对一系列戒断症状负责,并有助于负向强化。已知中央杏仁核向其发送信号的区域,如纹状体床核、外侧旁桥核和中脑水管周围灰质,可能参与了介导其在负向强化中的效果(见图1)。
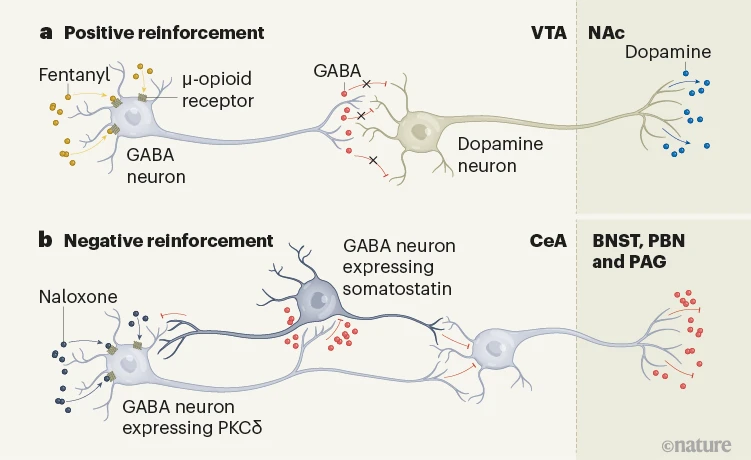
图1 | 芬太尼成瘾背后的不同大脑通路。a,Chaudun等人1报道,在小鼠的大脑中,芬太尼与表达在位于腹侧被盖区(VTA)的神经元上的µ-阿片受体(µORs)结合,这些神经元释放神经递质GABA。抑制这些神经元减少了GABA对邻近的多巴胺释放神经元的释放,解除了对它们的抑制,促进了多巴胺在伏隔核(NAc)中的神经元上的释放。这条奖励通路的激活支持了芬太尼的正向强化。b,在依赖芬太尼的小鼠中,通过给予µOR阻断剂纳洛酮引发戒断,激活了中央杏仁核(CeA)中一个亚群释放GABA的神经元(这些神经元也表达酶PKCδ)。这些神经元的激活触发了与戒断相关的不适感,而避免这种状态的动机支持了芬太尼的负向强化。这可能是通过对表达蛋白质生长抑素的邻近GABA神经元增加抑制来实现的,或者是通过控制位于CeA不同部分的GABA神经元来实现的,这些神经元向目标区域如纹状体床核(BNST)、旁桥核(PBN)或中脑水管周围灰质(PAG)发送神经投影。
正如大多数重要进展一样,Chaudun及其同事提出的新问题。芬太尼的作用机制是否适用于其他阿片类药物?这似乎很可能,但由于这些药物效果的差异——或许最关键的是它们的效力和作用在身体上的速度——不同阿片类药物之间正向和负向强化的相对作用可能不同。
此外,这里确定的负向强化机制是否在急性戒断之外还有作用?这与临床相关,因为临床上,戒断大约在五天内消散,但大多数患者在此之后很久才复发13。当前研究中确定的机制仍可能参与复吸,因为暴露于与药物相关的线索可以触发‘条件性’戒断的主观体验14——在这种情况下,患有阿片类药物成瘾的人在与阿片类药物使用相关的环境下经历戒断症状。因此,确定条件性阿片类药物戒断是否也激活了维持负向强化的中央杏仁核神经元至关重要。如果是这样,那将为开发能够选择性抑制这些神经元活动的药物提供强有力的理由。无论如何,Chaudun及其同事的发现代表了科学家们理解阿片类药物如何促进成瘾的重大进展。
https://m.sciencenet.cn/blog-41174-1435354.html
上一篇:磁控镁释放氢气疗法的研究
下一篇:纳米比亚达马拉带新大陆氢气田