博文
链球菌溶素O对分子氧敏感但与“二硫键”无关
|||
摘要 国内“医学微生物学”教材解释SLO对分子氧敏感,是因为在氧化态时SLO可形成链内二硫键。但国外学者在20余年前就指出,SLO(CDCs家族)肽链内只有1个半胱氨酸残基(Cys,C),有的CDC甚至1个Cys也没有,根本不可能形成链内二硫键。因此CDCs对氧敏感与二硫键无关。
链球菌溶素O(streptolysin O,SLO;肽链长571aa)属于细菌膜穿孔蛋白家族(family of poreforming proteins),由于这个家族绝大多数成员的膜受体都是胆固醇,所以命名为“胆固醇依赖溶细胞毒素家族(cholesterol-dependent cytolysins,CDCs)”。除SLO外,CDC家族还有肺炎球菌溶素O(pneumolysin
O, PLY;471aa)、产气荚膜杆菌溶素O(perfringolysin O,PFO;499aa;θ毒素)、李斯特菌溶素O(listeriolysin
O,LLO;529aa)、斯氏李斯特菌溶素(seeligeriolysin,LSO;530aa)、蜂房杆菌溶素(Alveolysin,ALY;512aa)、腊状溶素O(Cereolysin O,CLY,509aa)等二十几种。CDC家族中大多数毒素的氨基酸序列、结构域及其分子构象均已清楚。CDCs有几个共同的突出特点:
一、分子构像类似L回飞棒形
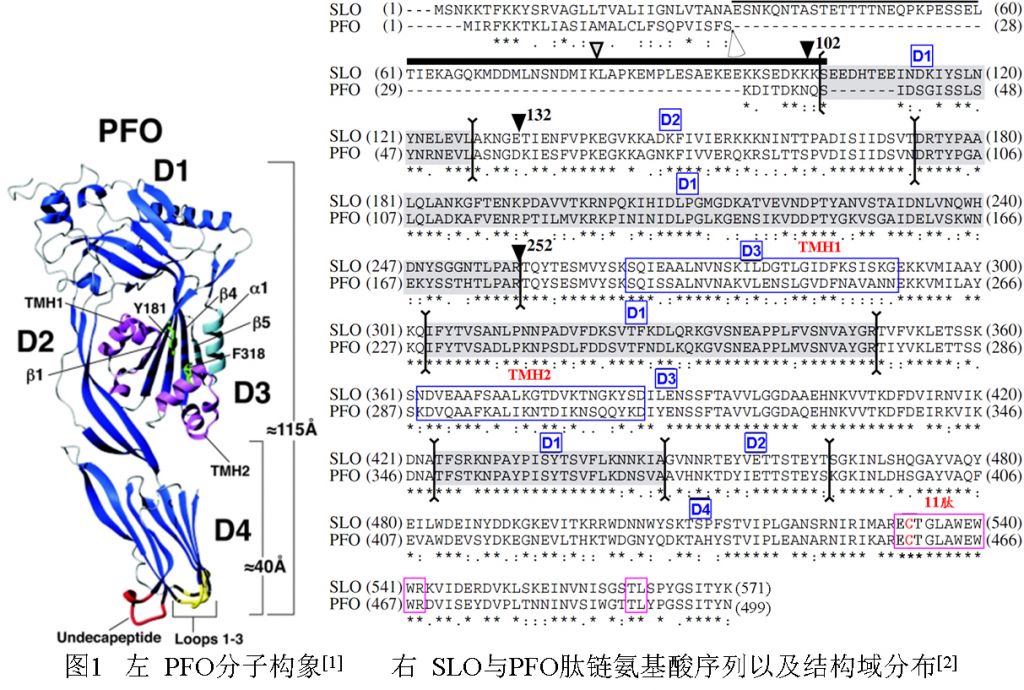
CDCs家族成员的分子构象一般为L回飞棒形(boomerang-shaped),有4个(D1~D4)不连续的桶状结构域[1,2](见图1)。
以PFO为例(图1),结构域D1(37–53,90–178,229–274,350–373aa)可能与D2一道起聚合作用以及促使D3插入细胞膜脂质层;D2(54–89,374–390aa)结构域通过一个甘氨酸(Gly392)与D4连接, 此外D2与D4之间的带电荷氨基酸(Lys70-Glu446)可借硫酸盐形成离子键(SO22—)相连;在D4区与胆固醇结合后,D2可变构;D3(179–228,275–349aa)含2个α-螺旋集束,形成两性“跨膜发夹结构(transmembrane β-hairpin, TMH)”(TMH1:190–217aa;TMH2:288–311aa),已证实TMH是CDCs插入细胞膜内结构;CDCs肽链C端为D4区(392–499aa),是一个紧凑的β-桶状区,几乎所有的CDCs-CD4都有一个非常保守的富含色氨酸(Trp,W)11肽段(undecapeptide:NH2-ECTGLAWEWWR-COOH)形成的襻结构[3]。
二、膜受体一般为胆固醇
CDC家族均大多数成员以膜胆固醇为黏附受体,CDC依靠D4区的11肽襻C端富含Trp序列和间隔22aa的L1环的2个保守“Thu-Leu对”[4](参见表1)合起来构成胆固醇结合位点与胆固醇结合。CDC单体分子的D4区识别膜胆固醇,结合在含高密度胆固醇的膜表面。结合后,与D4紧连的D2区变构,从而引起D1变构并挤压D3。D3受挤压后也改变空间构像,暴露两性TMH结构并使其插入细胞膜内。D1和D2区变构后也暴露聚合区,使得若干(>50)单体分子在细胞膜内互相聚合成跨膜中空聚合体(图2)[5]。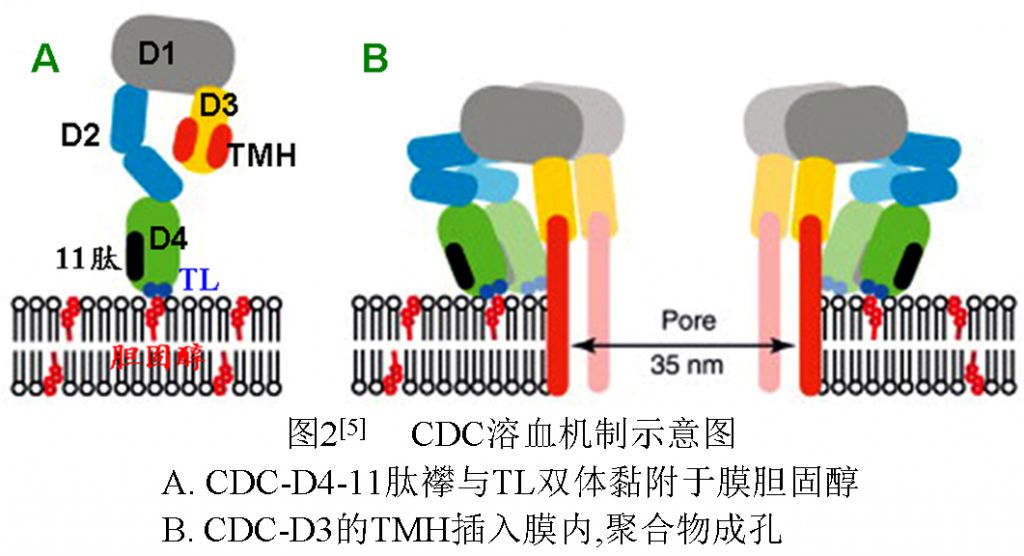

现已证实中间链球菌溶素O(intermedilysin,ILY;532aa)和阴道加德纳菌溶素(Vaginolysin,VLY:516aa)是例外,它们的11肽襻及T-L与其它CDCs的一样可与胆固醇结合,但只是介导单体分子聚合,不能导致膜损伤。它们的主要膜受体是人类CD59(即阻止补体攻膜复合体形成的“膜反应性溶解抑制物”)。以胆固醇作为膜受体的CDC可识别结合人与动物细胞,而以人CD59为受体的ILY和VLY只能识别结合并溶解人细胞。Polekhina等将ILY-D4与PFO-D1/2/3拼接在一起,嵌合体PFOILY-D4竟只能溶解人细胞;而将PFO-D4与ILY-D1/2/3拼接在一起,嵌合体ILYPFO-D4则既能溶解人红细胞又能溶解马红细胞[6],这说明识别细胞决定于D4区。Hughes等人证实:ILY-D4区与11肽的C末端紧接的9肽序列(494WRLIYSKND502,见表1-D画虚线序列)与补体C9的249—257aa区段同源,也像C9一样可与人CD59的42—58aa区域结合[7]。
CDCs单体分子与膜受体结合后,有两种聚合方式:一是以PFO为代表,单体分子黏附胆固醇后插入膜浅表(或锚定在膜表面),单体分子在膜表面聚合后再插入膜内(图3左A)。这种聚合方式,膜表面形成的CDCs聚合物未插入膜内时称为“前孔(prepore)”,插入膜内后称为“孔(pore)”;二是以SLO为代表,首先是1个或极少几个单体分子与膜胆固醇分子结合后插入膜内,然后其它单体分子以此为基点依次线性植入膜内,排列成弓形(图3左B)。弓形聚合物形成后,可能在其相对的游离边发生“切割”,细胞膜上出现弓形损伤,最终导致规则或不规则的环形损伤。在电镜下,可见细胞膜上出现1个由许多(40~125个)单体分子聚合形成的冠状双层,即外层环的单体分子疏水面朝外、内层环的单体分子亲水面朝内的大孔径(φ~25nm)跨膜孔(图3右)[8],比葡萄球菌溶血素α-Hly七聚体和补体攻膜复合体的跨膜孔都大,甚至允许蛋白质等大分子轻易外泄,最终导致细胞溶解。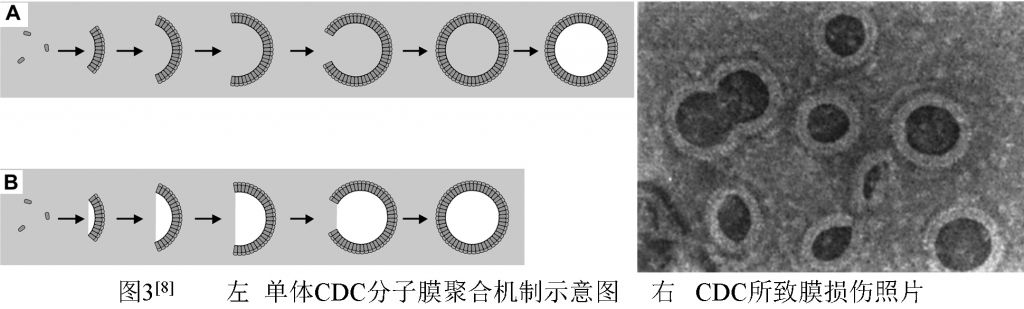

三、有分子氧(O2)存在时可逆性失去溶细胞毒性
在有游离氧分子存在时,毒素可逆性失去溶细胞毒性,加入还原剂(半胱氨酸或硫醇等)又重新恢复溶血毒性,故CDCs也称之为“硫醇活化溶细胞毒素家族(thiol-activated cytolysin,TACY)”。
国内几乎所有(怕自己读书太少不敢说全部)的医学微生物学教科书都是一种解释:SLO对O2敏感,遇到O2时,SH基被氧化为-S-S-基(二硫键),失去溶血活性。若加入还原剂,二硫键还原,溶血作用可以逆转(不引用文献了,读者随便找一本大学医学微生物学教科书,翻到“A群链球菌”一节,准能看到相同内容)。记得有一本著作有一张图还画出了SLO二硫键的位置(恕不引文献),我模拟画了一张类似图(见图4)。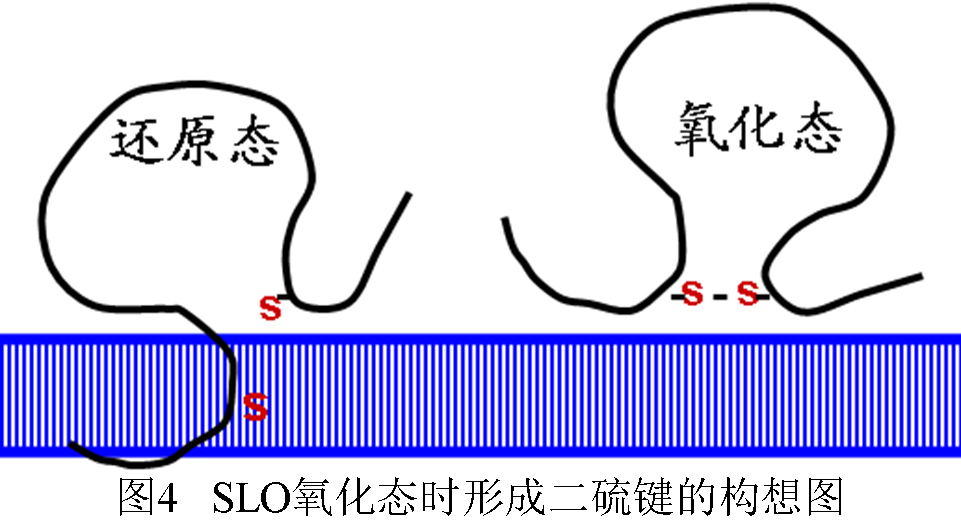

要说这种解释也有道理。例如,Hotze等人用氨基酸定位替换技术,将PFO的D2区的Gly57替换为Cys(G57C)、D3的TMH1区的Ser190替换为Cys(S190C),获得了替换突变型PFOC57-C190(图5)。这种带二硫键的突变型PFOC57-C190可以与膜胆固醇结合并在膜表面形成聚合物前体(prepore),但不能插入膜内造成溶血。在加入还原剂还原二硫键后,前体聚合物即插入膜内成孔(pore)[9]。Palmer等人也构建了一个T250C突变型SLO,含两个半胱氨酸(Cys250和Cys530),这一突变SLO也没有溶血性[10]。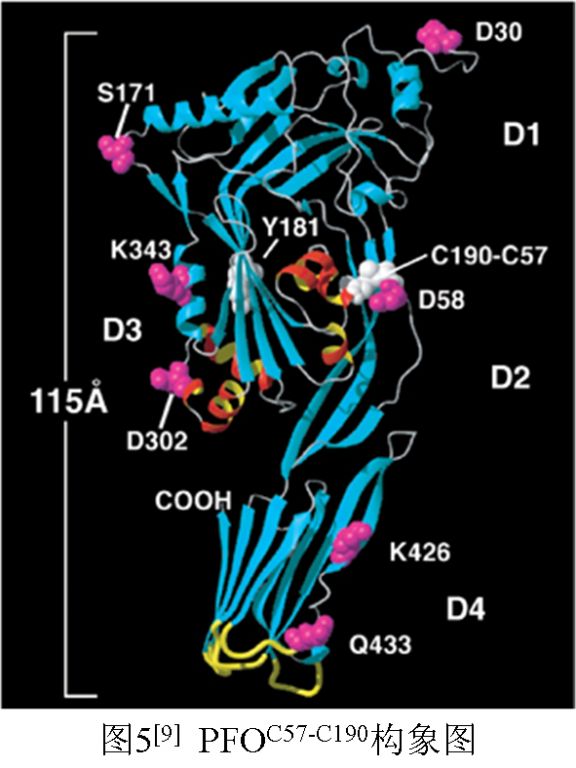

这些研究证实了CDCs若存在二硫键,确实没有溶血活性。但遗憾的是,这些作者研究的却是人工诱变的突变型CDCs,而不是天然野生型CDCs。
早在1987年,Walker等人就完成了肺炎球菌溶素O(PLY)的测序,结果发现PLY肽链长471aa,一级序列中只有1个Cys428[11]。紧接着Kehoe等人也完成了链球菌溶素O(SLO)的测序,结果发现SLO肽链长571aa,一级序列中也只有1个Cys530,没有2个(见图1右)!估计作者们对只有1个Cys也有点吃惊,特意用黑框将Cys醒目框住[12]。现如今,已发现的CDCs家族的所有毒素几乎都已经测序,绝大多数毒素肽链只有1个Cys(表1-A组),而PLO、ILY和VLY三种毒素甚至1个Cys也没有(表1-C/D组),唯独只有ILO有2个Cys(C483/C509;表1-B)。CDCs的肽链最多只有1个“Cys-SH”(巯基),不可能形成肽链内二硫键。
此后不久,Pinkney等人用定位突变技术,将SLO-Cys530密码子TGC,分别置换成GCC(Ala)得到突变型SLOA530、以及置换成TCG(Ser)得到突变型SLOS530。通过溶细胞实验发现,两种突变型溶素的溶细胞活性与野生型溶素没有显著性差异,而且组装的跨膜聚合体都相同,溶细胞活性都能被游离胆固醇分子所抑制。以至于作者们在标题上就断然说“SLO的溶细胞活性不需要巯基”[13]。
国外有些学者对待学术就是严谨,为了让疑惑者彻底无话可说, Polekhina等人用扫描替代突变法,用Ala分别替换PFO-11肽的10个氨基酸(除序列内原来的Ala),获得10种突变型PFO。将这10种突变型PFO分别与野生型PFO比较细胞结合活性和溶细胞毒性,发现PFOE458A和PFOC459A突变型与野生型相比,细胞结合活性和溶细胞毒性均无明显影响,这说明没有Cys的PFO其活性不受影响;其余突变型PFO与野生型相比,细胞结合活性和溶细胞毒性均大受影响,几乎完全没有溶细胞毒性(图6左)。他们还用同样的方法获得了11种突变型ILY(如原序列是Ala就换成Gly,如原序列是Gly就换成Ala,图6右),结果发现保守11肽任何位置氨基酸残基的改变,对毒素的细胞结合活性均无显著影响;但两个色氨酸(W)的突变型ILYW491A和ILYW494A,它们的溶细胞毒性几乎完全灭活。这一研究表明,保守11肽的Cys是否存在,对CDCs的细胞结合活性和溶细胞毒性无任何影响,倒是11肽C端氨基酸残基(尤其是色氨酸)的改变对毒素活性影响甚大[6]。此外,Gelber等人制备了VLY的11肽替换突变型VLYP480W,这种突变VLY也没有溶细胞毒性[14]。这很有意思,VLYP480W突变型11肽的脯氨酸(P)换成色氨酸(W)后,其11肽序列C端的5个氨基酸残基就与SLO等一样了(表1-A),但怎么反而丧失了溶细胞活性呢? 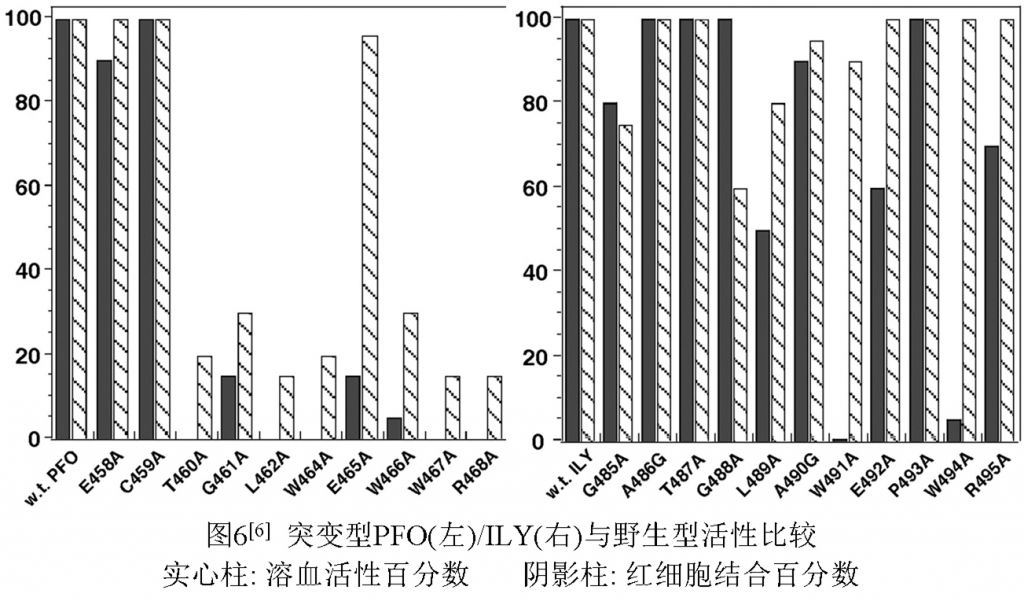

Watanabe
等人研究了李斯特菌溶素(LLO)等几种CDCs对小鼠的致死毒性。野生型LLO对小鼠显示强致死效应,而ILO的致死毒性稍微弱于LLO,SLO和PLY则明显弱于LLO。而只含有D1-3结构域(1-415aa)的LLO没有致死效应和溶细胞毒性,这证实了D4是发挥毒素活性必需的结构域。作者用定向突变技术制备了4种突变型LLO:替换11肽Cys的突变性LLOC484S,显示溶细胞毒性轻微减弱,小鼠致死效应未受影响;但是11肽的3个色氨酸突变型LLO,其中LLOW489A和LLOW491A没有显示任何致死效应和溶细胞毒性,而LLOW492A的溶细胞毒性严重衰减,但仍保留一定的致死效应(注射10只小鼠,死了6只)[15]。这一研究表明,在D4区保守的富含Trp的11肽中,Cys对毒素活性几乎无影响,而3个Trp则对毒素活性起着关键性的作用。
生脓隐秘杆菌(Arcanobacterium
pyogenes)溶素(pyolysin,PLO;534aa)的11肽也没有Cys(表1-C),但它与ILY及VLY不同,是以胆固醇为膜受体。它与ILY还有一个特殊之处,对O2不敏感(即抗氧化作用)。更有意思的是,Billington等人将PLO的11肽第2位丙氨酸(Ala492)替换成Cys,突变型PLOA492C的11肽(EC492TGLAWDPWR)与其它带Cys的野生型CDCs基本相同,但突变型PLOA492C与野生型PLO均对O2不敏感。有Cys也对O2不敏感,这完全颠覆了现有教科书有关“Cys对O2敏感”的认识[16]。
绵羊李斯特杆菌溶素(Ivanolysin,ILO;528aa)是CDCs家族中唯一的例外,其肽链一级序列中有2个Cys(Cys483/Cys509;表1-B)。由于尚未见到有关文献,ILO是否存在肽链内二硫键留待日后再探讨。
结语 CDCs肽链中最多只有1个Cys,所以不可能形成链内二硫键。保守11肽第2位是Cys的CDCs将此Cys替换成其它氨基酸、或原来在11肽第2位没有Cys的CDCs在此位换上1个Cys,其细胞结合活性和溶细胞毒性与野生型CDCs无异。证实原来关于“氧化态SLO形成二硫键而失去溶细胞毒性”的解释是错的!笔者在10年前就曾指出SLO等“巯基活化毒素的溶血性与巯基的氧化或还原无关”[17],并且有一段阐述文字与图,但由于某种有中国特色的原因被人模糊处理了。不过我仍时时期待着有哪位作者能将“医学微生物学”教材中的这个陈年错误改正过来,惜至今(至少在主流教材中)不曾见到。国内的“医学微生物学”与“医学免疫学”教材大多互相抄袭的现状何时能有改观?中国的医学生幸甚!
参考文献
[1] Rodney K. Tweten: Infect
Immun. 2005,73(10):6199–6209;
[2] Michael A. Meehl and
Michael G. Caparon: Molecular Microbiology,(2004),52(6):1665–1676;
[3] Jamie
Rossjohn,et. al.: Cell,1997,Vol.89(5):685–692;
[4] Allison J.
Farrand, et. al.: PNAS,
2010,Vol.107(9):4341–4346 ;
[5] Mélanie Anne
Hamon: Trends in Microbiology, 2012,Vol.20(8):360–368;
[6] Galina
Polekhina, et. al.: PNAS, 2005,Vol.102(3):600–605;
[7] Timothy R. Hughes, et. al.: Mol
Immunol.,2009,Vol.46(7):1561–1567;
[8] Alejandro P. Heuck,et. al.: JBC,2003,Vol.278:31218–31225;
[9] Eileen M. Hotze,et. al.: JBC,2001,Vol.276:8261–8268;
[10] Michael Palmer, et.
al.: The EMBO Journal,1998,Vol.17(6):1598–1605;
[11] John A. Walker, et. al.: Infection and
Immunity,1987, Vol.55(5):1184–1189;
[12] Michael A. Kehoe, et.
al.: Infection And Immunity,1987,Vol.55(12):3228–3232;
[13] Michael Pinkney, et. al.: Infection and Immunity,1989,Vol.57(8):2553–2558;
[14] Shari E.
Gelber, et. al.: J. Bacteriol.,2008,Vol.190(11):3896–3903;
[15] Isao Watanabe,
et. al.: J. Med.
Microbiol.,2006,Vol.55(5):505–510;
[16] Stephen J. Billington,
et. al.: J. Bacteriology, 1997, Vol.179(19):6100–6106;
[17] 龙北国、江丽芳主编《高级医学微生物学》,人民卫生出版社,2003年第1版,第41页。
https://m.sciencenet.cn/blog-809009-632955.html
上一篇:淋巴细胞“阴性选择”或另有玄机
下一篇:口罩,国民抵抗呼吸道传染病的无奈选择
扫一扫,分享此博文