博文
三型分泌系统ATPase—驱动致病细菌三型分泌系统毒力因子分泌马达
||||
三型分泌系统ATPase—驱动致病细菌三型分泌系统毒力因子分泌的马达
作者:高小攀
细菌性痢疾是威胁全球的重要疾病,在我国尤为严重,特别是近些年来新的血清型和耐药菌株的出现,为志贺氏菌的防治带来了挑战。志贺氏菌三型分泌系统在细菌性痢疾发病过程中扮演着重要角色,对三型分泌系统的致病机制研究一直是国际国内研究的热点。志贺氏菌三型分泌系统重要的调控蛋白、结构蛋白、效应蛋白、伴侣蛋白的结构解析为探究其致病机制奠定了坚实基础。在上期的博文“志贺氏菌毒力基因调控机制—从染色体、质粒分配到转录调控”
(http://blog.sciencenet.cn/home.php?mod=space&uid=2484430&do=blog&id=915739)中,我们报道了志贺氏菌三型分泌系统调控蛋白VirB识别毒力基因的结构生物学基础,初步阐明了毒力基因的转录激活机制,为我国在志贺氏菌三型分泌系统致病机制的研究迈出了坚实一步。但三型分泌系统的致病机制研究仍有许多科学问题亟待解决。本期博客旨在前期调研和研究的基础上,继续围绕志贺氏菌三型分泌系统重要蛋白进行系统的报道。特别是确定志贺氏菌三型分泌系统高度保守的ATPase的研究进展。
在现代社会中,细菌性痢疾仍然是全球公共卫生安全面临的重大威胁之一。在发展中国家,细菌性痢疾的危害尤为严重。志贺氏菌属于革兰氏阴性杆菌,是导致细菌性痢疾的首要病原体。细菌性痢疾每年造成数十万人死亡,尤其对儿童的威胁最大[1]。福氏志贺氏菌是引起细菌性痢疾的主要病原体之一。在过去十几年中,我国流行的福氏志贺氏菌优势株为福氏2a 301株。然而,最近我国科学家研究表明,新发现的福氏Xv志贺氏菌已经成为我国流行的优势菌株[2][3]。在以往的研究工作中,我们于2001年完成了福氏志贺氏菌2a 301株的全基因组序列测定,是我国首个独立完成的微生物基因组项目,为志贺氏菌的致病机理研究提供了完整的遗传背景信息[4]。
志贺氏菌的基因组序列与大肠杆菌高度同源,其致病性主要基于细菌中约230Kb的侵袭性大质粒。志贺氏菌的毒力基因集中分布在侵袭性大质粒中约31Kb的“entry region”中。这些毒力基因编码了三型分泌系统(T3SS)的效应蛋白、结构蛋白、调控蛋白及伴侣蛋白等大量蛋白质。志贺氏菌感染引发的细胞内病理变化和细菌性痢疾的临床表现正是由于T3SS大量的细菌毒力蛋白综合作用结果[5] [6]。T3SS通常由大约20到25种不同的蛋白组装成位于细胞被膜结构的巨大针状复合物。志贺氏菌效应蛋白通过针状复合物穿越细菌内膜、肽聚糖层和细菌外膜,最终进入到宿主细胞内发挥致病作用。在此过程中T3SS高度保守的ATPase对于细菌效应蛋白的分泌至关重要。这类ATP酶通过组装成同源六聚体,参与效应蛋白的识别,并利用ATP水解的能量将效应蛋白运输至针对复合物的中央管道,实现向胞外的蛋白质分泌。ATPase不仅结合伴侣蛋白还结合伴侣-效应蛋白复合物[7.8],更重要的是,ATPase加入到伴侣-效应蛋白复合物中造成复合物的解离和效应蛋白的去折叠[8],这种去折叠活性可以为分泌过程提供能量。目前比较认可的三型分泌系统ATPase的工作模型为:首先,ATPase是重要的分泌机器之一,具有水解ATP的能力;其次,ATPase通过识别伴侣-效应蛋白复合物并解离伴侣蛋白,从而使效应蛋白去折叠,效应蛋白通过孔道。ATP的水解驱动了这一过程;随后,质子泵(PMF)进一步推进了蛋白的输出[9]。(图1)
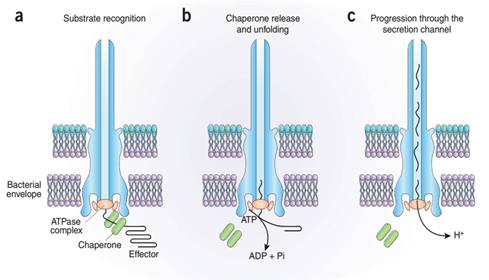
图1 三型分泌系统ATPase的工作机制
志贺氏菌三型分泌系统毒力基因Spa47主要编码大小为43Kd的ATPase,这类ATPase在三型分泌系统中高度保守,其中包括了沙门氏菌ATPase Invc、肠出血性大肠杆菌EscN、耶尔森氏菌YscN、绿脓杆菌HrcN以及鞭毛蛋白ATPaseFliI等。其主要结构域可分为N端寡聚化结构域(参与膜结合)、中央的ATPase结构域和C端与伴侣-效应蛋白结合结构域(图2)。中央的ATPase结构域包含了经典的Walker A和Walker B结构域,参与了ATP的结合和催化。氨基酸序列比对分析发现,T3SS的ATP酶与F1-F0 ATP合成酶及细菌鞭毛复合物的ATP酶FliI具有较高的同源性。因此,人们对T3SS的ATP酶的机制的了解基本建立在与同源结构比对的基础上,其催化机制和六聚体催化模型也基本建立在F1-F0 ATP合成酶的结构基础上。2007年,Zarivach[10]等人报道了T3SS 编码的ATP酶的唯一高分辨率结构- EscN-ADP复合物晶体结构。然而,EscN并未形成六聚体构象,与人们推测的六聚体催化模型不符。基于目前的研究结果,我们认为以下科学问题亟待解决:
第一:目前对于三型分泌系统ATPase的研究无论是最初的功能还是晶体结构的解析,对其工作机制的理解都基于单体结构。然而,三型分泌系统ATPase的天然状态是六聚体,目前除了低分辨率的电镜模型外,至今无高分辨率晶体和高分辨率电镜的结构报道,对其工作的机制的了解也是基于猜测。所以伴随着冷冻电镜技术的发展,解析三型分泌系统ATPase的高分辨率电镜结构将为理解此类ATPase的工作机制打开广阔的大门。
第二:生化研究证明,三型分泌系统ATPase通过解离伴侣-效应蛋白复合物来发挥功能。然而偶联这一机制的结构信息缺乏,比如,ATPase是否通过ATP水解产能驱动了伴侣-效应蛋白复合物的解离。ATPase与伴侣-效应蛋白复合物互做的结构基础是什么?
第三:在最新的JB文章中,美国耶鲁大学著名的微生物学家Jorge E. Galán(乔治·格兰)注:[11]发表了题为“Structural Features Reminiscent ofATP-Driven Protein Translocases Are Essential for the Function of a Type IIISecretion-Associated ATPase”报道了三型分泌系统ATPase的几个关键区域(luminal loop,two helix finger)参与了效应蛋白的输出。(图3)并通过结构模拟和生化,细菌学实验证明了关键区域对效应蛋白的输出作用。然而,尽管如此,我们仍旧无法理解此类ATPase如何利用ATP的水解参与了效应蛋白的运输的分子机制。
第四:ATPase作为一个动力蛋白,其核心问题是此类酶水解ATP产能,从而发挥功能,因此对其ATP水解产能的化学能如何转换为工作的机械能将为深入了解三型分泌系统ATPase的工作机制画上完美的句号。

图2 三型分泌系统ATPase的重要结构域(不同的结构域以不同的颜色标注。中央的ATPase结构域有分为4个不同的结构域以不同的颜色标注)
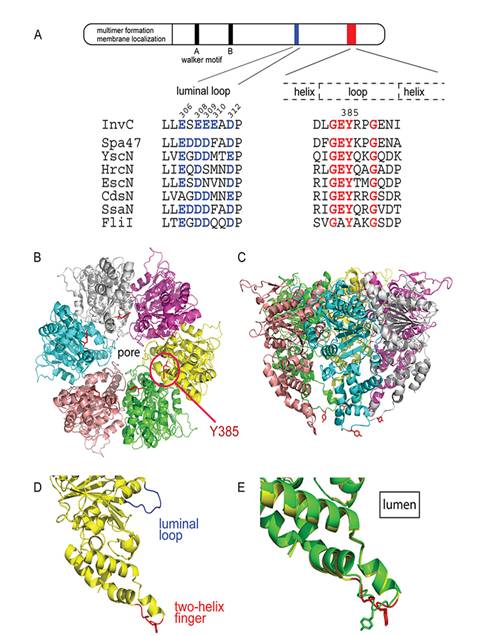
图3 三型分泌系统ATPase六聚体模型和参与效应蛋白输出的重要结构域
参考文献:1. Bardhan, P., Faruque, A.,Naheed, A. & Sack, D. Decrease in shigellosis-related deaths without Shigella spp.-specific interventions,Asia. Emerging Infect. Dis. 16,1718-1723 (2010).
2. Ye, C. et al. Emergence of a new multidrug-resistant serotype X variantin an epidemic clone of Shigella flexneri.Journal of Clinical Microbiology 48,419-426 (2010).
3. Zhang, N. et al. A genomic portrait of evolution and epidemic spread of arecently emerged multidrug resistant Shigellaflexneri clone in China.Journal ofClinical Microbiology, doi:10.1128/jcm.02669-13 (2014).
4. Jin, Q. et al. Genome sequence ofShigella flexneri 2a: Insights into pathogenicity through comparison withgenomes of Escherichia coli K12 andO157. Nucleic Acids Research 30,4432-4441 (2002).
5.姜铮,王芳,何湘,黄留玉,袁静.志贺氏菌致病机制研究进展. 中国热带医学 9, 1372-1383 ( 2009).
6.朱立, 王恒樑. 志贺氏菌三型分泌系统及其致病机理. 微生物学报 50, 1446-1451 (2010).
7. Rüssmann H, etal.(1998) Delivery of epitopes by the Salmonella type III secretion systemfor vaccine development. Science281(5376):565-568.
8. GalánJE & Wolf-Watz H (2006) Protein delivery into eukaryotic cells by type IIIsecretion machines. Nature444(7119):567-573.
9. GalánJE (2008) Energizing type III secretion machines: What is the fuel? Nature Structural and Molecular Biology15(2):127-128
10. ZarivachR, Vuckovic M, Deng W, Finlay BB, & Strynadka NCJ (2007) Structuralanalysis of a prototypical ATPase from the type III secretion system. Nature Structural and Molecular Biology14(2):131-137.
11. UnyaKato, Matthew Lefebre, Jorge E. Galán (2015) Structural Features Reminiscent ofATP-Driven Protein Translocases Are Essential for the Function of a Type IIISecretion-Associated ATPase. journal of bacteriology 14(2):131-137.
注:关于Jorge E. Galán(乔治·格兰)教授的简介见
https://tools.medicine.yale.edu/galan/www/Pages/galan_about_main.html
科学网报道Jorge E. Galán(乔治·格兰)教授:
http://news.sciencenet.cn/htmlnews/2011/2/244167.shtm
此外,科学网博友许培扬对Jorge E. Galán(乔治·格兰)教授也有简介。
http://blog.sciencenet.cn/blog-280034-415445.html
Jorge E. Galán(乔治·格兰)教授:
https://m.sciencenet.cn/blog-2484430-934105.html
上一篇:参加第十一届全国病毒学学术研讨会
下一篇:关注新抗生素Teixobactin和cyclohexylgriselimycin的抗结核作用