博文
经过20多年的研究,科学家已解决了Janus激酶的全长结构
||
经过20多年的研究,科学家已解决了Janus激酶的全长结构
诸平
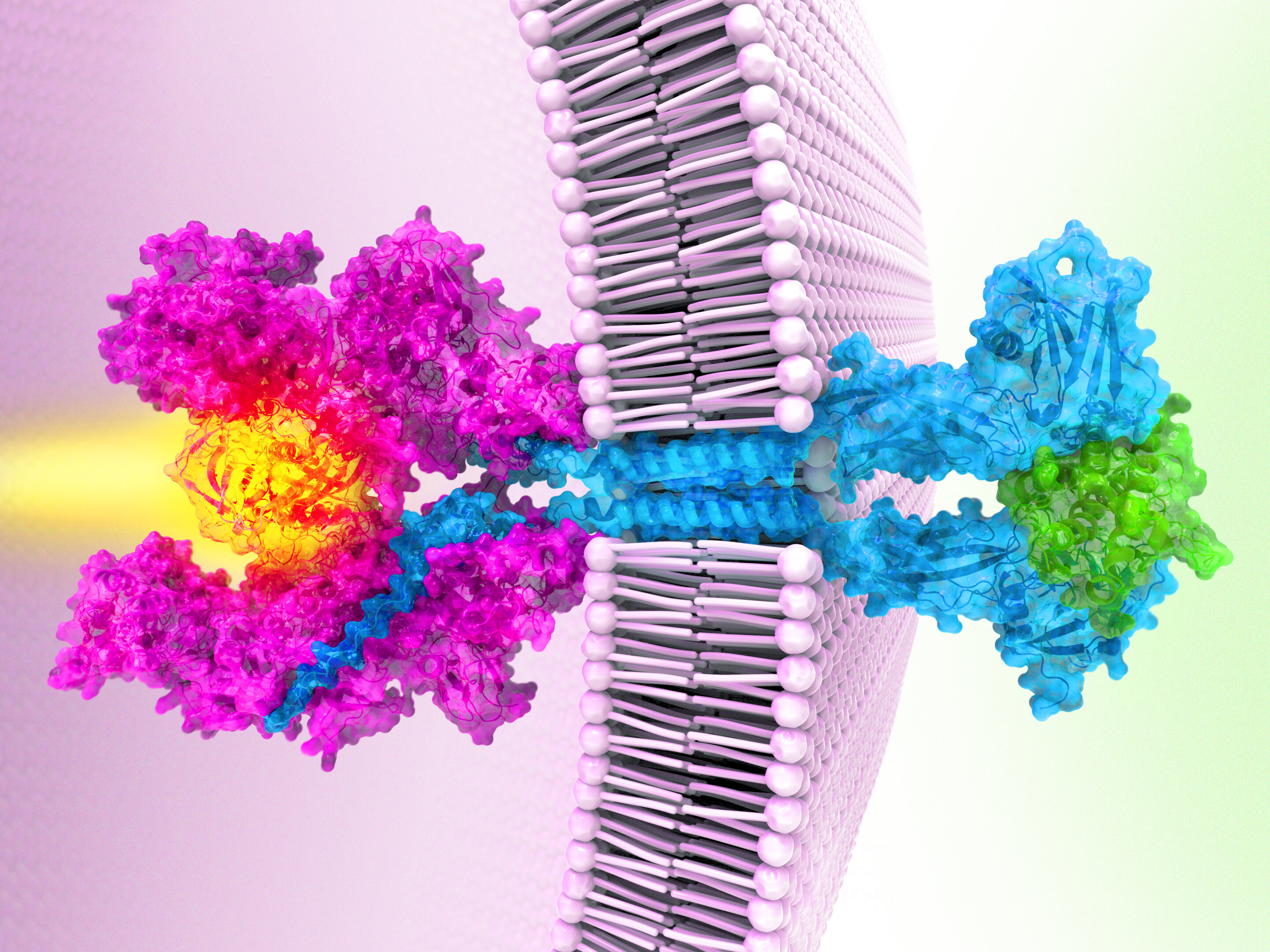
Fig 1 When a cytokine (green) binds to receptors (teal), two parts of the Janus kinase protein (pink) come together, activating it to send signals inside a cell. In some cancers, mutations in the kinase lock it together, keeping it abnormally active. Credit: Eric Smith/Chris Garcia/Howard Hughes Medical Institute
Fig. 2 K. Christopher Garcia, PhD
Investigator / 2005—Present
Dr. Garcia is a professor of molecular and cellular physiology and of structural biology at Stanford University School of Medicine.
据美国霍华德·休斯医学研究所(Howard Hughes Medical Institute简称HHMI)2022年3月10日报道,经过20多年的研究,科学家们已经解决了两面神激酶(Janus kinase)的全长结构(After more than 20 years, scientists have solved the full-length structure of a Janus kinase)。这一突破出现在分子生物学家克里斯托弗·加西亚(K. Christopher Garcia, Fig.2)的生日之时,可以认为是最好的生日献礼。
上图1由HHMI提供的照片,当细胞因子(绿色)与受体(蓝绿色)结合时,两面神激酶蛋白(粉红色)的两部分结合在一起,激活它向细胞内发送信号。在一些癌症中,两面神激酶的突变将其锁在一起,使其异常活跃。
20多年来,克里斯托弗·加西亚的团队(The Garcia Lab)和世界各地的其他人一直在追踪一个难以捉摸的领域——细胞中一种重要信号蛋白的3D结构。2021年底,他的电子显微镜下的分子图像开始清晰起来。12月8日,博士后Naotaka Tsutsumi和研究生迦勒·格拉斯曼(Caleb Glassman)给他发了一封电子邮件,邮件中清晰地显示了蛋白质与一个关键受体的联系。斯坦福大学霍华德·休斯医学研究所的研究员克里斯托弗·加西亚回忆说:“我当时在参加一个会议,然后我意识到我们已经得到了想要的结果。我立刻离开会场,跑回到实验室。”
迦勒·格拉斯曼当时刚搬到波士顿去哈佛大学读博士后(Harvard postdoc),他取消了原计划的野外旅行,匆忙赶回斯坦福大学。“我想完成Naotaka Tsutsumi和我已经开始的事情,”他解释道。然后,这三名研究人员夜以继日地工作,以确定这种蛋白质即两面神激酶(Janus kinase)的完整结构,并在竞争对手实验室之前发现了这一蛋白质。克里斯托弗·加西亚说:“这是世界上许多团体之间的一场大型比赛,我们正在向终点冲刺。”12月26日,他们匆忙向《科学》(Science)杂志提交了一份手稿,该杂志于2022年3月10日发表了这项研究——Caleb R. Glassman, Naotaka Tsutsumi, Robert A. Saxton, Patrick J. Lupardus, Kevin M. Jude, K. Christopher Garcia. Structure of a Janus Kinase cytokine receptor complex reveals the basis for dimeric activation. Science, 10 Mar 2022. DOI: 10.1126/science.abn8933. http://www.science.org/doi/10.1126/science.abn8933
克里斯托弗·加西亚的团队不仅捕捉到了一个极其重要的信号分子的完整结构,还捕捉到了这些激酶如何工作的机制,这曾是“生物学中的一个基本问题”。美国国立卫生研究院的免疫学家约翰·奥谢(John O'Shea)说。约翰·奥谢帮助开发了首批阻断两面神激酶功能的药物之一,他没有参与这项新研究。由于这些蛋白质可能在疾病中出错,研究结果可能会导致针对某些癌症的新药和更好的药物问世。“这是一项了不起的工作,”约翰·奥谢说。
小打小闹(Chipping away)
两面神激酶接收来自细胞外的信号,并将信息传递给细胞内的分子。多年来,科学家们已经知道,两面神激酶故障会导致疾病。一些损害两面神激酶的突变会严重削弱身体抵抗感染的能力,导致一种几乎与“泡泡男孩病(bubble boy disease)”相同的情况。当基因故障和夸大的信号过多地加速激酶时,结果可能是白血病(leukemia)等血癌,以及过敏性或自身免疫性疾病(allergic or autoimmune diseases)。
研究人员知道这些蛋白质部分的形状,包括相关的酶和分子末端的调节区域,因此它们被称为两面神激酶(Janus kinases),以罗马神话中的双面神命名。复杂的药物筛选已经发现了抑制这些蛋白质的分子,这给医生提供了一种治疗一些癌症和疾病(如风湿性关节炎)的方法。但科学家们在开发这些药物时,并不知道分子的完整结构,也不知道它们是如何被激活的。因此,目前十几种药物中的大多数,加上更多正在进行临床试验的药物,都是相对生硬的工具,能够阻断健康的和突变的两面神激酶。它们仍然可以治疗从湿疹到COVID-19的许多疾病,但也可能导致一系列副作用。
克里斯托弗·加西亚想要一个更详细的蛋白质视图,但是,当他在1995年作为博士后第一次尝试成像分子时,他发现这是一个令人畏缩的挑战。众所周知,在实验室中很难制造出这些激酶。而且它们不容易形成晶体,科学家需要使用X射线晶体学捕捉3D结构。因此,多年来,克里斯托弗·加西亚和其他人一次只能看到激酶的一些片段。他说:“我们一直在努力,却没有取得什么成果。”
在过去的几年里,事情开始有了头绪。一项关键的进步是一种被称为低温电子显微镜(cryo-EM)的方法,科学家将样本冷冻,然后用电子显微镜观察它们。另一个是克里斯托弗·加西亚的团队选择研究老鼠的两面神激酶而不是不稳定的人类的两面神激酶。他们还在小鼠激酶中引入了一种常见的致癌突变,从而进一步稳定了此分子。
点燃火(Lighting a fire)
克里斯托弗·加西亚团队的工作揭示了一种叫做JAK1的两面神激酶的结构,并概述了它在细胞内发送信号的步骤。
首先,受体蛋白附着在细胞膜上,从细胞的内外表面伸出来,就像牙签穿过三明治一样。然后,细胞内的一种两面神激酶附着在受体上,等待信号。接下来,叫做细胞因子(cytokines)的分子靠近细胞的外部,每一种分子与两个受体结合。细胞因子就像一座桥梁,把两个受体拉得更近,克里斯托弗·加西亚解释说。这将两面神激酶的活性端连接在一起,打开它们。就像火柴点火一样,两面神激酶传递一个信号,告诉基因打开或关闭。
这个结构也揭示了致癌突变是如何通过将两面神激酶的两个部分粘合在一起来缩短这一信息传递链的。这使得这两个活跃区域即使在没有外部细胞因子的情况下也保持开启状态,从而引发不受控制的活动,引发癌症。
克里斯托弗·加西亚希望新的结果可以帮助科学家设计出更好的药物,只针对有缺陷的两面神激酶,让健康的两面神激酶继续发挥它们的正常功能。他说,这项工作是“科学中理想情况的一个例子,即解决一个基本问题也与疾病直接相关。”
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
科学家提出了一种调节细胞通讯网络的新策略(Scientists propose a new strategy to regulate the cell communication network)
Cytokines signal through cell surface receptor dimers to initiate activation of intracellular Janus Kinases (JAKs). We report the 3.6-Å resolution cryo-EM structure of full-length JAK1 complexed with a cytokine receptor intracellular Box1/Box2 domain, captured as an activated homodimer bearing the Val→Phe (VF) mutation prevalent in myeloproliferative neoplasms. The seven domains of JAK1 form an extended structural unit whose dimerization is mediated by close-packed pseudokinase (PK) domains. The oncogenic VF mutation lies within the core of the JAK1 PK dimer interface, enhancing packing complementarity to facilitate ligand-independent activation. The C-terminal tyrosine kinase domains are poised to phosphorylate the receptor STAT-recruiting motifs projecting from the overhanging FERM-SH2 domains. Mapping of constitutively active JAK mutants supports a two-step allosteric activation mechanism and reveals new opportunities for selective therapeutic targeting of oncogenic JAK signaling.
https://m.sciencenet.cn/blog-212210-1329133.html
上一篇:数学上的发现可以揭示量子引力
下一篇:地球构造板块运动背后的基本过程的新模型