博文
蛋白质中的糖代码:为生物制药的发展铺平道路
||
蛋白质中的糖代码:为生物制药的发展铺平道路
诸平
据日本名古屋市立大学(Nagoya City University)2022年7月13日提供的消息,蛋白质中的糖代码:为生物制药的发展铺平道路(Sugar Code in Protein: Paving the Way for Development of Biopharmaceuticals)。
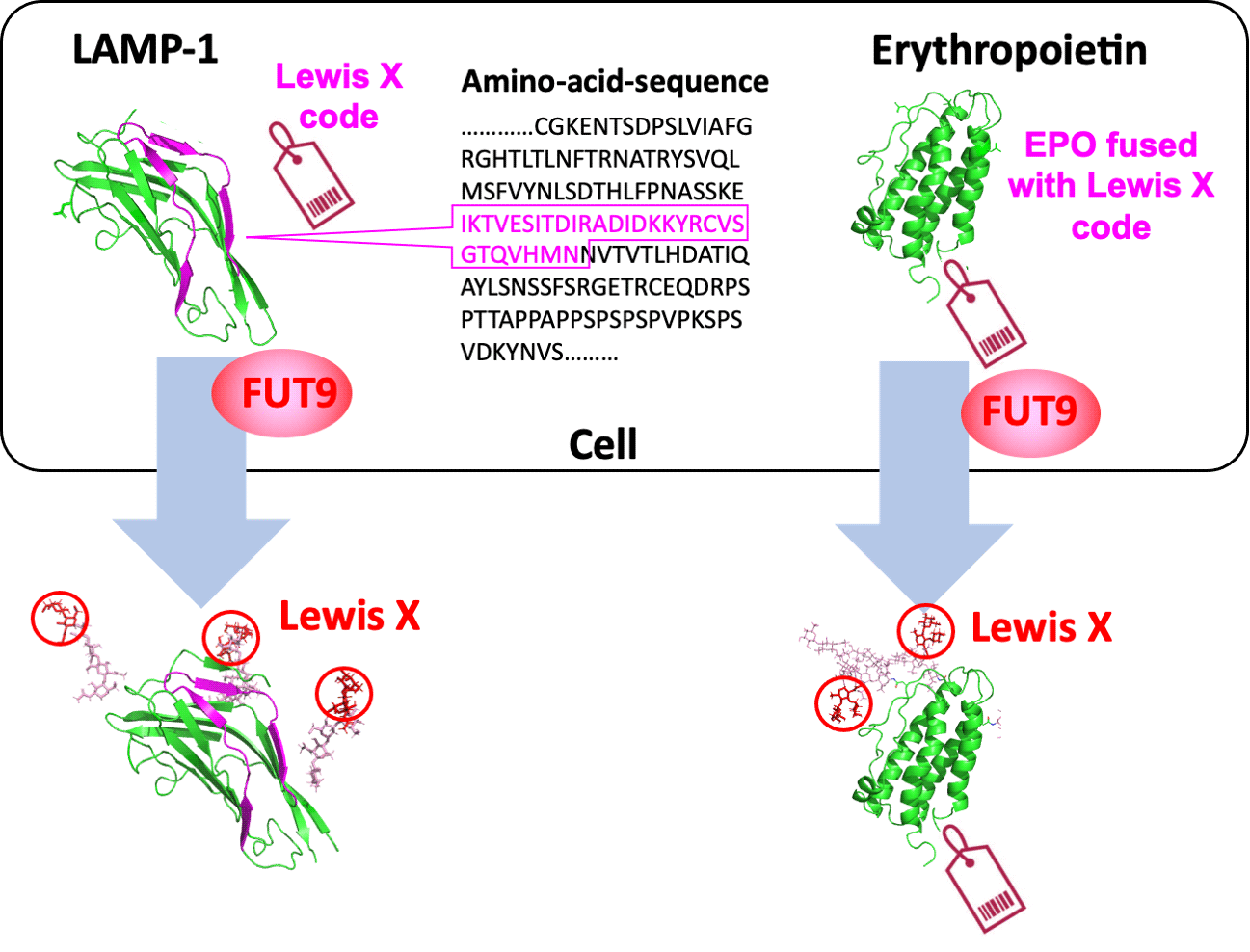
上述图示是由名古屋市立大学药学研究生学院(Nagoya City University Graduate School of Pharmaceutical Sciences)提供的,来自LAMP-1的特定29个氨基酸序列作为“刘易斯X密码(Lewis X code)”,由 FUT9 破译,它可以嵌入红细胞生成素(erythropoietin)中以引发刘易斯X修饰。相关研究结果于2022年7月13日已经在《通讯生物学》(Communications Biology) 杂志网站发表——Taiki Saito, Hirokazu Yagi, Chu-Wei Kuo, Kay-Hooi Khoo, Koichi Kato. An embeddable molecular code for Lewis X modification through interaction with fucosyltransferase 9. Communications Biology, 2022, 5, Article number: 676. Published: 13 July 2022. DOI: 10.1038/s42003-022-03616-1. https://www.nature.com/articles/s42003-022-03616-1
嵌入在蛋白质中调节其糖基化(glycosylation)的分子代码的鉴定。
自然界中的许多蛋白质以糖蛋白(glycoproteins)的形式存在,糖蛋白是由蛋白质(多肽链:polypeptide chain)和聚糖(糖链:sugar chain)组成的分子。虽然蛋白质结构是根据其遗传蓝图确定的,但有关聚糖的信息并不直接由基因组编码。因此,控制蛋白质糖基化非常具有挑战性。在这种情况下,一个由名古屋市立大学、日本国立自然科学研究机构(National Institutes of Natural Sciences, Okazaki, Japan)和中国台湾"中央研究院"(Academia Sinica)的科学家组成的合作研究小组,在多肽中发现了一个特定的氨基酸序列,该多肽诱导了一种名为 Lewis X 的特定聚糖结构。
日本的这组科学家此前已经表明,Lewis X 通过岩藻糖基转移酶 9 (fucosyltransferase 9简称FUT9) 的酶促作用特异性地修饰了小鼠神经干细胞中的蛋白质LAMP-1。在最近的这项研究中,他们表明LAMP-1特异性的Lewis X修饰不仅发生在神经干细胞中,还发生在几种培养的哺乳动物细胞中。此外,他们还发现LAMP-1中由29个氨基酸残基组成的序列促进了酶催化的Lewis X修饰,并且当与用作生物药物的其他蛋白质融合时,该序列诱导Lewis X 修饰。这意味着,在糖蛋白分子中,特定的氨基酸序列可以确定它们的聚糖结构(glycan structures)。
大多数生物药物实际上是糖蛋白,治疗性抗体就是最好的例证。它们的聚糖结构对其功效和安全性至关重要。因此,糖基化的控制是生物制药发展中的一个重要问题。他们对蛋白质糖基化调控代码的发现有望为控制生物药物的糖基化铺平道路。
此项研究得到了日本科学技术厅(Japan Science and Technology Agency),科学研究补助金(Grants-in-Aid for Scientific Research:Grant Numbers JP20J23703; JP17H06414; JP21H02625; JP20K21495, JP24249002 and JP25102008)的资助; 日本技术振兴机构(JST-CREST, Grant Number JP MJCR21E3)、日本自然科学研究机构(National Institutes of Natural Sciences)的生命与生命系统探索性研究中心(Exploratory Research Center on Life and Living Systems简称ExCELLS))联合研究资助(ExCELLS program Nos. 21-302, 22EXC304, and 22EXC318);日本学术振兴会研究人员资助(JSPS Grant-in-Aid for JSPS Research Fellow);中国台湾"中央研究院"研究员奖(Academia Sinica Investigator Award grant AS-IA-105-L02)资助等。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
N-glycans are diversified by a panel of glycosyltransferases in the Golgi, which are supposed to modify various glycoproteins in promiscuous manners, resulting in unpredictable glycosylation profiles in general. In contrast, our previous study showed that fucosyltransferase 9 (FUT9) generates Lewis X glycotopes primarily on lysosome-associated membrane protein 1 (LAMP-1) in neural stem cells. Here, we demonstrate that a contiguous 29-amino acid sequence in the N-terminal domain of LAMP-1 is responsible for promotion of the FUT9-catalyzed Lewis X modification. Interestingly, Lewis X modification was induced on erythropoietin as a model glycoprotein both in vitro and in cells, just by attaching this sequence to its C-terminus. Based on these results, we conclude that the amino acid sequence from LAMP-1 functions as a “Lewis X code”, which is deciphered by FUT9, and can be embedded into other glycoproteins to evoke a Lewis X modification, opening up new possibilities for protein engineering and cell engineering.
https://m.sciencenet.cn/blog-212210-1347240.html
上一篇:一种常见的药物可“开启”致癌基因?
下一篇:几所文理学院2022年上半年产出成果比较