博文
科学遐想-神秘的缠绕(1-6)
||
一、神秘的缠绕-生命力的第一推动
DNA分子作为“线型”大分子之后会“自发”获得“螺旋力”。所谓“螺旋力”就是线型大分子因旋转而产生的“缠绕”。DNA分子的缠绕有别于一条绳索因外力产生的“缠绕”,做为DNA分子侧链的嘌呤碱和嘧啶碱会依据“Watson-Crick”法则进行配对,形成AT和 GC碱基对,这样的碱基对呈平面构象,可以发生在线型DNA分子内,但更多是在两条DNA分子之间。所有位于线型DNA分子上的碱基之间都能以AT和GC配对的DNA分子彼此称“互补”。而彼此互补的DNA分子常常由DNA复制而产生。这种“制造”互补分子的机制本身就已经非常神秘(因为没有人说得清楚自然发生会产生这种机制的过程)。接下来在互补DNA分子之间因官能团的空间排布所产生的“二级结构”(包括常见的A型、B型和因碱基特殊排列造成的Z型,其他因所处环境的湿度(含水量)离子种类和离子强度不同会衍生出其他类型的构象变体,当前最受人关注的是包括发夹、三链和四链等非B型DNA构象,这些非B型DNA构象可以出现在分子内,也可以出现在分子间。它们通常具有2方面的作用,一是调节基因的表达,一是影响基因组的稳定)。
处于B型构象状态的两条DNA分子链接下来的“缠绕” 行为会越发类似“绳索”。只要把分子上的任一段两点固定,只要引入“扭力”就会彼此缠绕,由于这种缠绕是在碱基配对这个第一动力的基础上产生的次级螺旋,所以分子生物学家常常称“超螺旋”为“螺旋的螺旋”。这种螺旋力并不局限于所谓的cccDNA (cccDNA 是一种共价闭环DNA分子,如原核细胞中的染色质分子和质粒分子,以及真核生物细胞线粒体和叶绿体内的DNA分子(基于内共生假说,这些线粒体和叶绿体内的DNA分子源自原核单细胞)和有人为了区别于两点固定后线型双链DNA出现的螺旋的螺旋,把后者称为pesudo-supercoiling)。
超螺旋的拓扑学
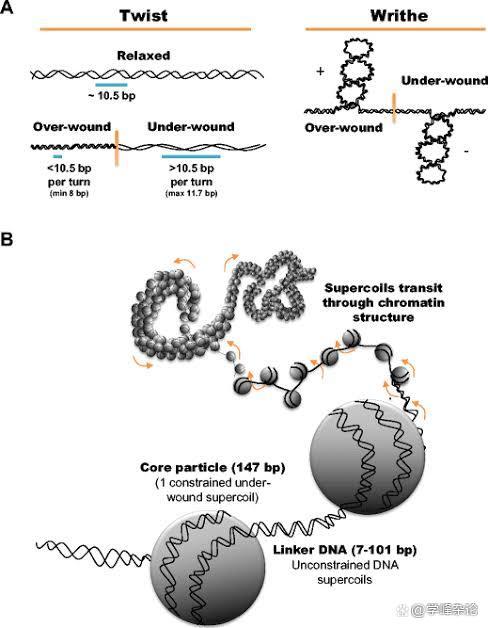
超螺旋包含了2个“旋转”层级,一层起因碱基间的Watson-Crick 配对“驱动”,这个层级的“旋转”操作被称为“Twist”, 而第二层级的旋转被称为“Writhe”。因此两条互补的DNA分子链因“旋转”产生的“缠绕”(Link Number)来自于“Twist ”和“Writhe”的加合。需要特别指出的是Twist 和Writhe 均为“矢量”(Vector Quantity),具有方向性,要么顺时针(Clockwise),要么逆时针(counter clockwise)。Lk=Tw+Wr
 Twist Writhe 和连接子数
Twist Writhe 和连接子数
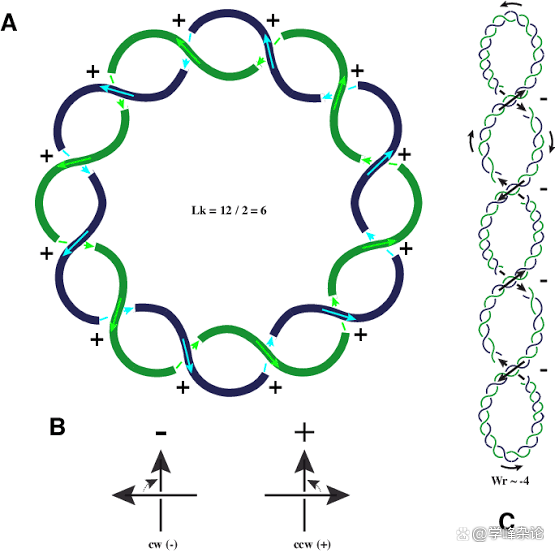 拓扑结构表征
拓扑结构表征
 超螺旋造成与蛋白质结合
超螺旋造成与蛋白质结合
 Writhes 造成的缠绕
Writhes 造成的缠绕
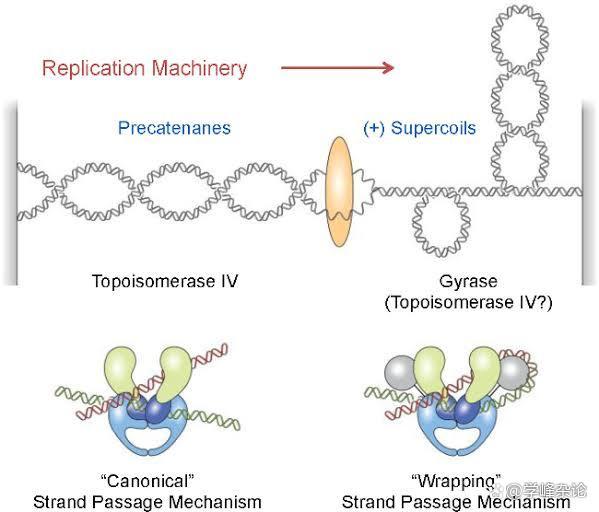 拓扑异构酶
拓扑异构酶
二、神秘的缠绕-生命创制
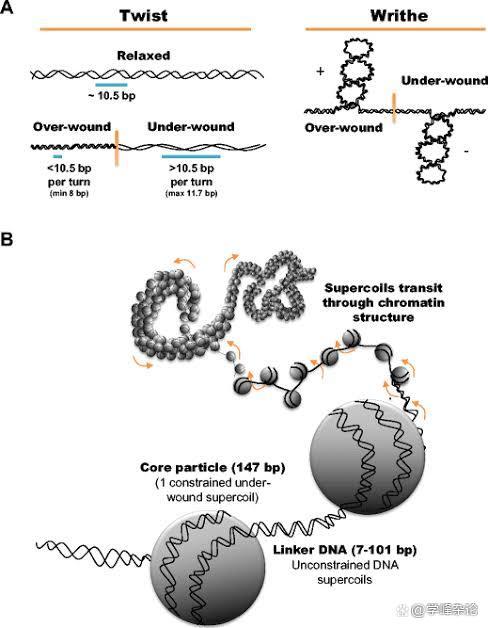
双螺旋状态下的DNA分子链一旦在两个点被固定住,那么它就会引入“螺旋的螺旋”,实际上就是在两条单链的基础上发生在双链上的缠绕。双链缠绕的动力从何而来?依据DNA拓扑学公式Lk=Tw+Wr, Tw(Twists, 两条DNA单链之间的缠绕)可以转化为Wr(Writhes, 双链DNA层面的缠绕), 当然,这种“转化”的前提条件必须是DNA链在两端固定。既不能被“切断”(如DNA拓扑异构酶负责),也不能被“捆绑” (SMC蛋白家族中的Cohesin 蛋白体负责),这就是最初的生命设计。
“缠绕的缠绕”用于贮存“能量”,这种能量用于DNA代谢(右手负超螺旋的所储存的能量要小于左手正超螺旋所储存的能量,因此左手正超螺旋缠绕只见于一下嗜热的古细菌)。矢量缠绕数包括了缠绕的方向和缠绕数,缠绕运动在2D平面有顺时针(Clockwise, 顺时针)和逆时针(counterclockwise/anticlockwise, CCW/ACW)(当拇指指向轴心,其余四指的方向,Normal left rotation = clockwise;Normal right rotation = counterclockwise)两种,最常见的基于两条单链DNA的“缠绕”是B型螺旋,呈现“右手”缠绕(逆时针,负螺旋)
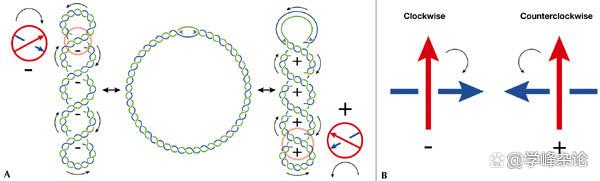 缠绕方向的表征,顺时针和逆时针
缠绕方向的表征,顺时针和逆时针
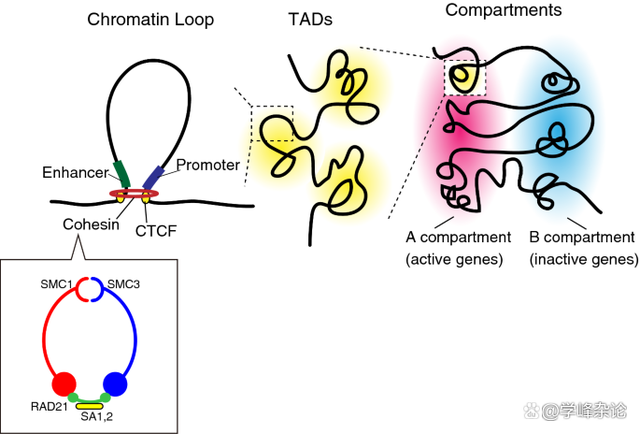
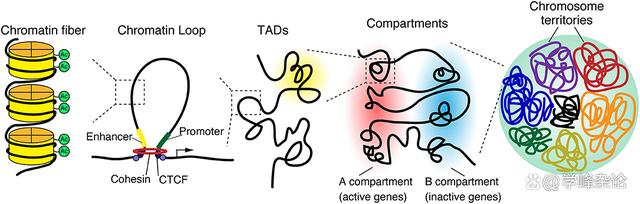
基于两条单链DNA通过碱基配对诱发的缠绕需要满足碱基能够妥善堆积的前提(右手缠绕,负超螺旋,Tw为负值)这种缠绕所贮存的能量是守恒的(可以转化为“功”work,通过“机械旋转”容许Tw和Wr之间“转换”)。对于近乎2米长的人基因组双链DNA分子而言,即使分做了23对(条),围绕上面的“生命创制”机制需要形成“拓扑学相关的域(Topologically Associated Domains, TAD)”, 这本质上是对线型DNA双螺旋的“分段管理”的结果。
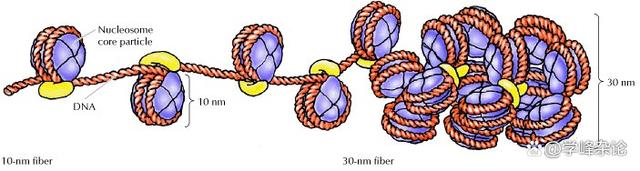
三、神秘的缠绕-核小体
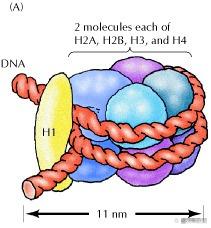
“核小体”(nucleosome , nucleo-,核;-some, 小体)是双链B型DNA(右手,负螺旋)与“核心”(被DNA缠绕住,位于中间)“组蛋白”(histone)形成的一种真核生物染色质的基本单位。需要与之区分的是“核小体+H1或H5组蛋白”小体,这样的“小体”被称为“染色体小体(chromatosome)”。
核小体“缓解/分担” Writhe (Wr)
双链DNA(右手缠绕)和一个各含有两个H2A、 H2B、H3和H4的组蛋白八聚体以左手缠绕1.65(1.75)圈,每个如此形成的核小体约分担一个负超螺旋。因此,失去一个核心组蛋白八聚体,双链DNA需要自身缠绕一次,相当于增加一个Wr。由于这种发生在DNA双链间的缠绕是依左手缠绕,故形成的局部缠绕结无法被轻易“打开”(应该可以被拓扑异构酶II/IV型切开再连接/DNA酶切割,如限制性内切酶?),这样的无核小体区域经染色后形态上看似“断裂”(常见于脆性染色体,Fragile chromosome region, 如脆性X染色体,马丁-贝尔综合征,21三体综合征之外最常见影响智力的一种综合征)。因此,这种状态的DNA无法被顺利复制和转录。
组蛋白密码
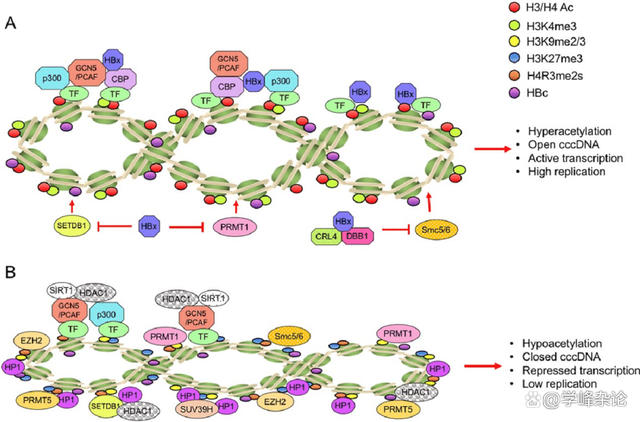
位于核小体中的八个组蛋白均有一个长短不一的“尾巴”,这些“尾巴”位于组蛋白的N端,故称N端结构域。这种“结构域”实际上是一种无序的肽链结构,富含碱性氨基酸残基,在中性环境中带有“正电荷”,可以与缠绕在组蛋白八聚体C端结构域的DNA的磷酸骨架上的负电荷结合,所以DNA缠绕在组蛋白八聚体上的“圈数”可以不是整数圈(整数圈会影响后续的组蛋白密码指令的执行,特别是“松开”的指令),也正因为如此组织给后续的“组蛋白密码”指令预留了可能。所谓“组蛋白密码”,是指通过对组蛋白N端结构域中赖氨酸、精氨酸等碱性氨基酸残基进行“翻译后修饰”,包括甲基化、乙酰基化(引入负电荷,弱化与磷酸骨架的正负电荷作用)等等...八聚体组织的组蛋白N端结构域的修饰指令被称为“组蛋白密码”,属于一类表观遗传“密码”(不同于碱基编码氨基酸的三联体密码),组蛋白密码体现“基因与环境互作”(G×E)。
核小体结构进一步形成30nm螺线管还是被cohesin 及CTCF蛋白锁定为TAD?
这要视细胞周期和染色体折叠周期,位于有丝分裂和减数分裂中期(位于细胞周期的M时相)的染色体是由位于细胞周期间期(G2时相)的位于TAD状态的染色质通过condensin I 和II进一步压缩而成,虽然目前似乎尚无人注意到这个问题,我个人觉得用condensin 的进一步压缩可能是回答上述疑问的答案。
 染色体小体
染色体小体
 染色体的压缩
染色体的压缩
 缠绕的缠绕
缠绕的缠绕
四、神秘的缠绕-缠绕力决定DNA死活
都知道DNA分子是“遗传信息载体”,但很多人不知道,作为遗传信息载体的DNA分子必须是那些拥有“缠绕”能力的双螺旋DNA分子(螺旋之上可以缠绕,螺旋的螺旋)。大家公认的一点是两条单链DNA形成双链缠绕的能量属于化学能,而在此基础上的进一步缠绕所储存的能量是“生命的活力”。因此,不具Wr的DNA分子不能在细胞内被容易地打开,因此影响其复制和转录。
问题是如何看“解旋酶”的作用?
DNA解旋酶(DNA helicase)是生命代谢运动中十分关键的工具酶,大部分负责打开DNA双螺旋,即把处于双链状态的DNA链打开呈单链,之后被复制、修复或转录。这种活动一般可以见于体外利用rcDNA 进行的复制或转录,但体内通常需要缠绕引入超螺旋(supercoiling)对DNA分子加以组织(3-D基因组),所以细胞内的DNA分子必须拥有“缠绕力”(超螺旋)才能被保留在传代过程中。
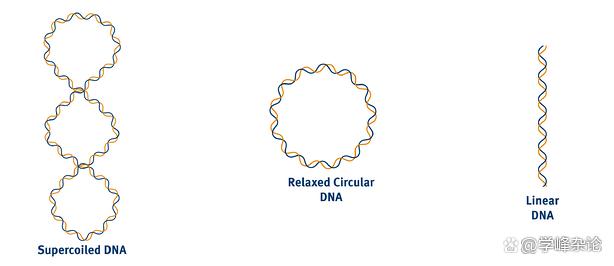
简单如DNA病毒的分子生物的DNA,如细菌的噬菌体,人类的乙型肝炎病毒等等均通过rcDNA(relaxed circular DNA, Wr=0)转化成具有超螺旋的cccDNA (共价闭合环状,covalent closed circular DNA, cccDNA, Wr不等于0 )。cccDNA形式容许病毒与宿主细胞终身共存。
 乙肝病毒通过形成cccDNA
乙肝病毒通过形成cccDNA
 通过核小体中组蛋白化学修饰和重塑
通过核小体中组蛋白化学修饰和重塑
五、神秘的缠绕-拓扑结构域
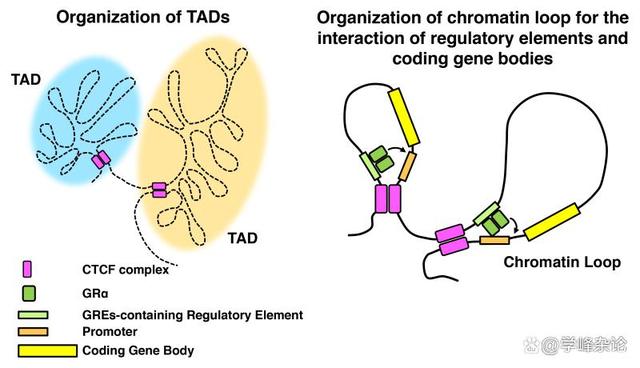
线型DNA与组蛋白八聚体形成核小体“串珠”样染色质后需要在这种染色质层级“利用拓扑学的缠绕”进行进一步组织。为此,需要以 DNA分子上“CCCTC ”基序及其结合蛋白“CTCF”进行分区固定,之后在Cohesin 这种染色质维护(SMC)蛋白体的帮助下形成一个个“环形”结构域(topologically associated domain, TAD)。
TAD应该是一组编码蛋白质或RNA的“基因”的结构实体和功能单位。其中,那些需要转录的区段接受“组蛋白密码”所形成的“指令”指导(表观遗传调控)使得染色质分为“活性区”(基本对应常染色质区,Euchromatin, eu 意识是“好的”)和“失活区”(基本类似异染色质区,heterochromatin, hetero, 意思是“异常/坏的”)。这样的TAD染色质域组织的边界由“绝缘子”(Insulator)分隔,彼此之间不受各自表观遗传指令的影响。
它们可能是高分辨染色体呈带染色(chromosome high resolution banding)时所呈现的常染色质和异染色质区段分布的基础。
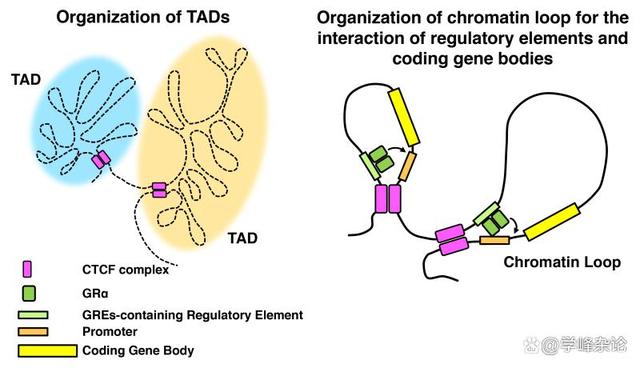 TAD的形成
TAD的形成
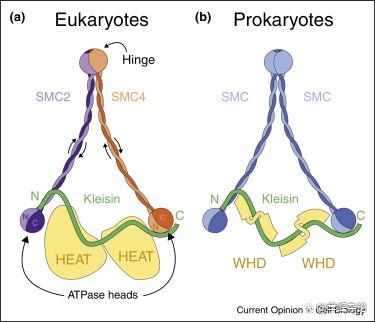 类似结构的SMC蛋白体
类似结构的SMC蛋白体
 有丝分裂中期高度压缩的性染色体
有丝分裂中期高度压缩的性染色体
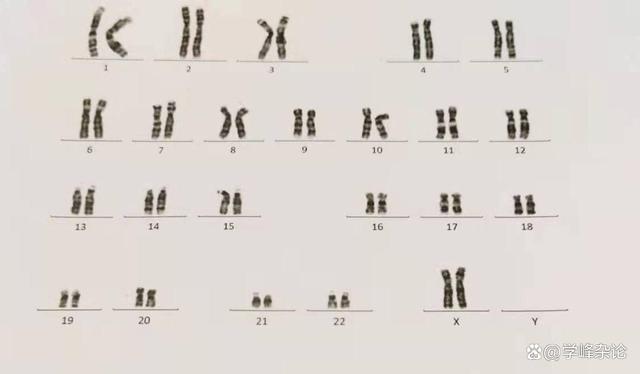 一位妇人的染色体组成的核型
一位妇人的染色体组成的核型
六、神秘的缠绕-DNA复制与染色质修饰
DNA复制发生在细胞周期S时相, 基本过程参见《基因疾病的分子生物学》和《基因的自身维护与疾病的发生》。
显然,任何组织的形成均需要细胞进行有丝分裂,以增加细胞数目。细胞分裂之前需要首先倍增细胞核内的基因组,这个过程需要DNA复制。同时,经复制倍增的基因组需要“保留”原有染色质的表观修饰状态,维系特定的“表观基因组(epigenome)”,以维持既有的特定分化类型的细胞状态。
因此,细胞分裂前后既需要“基因组DNA复制”,又需要“维系”特定的表观遗传修饰状态,完成“表观基因组的传承。
通常情况下,DNA复制异常,会造成“DNA序列或碱基的改变,如Indel 突变、碱基突变等等,表现为“基因组”的不稳定;而如果表观遗传修饰异常,则会改变细胞的分化状态,出现去分化或异常分化类型的细胞,这些改变均与“癌变”和“遗传疾病”有关。
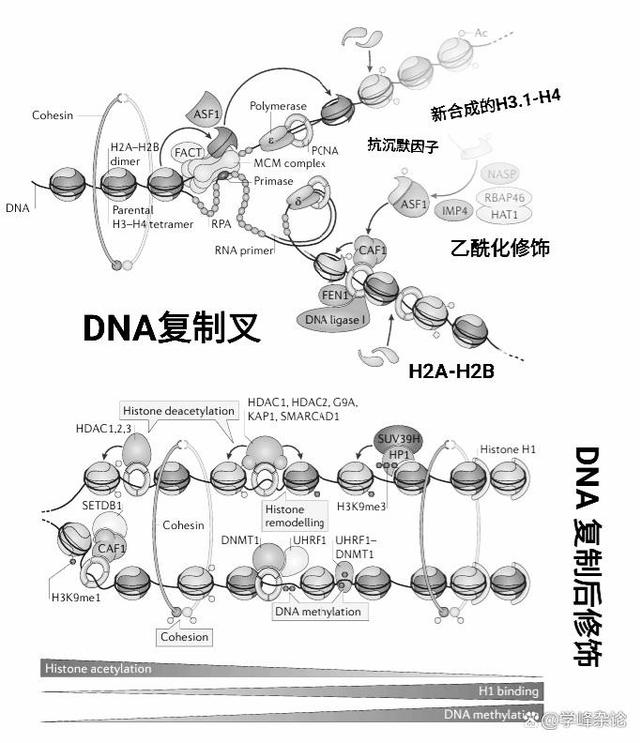 DNA 复制和修饰
DNA 复制和修饰
DNA复制过程中涉及核小体的重新组装,主要过程为新合成的组蛋白H3-H4经乙酰化修饰呈现“活性”状态,并经由抗沉默因子蛋白ASF-1 蛋白递送给染色质组装因子1(CAF-1),之后与原先与DNA模板结合的组蛋白H2A-H2B组装成“杂合”核小体。之后,主要是去乙酰化、甲基化修饰(包括组蛋白甲基化和DNA甲基化修饰),使得染色质呈“致密”状态。
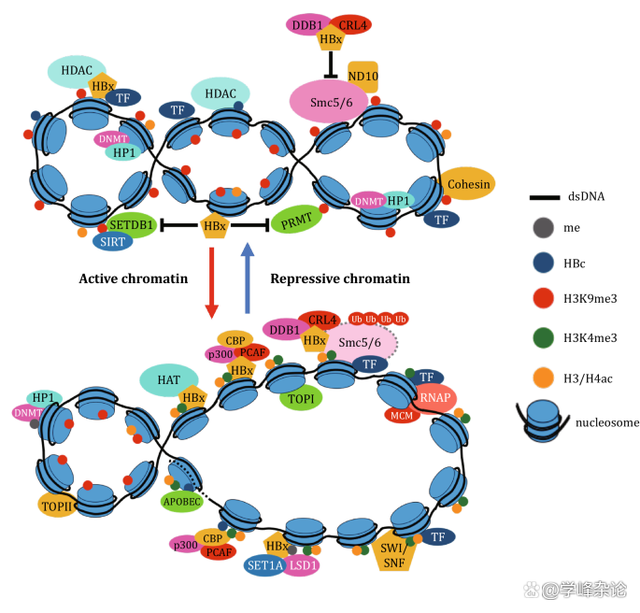 活性染色质和非活性染色质的保留,分化
活性染色质和非活性染色质的保留,分化
 表观基因组的维护
表观基因组的维护
https://m.sciencenet.cn/blog-218980-1352857.html
上一篇:潘学峰诗选-金合欢 The Golden Wattles
下一篇:科学遐想-神秘的缠绕(7--12)