博文
找泛素连接酶底物的两个新策略
|||
新的想法,特别是在一个新的领域里的新想法,未必有人引用。倒是在成熟领域的改进可能当时影响的人更多。开博后写了这些篇博文,唯一的精选博文竟是非常技术的一篇。而且不知道为什么好像点击比其他更有创意,影响更大的博文还高,到现在居然有四千多。真的是博文领域比较大的原因还是因为博文精选导致的误打误撞比较多,也看不清楚。倒是让我觉得科学网不只是玩标题党,也有些关心技术的人。哪怕只有点击数的1%的人真正在用这个方法,也有四十多个实验室了。既然是个不错的宣传方法,就继续宣传。还是应该给博主一个自己把博文排序的功能。
今天再说说我们做的找泛素连接酶底物的两个方法吧。
总结以前的方法太费时间了,也有综述,估计看了这个题目还准备点开看正文的人也都知道了。还是直入正题吧。
第一个方法是把活的表达了蛋白在表面的噬菌体文库直接扔到泛素化反应的体系中去。这时泛素化体系中的连接酶特异性地泛素化了文库中的几个噬菌体表面的蛋白。然后我们再把表面有泛素化蛋白的噬菌体富集起来,感染细菌,制备噬菌体,把噬菌体所带的插入基因测序就知道被这个连接酶泛素化的蛋白是什么了。这个实验还是需要一点前提条件的。就是这个连接酶除了表面表达的蛋白外不能泛素化噬菌体的其他蛋白。这个可以在放入噬菌体文库的实验前,先放入没有表面呈现蛋白的空噬菌体试一试。背景足够低就可以了。还有一个条件是噬菌体能够在泛素化的反应体系中保持活力和繁殖力。泛素化的体系不是特别难适应,噬菌体看样子没有问题能熬过那一段37度的时光,估计绝大部分噬菌体在表面蛋白又加上泛素后都还保持着繁殖力。整个策略如果加上一步负选择可以提前去掉文库中能够产生假阳性的克隆,后续验证效率更高。这个方法优点是比较简单快速高通量。整个过程见示意图。文章的链接在这里:http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0076622#pone-0076622-g004
Screening E3 substrates using a live phage display library.pdf

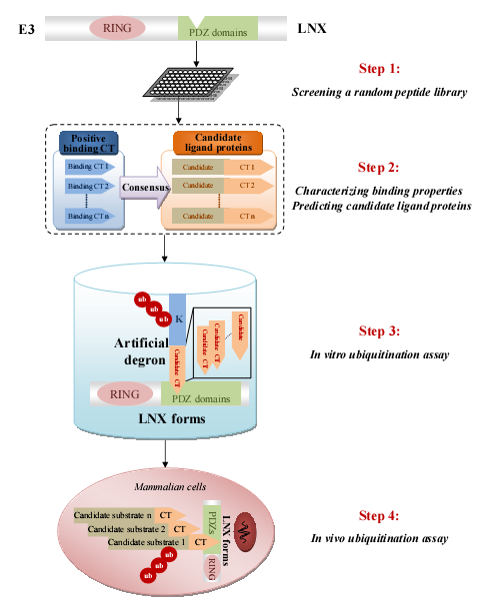
第二个方法是如果连接酶有其他的蛋白结合结构域,可以先通过这结构域找连接酶的结合蛋白,然后再试试这个结合蛋白是不是底物。当然如果只结合而不是底物,那可能就是一个站着茅坑不拉屎的泛素化调解物,它拦住了其他底物被泛素的路。泛素化的调解物用其他的方法好像还很难找到。我没印象哪个方法可以高通量筛选泛素化的调节蛋白,如果查证真没有,其实以后可以专门开发一个。我们试的是一个有PDZ结构域的连接酶。先通过PDZ的结合特性找到可能结合的蛋白,然后表达出来试试是不是底物。因为丰度不高的底物不是和其他丰度高的底物在一起筛,这个方法可以找到量比较少的底物。验证起来一个一个克隆表达比较麻烦。我们就做了一个统一的可泛素化的Degron连上我们筛出来的识别位点做底物,初步做体外验证。这样效率高一些。进一步的验证实验再用整蛋白做,那时是底物的可能性已经增大了,复杂的实验可能也值得做了。
http://pubs.acs.org/doi/abs/10.1021/pr300674c
A Proteomics Strategy to Identify Substrates of LNX, a PDZ Domain-Containing E3 .pdf
欢迎大家批评指正多提宝贵意见!
2014-5-4应读者要求贴上原文。
https://m.sciencenet.cn/blog-244733-783891.html
上一篇:最具活力的医疗体
下一篇:盲目提高自尊心到能力所不能及也许是个坏事