博文
温度对物质标准摩尔生成焓的影响
|
物质的标准摩尔生成焓(ΔfHθm)是平衡态热力学的重要概念,对热力学过程自发性的判断及标准平衡常数(Kθ)的计算有一定意义.
本文拟结合热力学基本原理探究温度对物质标准摩尔生成焓的影响.
1.基希霍夫公式
系统在任意温度下均可处于标准态, 热力学标准态通常并不限制温度.
设有一化学反应,参见如下式(1):
aA+bB=cC+dD (1)
不同温度下式(1)标准摩尔焓变(ΔrHθm)的计算公式参见如下式(2)[1].
ΔrHθm(T)=ΔrHθm(298.15K)+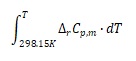 (2)
(2)
式(2)称基希霍夫公式.
1.1 反应的标准摩尔焓变[ΔrHθm(298.15K)]
式(2)中ΔrHθm(298.15K)计算公式参见如下式(3).
ΔrHθm(298.15K)=∑(νB·ΔfHθm,B)
=c·ΔfHθm,C(298.15K)+d·ΔfHθm,D(298.15K)-a·ΔfHθm,A(298.15K)-b·ΔfHθm,B(298.15K) (3)
1.2 反应的定压摩尔热容[ΔrCp,m(298.15K)]
式(2)中ΔrCp,m称化学反应的定压摩尔热容,其计算公式参见如下式(4).
ΔrCp,m=∑(νB·Cp,m,B)
=c·Cp,m,C(298.15K)+d·Cp,m,D(298.15K)-a·Cp,m,A(298.15K)-b·Cp,m,B(298.15K) (4)
1.3 ΔfHθm(T)的计算
将式(3)及(4)分别代入式(2)并整理可得:
ΔrHθm(T)=∑{νB·[ΔfHθm,B(298.15K)+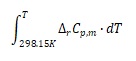 ]} (5)
]} (5)
另:ΔrHθm(T)=∑[νB·ΔfHθm,B(T)] (6)
结合式(5)及(6)可得:
ΔfHθm,B(T)=ΔfHθm,B(298.15K)+ (7)
式(7)为B物质T温度下的标准摩尔生成焓计算公式.
由式(7)可知,物质的标准摩尔生成焓是温度函数,改变温度,物质的ΔfHθm值发生变化.
2. 热力学实例
例1. 试分别计算500K时H2(g),O2(g)及H2O(g)的ΔfHθm,并计算化学反应H2(g)+1/2O2(g)=H2O(g)的ΔrHθm(500K). 已知[2]298.15K时ΔfHθm(H2O,g) =-241.818kJ·mol-1,H2(g),O2(g)及H2O(g)的平均定压摩尔热容Cp,m的值依次为:28.828、29.355及33.577J·mol-1·K-1.
解:由式(7)可得:
ΔfHθm(H2, 500K)=Cp,m,H2(T-298.15K)
=28.828J·mol-1·K-1×(500K-298.15K)
=5.819kJ·mol-1
ΔfHθm(O2, 500K)=Cp,m,O2(T-298.15K)
=29.355J·mol-1·K-1×(500K-298.15K)
=5.925kJ·mol-1
ΔfHθm(H2O, g, 500K)= ΔfHθm(H2O, g, 298.15K)+Cp,m,H2O(T-298.15K)
=-241.818kJ·mol-1+33.577J·mol-1·K-1×(500K-298.15K)
=-235.040kJ·mol-1
由式(6)可得:
ΔrHθm(T)=∑[νB·ΔfHθm,B(T)]
=ΔfHθm(H2O, g, 500K)-1/2·ΔfHθm(O2, g, 500K)-ΔfHθm(H2, g, 500K)
=-235.040kJ·mol-1-1/2×5.925kJ·mol-1-5.819kJ·mol-1
=-243.822kJ·mol-1
3. 结论
⑴ ΔfHθm,B(T)=ΔfHθm,B(298.15K)+ ;
⑵ ΔrHθm(T)=∑[νB·ΔfHθm,B(T)]
参考文献
[1]天津大学物理化学教研室编. 物理化学(上册,第四版).北京:高等教育出版社, 2001,12:83-84.
[2] Lide D R. CRC Handbook of Chemistry and Physics. 89th ed, Chemical Co, 2008,17:2688.
https://m.sciencenet.cn/blog-3474471-1355894.html
上一篇:绝热过程的新解读
下一篇:热力学"-pdV"意义的探究