博文
典型无机物的大Π键类型解析
|
本文拟结合价层电子对互斥理论及杂化轨道理论解析典型无机物的大Π键类型,供参考.
S-O类无机物的大Π键类型解析
本文探讨的S-O类无机物包括SO2、SO3、SO42-与H2SO4.
1.1 SO2分子的大Π键类型解析
依据价层电子对互斥理论可得SO2分子:
价层电子对数VP=1/2×中心(或硫)原子的价电子总数=1/2×6=3;
键电子对数BP=2;
孤电子对数LP=VP-BP=3-2=1.
由上可得SO2分子的空间构型为角(或"V")形.
另S原子的价电子构型为:3s23p4.
结合杂化轨道理论可知:SO2分子形成时,S原子将采用sp2不等性杂化,参见如下图1.

图1. S原子sp2不等性杂化示意图
图1中S原子的两个含有单电子的sp2不等性杂化轨道,将分别接受两个氧原子提供的自旋方向相反的单电子形成两个完全相同的σ共价键;需强调S原子的sp2不等性杂化轨道中孤电子对将不参与大Π键形成.
SO2分子的结构示意参见如下图2.
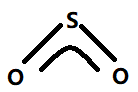
图2. SO2分子结构示意图
图2中O-S-O形成的大Π键包括三个中心(O-S-O);其中S原子提供一对未参与杂化的3p轨道中的孤对电子,两个O原子各提供一个单电子共同参与大Π键的形成,一共包含“2+2×1=4”个电子.
因此SO2分子中大Π键包括三个中心,四个电子,即可表示为: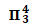
1.2 SO3分子的大Π键类型解析
依据价层电子对互斥理论可得SO3分子:
价层电子对数VP=1/2×中心(或硫)原子的价电子总数=1/2×6=3;
键电子对数BP=3;
孤电子对数LP=VP-BP=3-3=0.
由上可得SO3分子的空间构型为平面三角形, S原子位于平面三角形的几何中心.
另S原子的价电子构型为:3s23p4.
结合杂化轨道理论可知:SO3分子形成时,S原子将采用sp2等性杂化,参见如下图3.

图3. S原子sp2等性杂化示意图
图3中S原子的三个含有单电子的sp2等性杂化轨道,将分别接受三个氧原子提供的自旋方向相反的单电子形成三个完全相同的σ共价键.
SO3分子的结构示意参见如下图4.
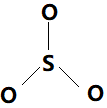
图4. SO3分子结构示意图
图4中SO3分子形成的离域大Π键包含四个中心(一个S原子,三个氧原子);其中S原子提供三个未参与杂化的价电子,三个O原子各提供一个单电子,共包括“3+3×1=6”电子.
因此SO3分子中离域大Π键可表示为: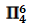
1.3 SO42-的大Π键类型解析
依据价层电子对互斥理论可得SO42-:
价层电子对数VP=1/2×[中心(或硫)原子的价电子总数+2]=1/2×(6+2)=4;
键电子对数BP=4;
孤电子对数LP=VP-BP=4-4=0.
由上可得SO42-空间构型为正四面体,S位于正四面体的体心,四个O位于正四面体的四个角顶.
另S原子的价电子构型为:3s23p4.
结合杂化轨道理论可知:SO42-形成时,S原子将采用sp3等性杂化,参见如下图4.
![]()
图4. S原子sp3等性杂化示意图
图4中S原子的四个含有单电子的sp3等性杂化轨道,将分别接受四个氧原子提供的自旋方向相反的单电子形成四个完全相同的σ共价键.
SO42-的结构式示意参见如下图5.
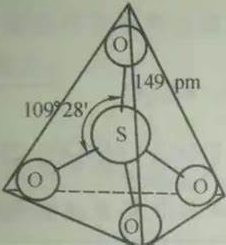
图5. SO42-的结构式示意图
图5中SO42-形成的离域大Π键包含五个中心(一个S原子,四个氧原子);其中S原子提供两个未参与杂化的价电子,四个O原子各提供一个单电子,再加上SO42-所带的两个负电荷,共包括“2+4×1+2=8”电子.
因此SO42-中离域大Π键可表示为: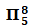
1.4 H2SO4的大Π键类型解析
图5中任意两个角顶的氧原子分别再结合一个氢原子,便形成了H2SO4结构示意图, 参见如下图6.
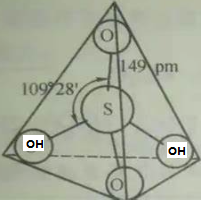
图6. H2SO4分子的结构式示意图
图6中两个角顶的O原子分别与H原子结合形成一个σ共价键,此时这两个O原子的成键能力均消耗完,将不参与后期的离域大Π键的形成.
图6中H2SO4的离域大Π键包含三中心(一个S原子,两个O原子);其中S原子提供两个未参与杂化的价电子,二个O原子各提供一个价电子,共包括“2+2×1=4”电子. 即可表示为: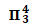
S-O类无机物的大Π键类型解析结果参见如下表1.
表1. S-O类无机物的大Π键类型解析结果
| S-O类无机物化学式 | 中心原子轨道杂化方式 | 离域大Π键类型 |
| SO2 | sp2不等性杂化 | 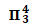 |
| SO3 | sp2等性杂化 | 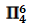 |
| SO42- | sp3等性杂化 | 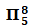 |
| H2SO4 | sp3等性杂化 | 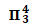 |
2. N-O类无机物的大Π键类型解析
本文探讨的N-O类无机物包括NO2、NO3-与HNO3.
2.1 NO2分子的大Π键类型解析
依据价层电子对互斥理论可得NO2分子:
价层电子对数VP=1/2×中心(或氮)原子的价电子总数=1/2×5=2.5;
键电子对数BP=2;
孤电子对数LP=VP-BP=2.5-2=0.5.
备注:特指孤单电子.
由上可得NO2分子的空间构型为角(或"V")形.
另N原子的价电子构型为:2s22p3.
结合杂化轨道理论可知:NO2分子形成时,N原子将采用sp2不等性杂化,参见如下图7.

图7. N原子sp2不等性杂化示意图
图7中N原子的两个含有单电子的sp2不等性杂化轨道,将分别接受两个氧原子提供的自旋方向相反的单电子形成两个完全相同的σ共价键.
NO2分子的结构式参见如下图8.
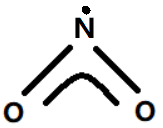
图8. NO2分子结构式
图8中NO2的离域大Π键包含三中心(一个N原子,两个O原子);其中N原子提供两个未参与杂化的价电子,二个O原子各提供一个价电子,共包括“2+2×1=4”电子. 即可表示为: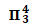
2.2 NO3-的大Π键类型解析
依据价层电子对互斥理论可得NO3-:
价层电子对数VP=1/2×(中心(或氮)原子的价电子总数+1)=1/2×(5+1)=3;
键电子对数BP=3;
孤电子对数LP=VP-BP=3-3=0.
由上可得NO3-的空间构型为平面三角形.
另N原子的价电子构型为:2s22p3.
结合杂化轨道理论可知:NO3-形成时,N原子将采用sp2等性杂化,参见如下图9.

图9. N原子sp2等性杂化示意图
图9中N原子的三个含有单电子的sp2等性杂化轨道,将分别接受三个氧原子提供的自旋方向相反的单电子形成三个完全相同的σ共价键.
NO3-的结构示意参见如下图10.
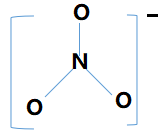
图10. NO3-结构示意图
图10中NO3-的离域大Π键包含四中心(一个N原子,三个O原子);其中N原子提供两个未参与杂化的价电子,三个O原子各提供一个价电子,再加上自身所带的一个负电荷,共包括“2+3×1+1=6”电子. 即可表示为:![]()
2.3 HNO3的大Π键类型解析
图10中任意一个角顶的氧原子再结合一个氢原子,便形成了HNO3结构示意图, 参见如下图11.

图11. HNO3的结构式示意图
图11中角顶的O原子与H原子结合形成一个σ共价键,此时该O原子的成键能力消耗完,不参与后期的离域大Π键的形成.
图11中HNO3的离域大Π键包含三中心(一个N原子,两个O原子);其中N原子提供两个未参与杂化的价电子,二个O原子各提供一个价电子,共包括“2+2×1=4”电子. 即HNO3的离域大Π键可表示为: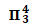
N-O类无机物的大Π键类型解析结果参见如下表2.
表2. N-O类无机物的大Π键类型解析结果
| N-O类无机物化学式 | 中心原子轨道杂化方式 | 离域大Π键类型 |
| NO2 | sp2不等性杂化 | 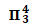 |
| NO3- | sp2等性杂化 | 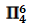 |
| HNO3 | sp2等性杂化 | 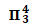 |
3. 其它类无机物的大Π键类型解析
本文探讨的其它类无机物包括O3和CO2.
3.1 O3分子的大Π键类型解析
将O3分子拆分成"OO2"型分子,依据价层电子对互斥理论可得O3分子:
价层电子对数VP=1/2×中心(或氧)原子的价电子总数=1/2×6=3;
键电子对数BP=2;
孤电子对数LP=VP-BP=3-2=1.
由上可得O3分子的空间构型为角形.
另O原子的价电子构型为:2s22p4.
结合杂化轨道理论可知:O3分子形成时,O原子将采用sp2不等性杂化,参见如下图12.
![]()
图12. O原子sp2不等性杂化示意图
图12中O原子的两个含有单电子的sp2不等性杂化轨道,将分别接受两个氧原子提供的自旋方向相反的单电子形成两个完全相同的σ共价键;O原子的sp2不等性杂化轨道中孤电子对通常不参与大Π键形成.
O3分子的结构示意参见如下图13.
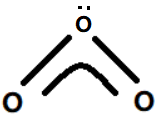
图13. O3分子结构示意图
图13中O-O-O形成的大Π键包括三个中心(O-O-O);其中中心O原子提供一对未参与杂化的2p轨道中的孤对电子,两个O原子各提供一个单电子共同参与大Π键的形成,一共包含“2+2×1=4”个电子.
因此O3分子中大Π键包括三个中心,四个电子,即可表示为: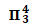
3.2 CO2分子的大Π键类型解析
依据价层电子对互斥理论可得CO2分子:
价层电子对数VP=1/2×中心(或 碳)原子的价电子总数=1/2×4=2;
键电子对数BP=2;
孤电子对数LP=VP-BP=2-2=0.
由上可得CO2分子的空间构型为直线形.
另C原子的价电子构型为:2s22p2.
结合杂化轨道理论可知:CO2分子形成时,C原子将采用sp等性杂化,参见如下图14.

图14. C原子sp等性杂化示意图
图14中C原子的两个含有单电子的sp等性杂化轨道,将分别接受两个氧原子提供的自旋方向相反的单电子形成两个完全相同的σ共价键.
CO2分子的结构示意参见如下图15.

图15. CO2分子结构示意图
图15中O-C-O形成的大Π键包括三个中心(O-C-O);其中中心C原子提供两个未参与杂化的2p轨道中的单电子,两个O原子各提供一个单电子共同参与大Π键的形成,一共包含“2+2×1=4”个电子.
因此CO2分子中大Π键包括三个中心,四个电子,即可表示为: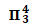
其它类无机物的大Π键类型解析结果参见如下表3.
表3. N-O类无机物的大Π键类型解析结果
| 其它类无机物化学式 | 中心原子轨道杂化方式 | 离域大Π键类型 |
| CO2 | sp等性杂化 | 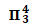 |
| O3 | sp2不等性杂化 | 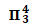 |
4. 结论
⑴中心原子参与杂化的孤对电子通常不再参与后期大Π键的形成;
⑵典型无机物大Π键解析结果如下表所示:
| 典型无机物化学式 | 中心原子轨道杂化方式 | 离域大Π键类型 |
| CO2 | sp等性杂化 | 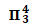 |
| O3 | sp2不等性杂化 | 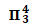 |
| NO2 | sp2不等性杂化 | 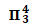 |
| NO3- | sp2等性杂化 | 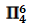 |
| HNO3 | sp2等性杂化 | 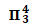 |
| SO2 | sp2不等性杂化 | 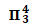 |
| SO3 | sp2等性杂化 | 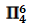 |
| SO42- | sp3等性杂化 | 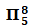 |
| H2SO4 | sp3等性杂化 | 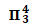 |
https://m.sciencenet.cn/blog-3474471-1382153.html
上一篇:热力学平衡态、准静态过程与环境的图像关系
下一篇:胶体的光学性质——丁达尔效应介绍