博文
含化学势及表面张力的热力学基本方程应用
|
本文拟介绍准静态过程假说中含化学势及表面张力的热力学基本方程应用实例,供参考.
含化学势及表面张力的热力学基本方程
对于均相多组分系统,准静态过程假说中含化学势及表面张力的热力学基本方程,参见如下式(1)所
示:
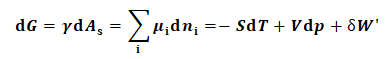 (1)
(1)
式(1)中γ表示表面张力;μi表示均相多组分系统中i组分的化学势;W'代表热力学过程的有效功.
2. 含表面张力的热力学基本方程应用实例
[例1].在293K时,把半径(R)为1×10-3m的水滴分散成半径(r)为1×10-6m的小水滴,计算该过程的ΔG.
已知:γ(H2O,l,293K)=72.75mN/m.
解:准静态过程假说认为,该过程dT=0、δW'=0.
此时式(1)可化简为:
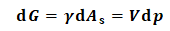 (2)
(2)
式(2)积分可得:
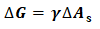 (3)
(3)
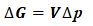 (4)
(4)
2.1 表面张力计算法
依题:水滴 As1=4πR2=4×3.142×(1×10-3)2m2=1.257×10-5m2
小水滴 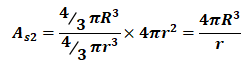
=4×3.142×(1×10-3)3/(1×10-6) m2=1.257×10-2m2
则: (5)
(5)
将式(5)结果及γ(H2O,l,293K)数据代入式(3)可得:
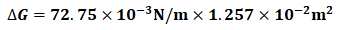
= 9.145×10-4J (6)
2.2 附加压力计算法
依题:水滴 V=4/3·πR3=4/3×3.142×(1×10-3)3m3=4.189×10-9m3 (7)
由液滴附加压力计算公式可得:
水滴 p1=3γ/R=3×72.75×10-3N/m÷(1×10-3m)=218.25N/m2 (8)
小水滴 p2=3γ/r=3×72.75×10-3N/m÷(1×10-6m)=218.25×103N/m2 (9)
将式(7)、(8)及(9)结果代入式(4)可得:
ΔG=V·(p2-p1)
=4.189×10-9m3×(218.25×103N/m2-218.25N/m2)=9.143×10-4J (10)
考虑计算误差,式(6)与(10)结果相同,表明含有表面张力的热力学基本方程正确.
3. 含化学势的热力学基本方程应用实例
[例2]. 试计算25℃标态下,反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)提供的有效功W'.
已知:25℃标态下,ΔfGθm(Cu2+)=65.49kJ·mol-1;ΔfGθm(Zn2+)=-147.06kJ·mol-1.
解:由式(1)可得,
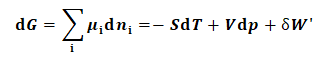 (11)
(11)
依题化学反应发生在:恒温(dT=0),恒压(dp=0)条件下 .
将上述条件代入式(11),并积分可得:
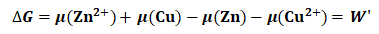 (12)
(12)
另依热力学基本原理,25℃标态下,该反应:
ΔrGθm=ΔfGθm(Zn2+)+ΔfGθm(Cu)-ΔfGθm(Zn)-ΔfGθm(Cu2+)
=-147.06kJ·mol-1+0-0-65.49kJ·mol-1
=-212.55kJ·mol-1 (13)
式(13)结合式(12)可知25℃标态下,反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)提供的有效功:
W'=ΔrGθm=-212.55kJ·mol-1 (14)
[例3]. 1mol氮气,在100kPa下,由25℃恒压升温至60℃,试计算该过程的ΔG.
解:该过程示意图如下,
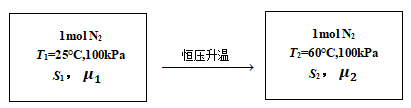
图1. 氮气恒压升温示意图
查表可得: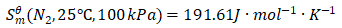 ;
;
 .
.
另: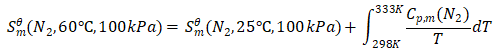
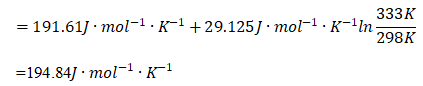 (15)
(15)
依题该过程:dp=0,δW'=0.
将上述条件代入式(11),并积分可得:
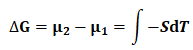 (16)
(16)
对于恒压条件下,理想气体pVT变化:
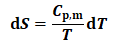 (17)
(17)
又因为:d(TS)=TdS+SdT
则:SdT=d(TS)-TdS
上式两边积分可得:
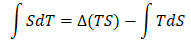 (18)
(18)
式(18)中:
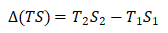
=194.84J·mol-1·K-1×333.15K-191.61J·mol-1·K-1×298.15K
=7.782kJ·mol-1 (19)
将式(17)代入下式可得:

=1.019kJ·mol-1 (20)
将式(19)及(20)代入式(18)可得:
 (21)
(21)
将式(21)代入式(16)可得:
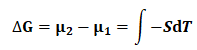
=-6.763kJ·mol-1 (22)
需明确,有效功作为热力学过程中能量传递的一种固定方式,出现在热力学基本方程式中是合理的;
式(11)揭示出热力学基本方程式中化学势与有效功的正确关系.
3. 结论
含化学势及表面张力的热力学基本方程式为:

参考文献
[1]余高奇. 表面张力的热力学属性探究.http://blog.sciencenet.cn/u/yugaoqi666.科学网博客,2023,12.
[2]余高奇. 化学势的热力学属性探究.http://blog.sciencenet.cn/u/yugaoqi666.科学网博客,2023,12.
https://m.sciencenet.cn/blog-3474471-1414478.html
上一篇:小液滴饱和蒸汽压与热力学基本方程
下一篇:化学势在理想气体pVT变化过程ΔG计算中的应用