博文
浅析热力学标态反应的实现途径(Ⅱ)
|
本文拟在博文“浅析热力学标态反应的实现途径”的基础上,结合具体实例,进一步明确热力学标态反应
的意义.
1. 热力学标态反应实例
[例]. 试利用298.15K标态下的热力学数据,计算敞口容器内反应CaCO3(s)→CaO(s)+CO2(g),①正向进行的最低(或转化)温度;②298.15K及1400K时反应的标准平衡常数;③298.15K及1400K时CaCO3(s)的分解压. 相关物质的热力学性质参见如下表1[1].
表1. 298.15K标态下相关物质的热力学性质

2.标态反应的热力学计算
依热力学基本原理可得:
ΔrHθm(298.15K)=ΔfHθm(CaO,s,298.15K)+ΔfHθm(CO2,g,298.15K)-ΔfHθm(CaCO3,s,298.15K)
=-635.09kJ·mol-1+(-393.51kJ·mol-1)-(-1206.92kJ·mol-1)
=178.32kJ·mol-1 (1)
ΔrGθm(298.15K)=ΔfGθm(CaO,s,298.15K)+ΔfGθm(CO2,g,298.15K)-ΔfGθm(CaCO3,s,298.15K)
=-604.03kJ·mol-1+(-394.36kJ·mol-1)-(-1128.79kJ·mol-1)
=130.40kJ·mol-1 (2)
ΔrSθm(298.15K)=Sθm(CaO,s,298.15K)+Sθm(CO2,g,298.15K)-Sθm(CaCO3,s,298.15K)
=39.75J·mol-1·K-1+213.74J·mol-1·K-1-92.9J·mol-1·K-1
=160.59J·mol-1·K-1 (3)
ΔrCp,m(298.15K)=Cp,m(CaO,s,298.15K)+Cp,m(CO2,g,298.15K)-Cp,m(CaCO3,s,298.15K)
=42.80J·mol-1·K-1+37.11J·mol-1·K-1-81.88J·mol-1·K-1
=-1.97J·mol-1·K-1 (4)
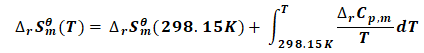
=160.59J·mol-1·K-1 -1.97J·mol-1·K-1 ×ln(T/298.15K)>0 (5)
又因为: ΔrGθm(T)=ΔrHθm(T)-T·ΔrSθm(T) (6)
式(5)结合式(6)可知:温度升高,ΔrGθm(T)减小,有利于反应的自发性.
2.标态反应热力学计算的意义
2.1 转变温度(Tc)的获取
转变温度(Tc)是指标态反应实现平衡时,对应的温度.
对于标态反应CaCO3(s)→CaO(s)+CO2(g),建立平衡时:
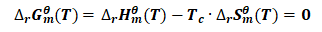 (5)
(5)
则: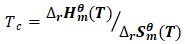 (6)
(6)
为方便计算Tc,可认为温度改变时,反应的焓变与熵变值基本不变;
即: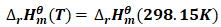 (7)
(7)
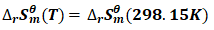 (8)
(8)
将式(7)、(8)结果代入式(6)可得:
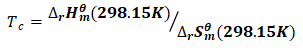 (9)
(9)
将式(1)、(2)结果代入式(9)可得:
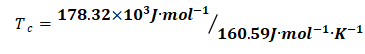
=1110.4K
即:该反应正向进行的最低温度为1110.4K.
2.2 热力学平衡常数的获取
平衡态热力学规定,
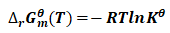 (10)
(10)
由式(10)可得:
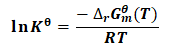 (11)
(11)
因为: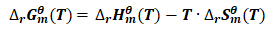 (12)
(12)
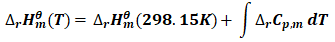 (13)
(13)
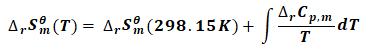 (14)
(14)
热力学反应通常发生在恒温条件下,此时将式(13)、(14)分别代入式(12),并整理可得:
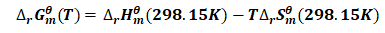 (15)
(15)
由式(1)、(3)及(15)可得:
![]()
=178.32kJ·mol-1-1400K×160.59J·mol-1·K-1
=-46.506kJ·mol-1
将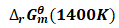 及
及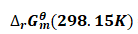 的值,分别代入式(11)可得:
的值,分别代入式(11)可得:
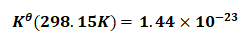 (16)
(16)
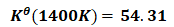 (17)
(17)
2.3 分解压的计算
一定温度下,反应CaCO3(s)→CaO(s)+CO2(g)建立平衡时,CO2(g)的分压,被称为CaCO3(s)的分解压.
则: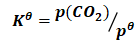 (18)
(18)
由式(18)可得:
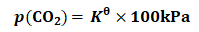 (19)
(19)
将式(16)数据代入式(19)可得:
298.15K时,CaCO3(s)的分解压: (20)
(20)
将式(17)数据代入式(19)可得:
1400K时,CaCO3(s)的分解压: (21)
(21)
需强调,热力学标态反应仅是一种理论模型,客观无法实现. 热力学借助该模型的热力学计算获取真实化学
反应的转变温度Tc、热力学平衡常数Kθ及分解压p等.
3. 结论
通过标态反应的热力学计算,可获取真实化学反应的转变温度Tc、热力学平衡常数Kθ及分解压p等.
参考文献
[1] Lide D R. CRC handbook of chemistry and physics. 89th ed, Chemical Rubber, 2008,17:268
https://m.sciencenet.cn/blog-3474471-1414992.html
上一篇:典型无机热力学题目解析(二)
下一篇:平衡态热力学计算的主要公式