博文
氢燃料的使用价值
||
按:首先,开宗明义,本人不支持以氢气作为能源的普遍使用。
其一、本博对经典温室效应理论持否定意见,因此不支持这类应对措施,因为根本没有任何的益处。
其二、本博今后几篇将专题讨论氢气作为能源利用所面对的热力学基础问题,可以清楚地揭示氢气不宜作为化石能源的替代品。欢迎批评指正。
氢燃料的使用价值
为应对气候变化,氢能得到前所未有的重视。自2016年,仅国家层面颁布的涉氢扶持政策和专项就多达10余项,一些地方政府的政策扶持力度也很大,吸引了大量的社会投资,氢能技术发展正在加速。
2020年我国氢气产量超2500万吨,其中煤制氢占62%,天然气制氢占19%,工业副产气制氢占18%,电解水制氢占1%左右。这说明到目前为止,氢气主要自然化石能源转化,这背后还存在着相当比重的碳排放。
然而,氢气在自然界非常稀少,作为能源使用必须通过工业处理才能批量获得。氢气固有的热力学性质会对其制备、输运及利用的能效及成本产生直接影响,本文拟从基础热力学出发,对此做一简要分析,供氢能相关领域的专业人员参考。
在热能工程中,燃料直接燃烧释放出热量,热被用于火力发电及供热等等,燃料的使用价值表示为热量,于是燃料的热值成为热力学第一定律效率(热效率)计算的基准。燃料的交易也以其热值为基准。为统一计量,人们提出了标准煤的概念,通过标准煤热值或油当量对不同燃料进行统一折算。我国能源以煤为主,使用标准煤进行统一折算,许多国家和地区的燃料以石油天然气为主,他们多以油当量进行统一折算。标准煤热值为29307.6 kJ/kg(7000kcal/kg),油当量值为41868 kJ/kg(10000kcal/kg)。
燃料燃烧通常有水蒸汽产生,如果热值不包括水蒸汽的潜热,则称为燃料的低位热值,如果包括这部分潜热,则称为燃料的高位热值。在能源利用系统中,燃烧产生的水蒸汽及潜热一般都随烟气排放到环境中而损失掉了。另外,烟气中的水蒸汽凝结温度多数比较低,以含氢比重较高的天然气为例,其烟气的饱和温度在56℃的水平,即便潜热得以回收,其做功能力(热量㶲)也不高,适合辅助采暖供热使用。我国的能源标准规定以燃料的低位热值作为能效计算和燃料量统计的基准。
在热力学中,化学反应的反应自由焓之负值(-△G)被称为该化学反应的化学功或化学能。我们知道,化学反应本质上是参与反应的分子之间进行电子交换而生成产物的过程,其化学功的输出与利用需要类似燃料电池的技术,化学反应分在阴阳电极上间接进行,所交换的电子经过外电路形成定向电流而供用户使用。如果反应物直接混合进行化学反应,则无法形成定向电流,其化学功将无法输出,这会导致不可逆损失的产生。
化学功是一个化学反应可以直接输出电量的理论最大值。对于化石燃料,其化学功在热力学参考环境状态下为最大,随着反应温度的升高,其燃烧反应的化学功减小。单位质量的燃料在此参考环境状态下的化学功(-△gR0)可以视为该燃料的比化学㶲。根据热力学理论,㶲是体系最大的做功能力,燃料的化学㶲是热力学第二定律视角下燃料的使用价值,亦是能源利用第二定律效率计算的基准。
由于燃烧产物相对于参考环境的大气成分,还具有分子扩散做功的能力,因此严格说来,燃料的化学㶲应包括这一部分扩散㶲。但是,如果把这部分扩散㶲计入燃料的化学㶲,则燃料和助燃剂从何而来以及为此所付出的能量消耗等问题也势必需要加以考虑,这些对能源利用第二定律效率的计算带来困扰。
在热力学中,△gR0又称为燃料燃烧的标准反应自由焓,△gR0=△hR0-T0△sR0,式中的△hR0称为标准反应焓,负的标准反应焓(-△hR0)即为燃料的热值;△sR0是燃料燃烧的标准反应熵。显然,燃料化学㶲的计算还涉及燃料熵的确定。然而,对于以混合物形式存在的煤、石油和天然气等实际燃料,其热力学参数计算非常复杂。但复杂的计算不意味着有更可靠的结果,因此为了简便,一些文献给出了经验模型来计算燃料的化学㶲,但这又导致能源利用系统的㶲平衡分析在理论上无法平衡的问题。不仅如此,针对能源利用效率的计算,热力学第一定律与第二定律使用了不同的基准,这极大地阻碍了第二定律方法的应用,也影响到对氢燃料使用价值及能效的认识。
事实上,能源利用系统处于环境之中,燃料和氧气来源于环境,产品、热损失、烟气及废弃物仍处于环境之中。如果我们将参考环境纳入燃料化学㶲的分析,则会有完全不同的认识。根据热力学的定义,以及为满足热力学分析计算的客观要求,参考环境具有无穷大的性质,能源利用系统与之交换物质和热量,其温度、压力、质量及成分构成均保持不变,这意味着热力学分析要求能源利用系统+参考环境的总熵变为0,即△S=0。如果我们考虑单位质量的燃料在参考环境中的完全燃烧,其化学㶲将全部损失,根据热力学第二定律,其熵产可以表示为:
sgen =△s-△es =-△es=-△hR0/T0 (1)
在这种条件下,燃料的化学㶲等于燃料燃烧的不可逆损失,根据Gouy-Stodla方程,有,
ef= T0sgen =-△hR0 (2)
即燃料的化学㶲取燃料的热值,这使得在计算能源利用效率时,热力学第二定律与第一定律的基准得到统一,有助于热力学第二定律的应用。
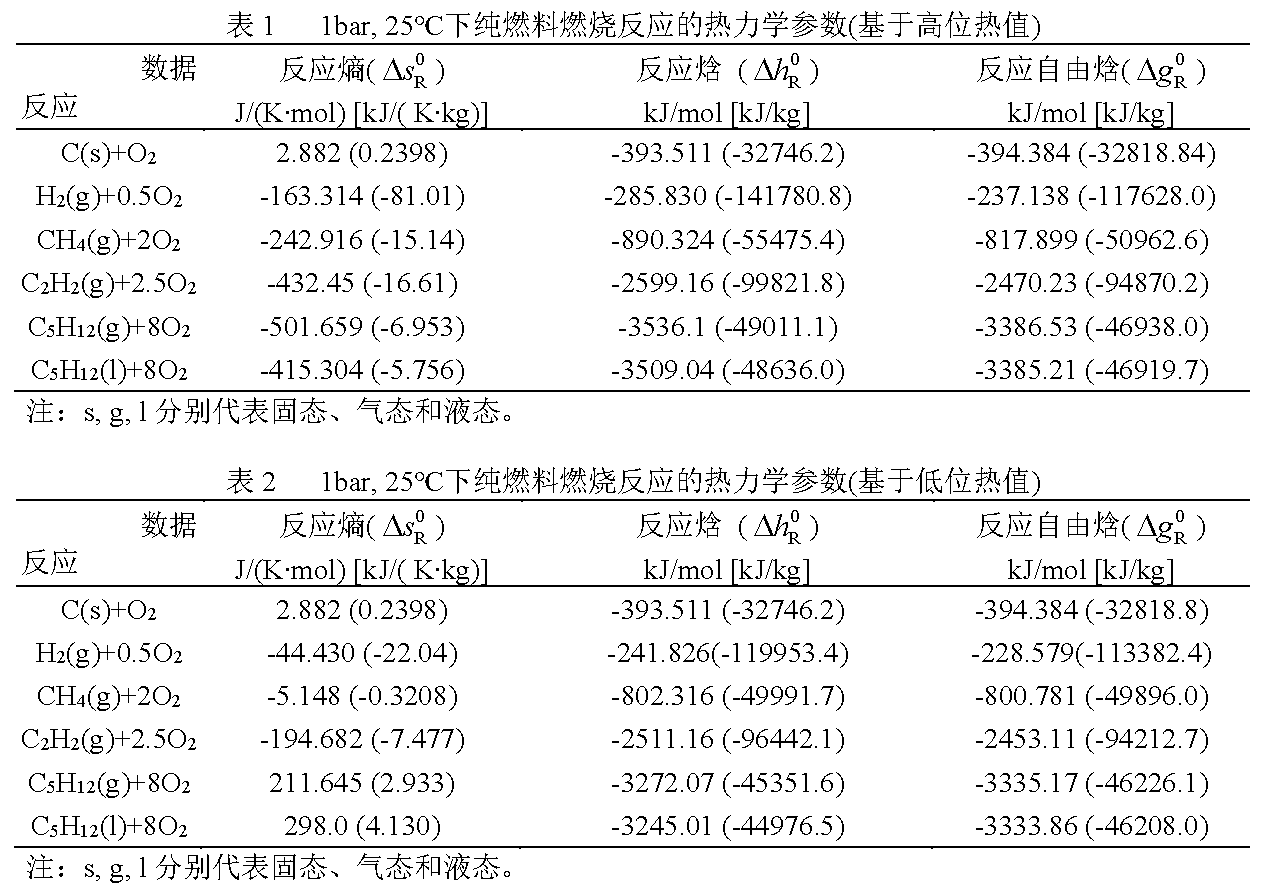
表1和表2给出了一些纯燃料以1bar,25℃为参考环境状态下的燃烧反应的热力学参数。由于多数燃料的标准反应自由焓(△gR0)与标准反应焓(△hR0)相差不大,因此,一些学者提出将热值作为燃料的化学㶲。
电是最高品质的能量,最易于输运及利用,一个国家和地区的电气化水平在很大程度上反映了其现代化水平,燃料的使用价值可以用其理论最大可转化的电量表示,如此处理可以方便不同能源之间的等价换算及对比分析。
㶲是体系的做功能力,电是最高品质的功量,可视为100%的㶲。遵照式(2),将燃料的化学㶲取燃料的热值,则燃料的比电㶲为:
efe =ef /3600 [kW·h/kg] (3)
对于标准煤,ef =qls=29307.6kJ/kg,根据上式,其比电㶲为:
efe,s =29307.6/3600 =8.141 kW·h/kg
上式的物理意义在于,在没有任何不可逆损失的理想条件下,单位标准煤所能转化生产的电量。
对于氢燃料,如果以高位热值计算,氢燃料的比电㶲为:
ef,HCVe,s =141780.8/3600=39.38kW·h/kg
如果以低位热值计算,氢燃料的比电㶲为:
ef,LCVe,s =119953.4/36000=33.32kW·h/kg
由于氢燃料电池排放的是水蒸汽,即氢燃料的使用,最少有39.38-33.32=6.06 kW·h/kg的潜热损失,占氢燃料高位热值的15.4%。
另外,从表1和表2不难看出,燃料的高、低位热值之差与其含氢元素的比重有关,含氢量比重越高,差额越大。
https://m.sciencenet.cn/blog-38693-1338411.html
上一篇:2021年诺贝尔物理学奖获得者真锅淑郎论文错误之三
下一篇:电解水制氢的能耗与成本估算