博文
感染、代谢与肿瘤——Infection,Metabolism and Cancer
|
代谢与肿瘤
恶性肿瘤是严重威胁人类生命和影响人类生活质量的重大疾病之一。虽然近年来在肿瘤生物学研究和治疗领域有较大进展,但目前临床上用于化疗的药物仍有很大的局限性。大多数传统化疗药物在抑制肿瘤细胞的同时,对正常细胞有较大的毒性,副作用严重。特异性靶向药物虽然毒性较小,但其应用范围相对狭窄,且许多患者治疗后肿瘤仍然复发。肿瘤靶向治疗失败的主要原因在于大部分癌细胞有多位点基因突变或异常,针对某个特定基因分子的靶向治疗在多数情况下并不能有效杀灭肿瘤细胞。因此,探索肿瘤细胞中普遍存在但又异于正常细胞的生物学特性,并针对该特性进行特异性干预,是提高肿瘤治疗疗效的关键。
正常组织中,90%的能量(ATP)来源于氧化磷酸化,仅有10%源于糖酵解,且有氧条件下糖酵解受到抑制,称为巴斯德(Pasteur)效应。1924年德国著名生物化学家﹑诺贝尔生理医学奖获得者奥托·瓦伯格(Otto Warburg)发现:相比于正常成熟细胞,肿瘤细胞以更高的效率、吸收更多的葡萄糖来产生能量和满足快速生长的需求;即使在供养充足的情况下,约80%的葡萄糖在肿瘤细胞也主要是通过有氧糖酵解途径产生ATP,伴随产生大量的乳酸,而不通过氧化磷酸化途径,此即著名的瓦伯格效应(Warburg effect,也称为有氧糖酵解 aerobic glycolysis)1。虽然瓦伯格效应早在上世纪20年代就已提出,但很长的一段时间里,肿瘤的基因调控学说占了主导地位(认为肿瘤是基因病),瓦伯格效应并没有得到重视。近二十年来,现代分子生物学技术的广泛应用极大地推动了肿瘤代谢领域的进展,越来越多的证据表明:肿瘤相关基因(致癌基因的激活或抑癌基因的丢失、灭活)、细胞微环境(低氧状态)、转录因子、非编码RNA、病毒感染等,以及代谢酶自身的突变或代谢调控蛋白的活性变化,均可导致肿瘤细胞的代谢重编程(metabolic reprogramming)。
瓦伯格效应的内涵也被进一步扩充,已经不再局限于糖酵解和三羧酸循环的改变(图1),脂肪酸代谢、谷氨酰胺代谢、丝氨酸代谢、一碳单位代谢、胆碱代谢等诸多代谢通路的改变,也被概括到瓦伯格效应中来,相信不久的将来会有更多的不曾受到关注的代谢分子/通路将成为肿瘤代谢中的重要成员。(Various unanticipated interrelations of metabolic alterations with cancer-driving pathways were identified and are awaiting translation into diagnosis and therapy of cancer.)代谢重编程已被视为肿瘤的重要特征之一2,其与肿瘤的发生发展互为因果。所以,肿瘤是一种基因病,也是一种代谢病。
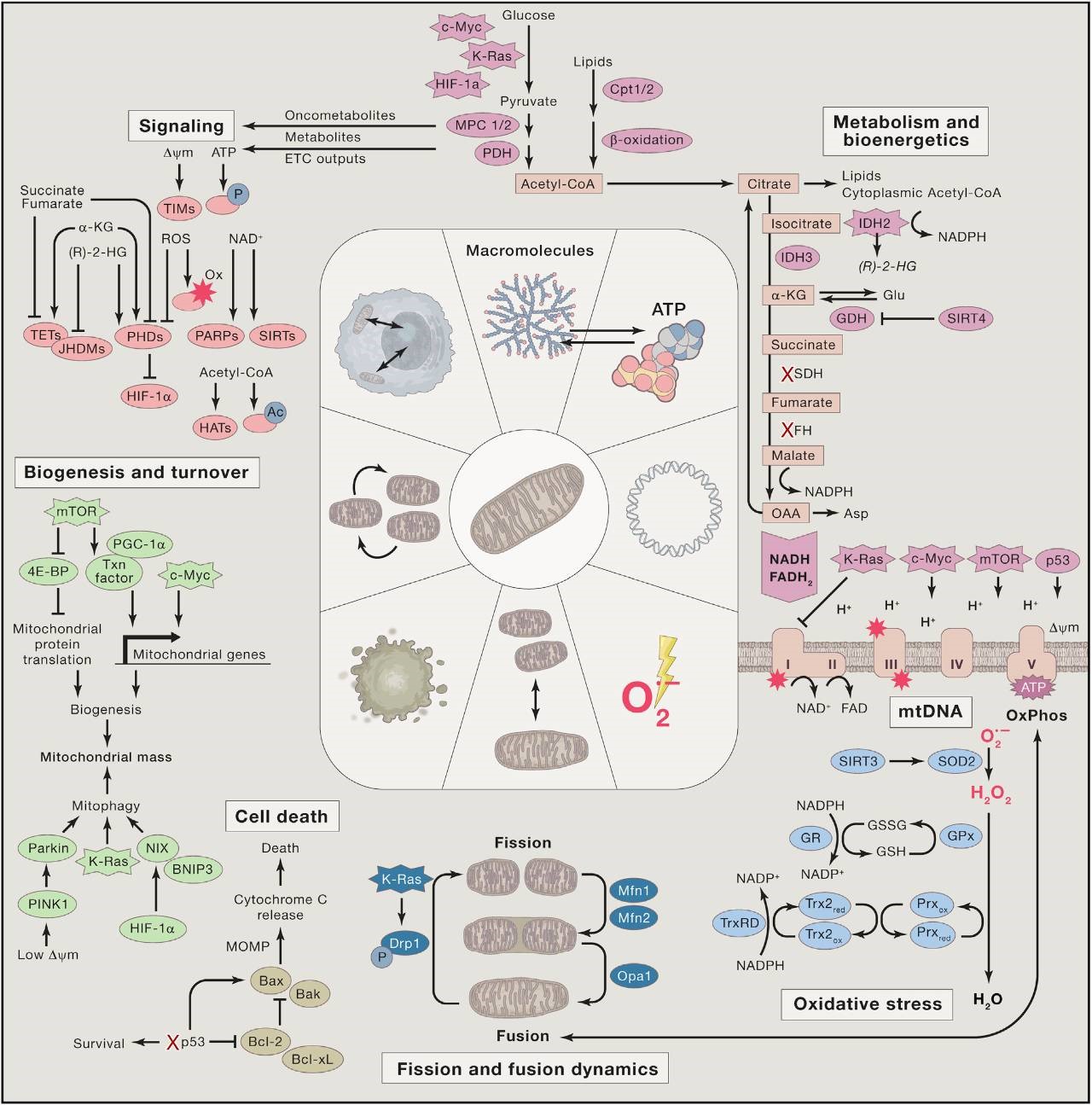
图1. 线粒体代谢与肿瘤3
代谢重编程与肿瘤的发生发展互为因果
肿瘤细胞通过重编程自身的代谢方式以满足其对能量、生物大分子的需求,以及氧化还原稳态的维持。肿瘤代谢异常既是肿瘤发生后信号通路改变引起的适应肿瘤增殖生长的结果,也是诱导肿瘤发生的上游信号源头(因)。三羧酸循环中的三个关键代谢酶——异柠檬酸脱氢酶(isocitrate dehydrogenase , IDH)4,5、琥珀酸脱氢酶(succinate dehydrogenase , SDH)6和延胡索酸水合酶(fumarate hydratase, FH)7突变可激活促癌信号通路,从而导致多种肿瘤的发生8。
一方面,肿瘤相关基因的突变造成了细胞内多条信号通路的改变,从而影响肿瘤细胞的代谢,并重塑肿瘤细胞,以增强其存活和生长能力——即信号转导通路调控代谢通路(Signaling pathways regulating cell metabolism),包括各种癌基因对肿瘤代谢的调控9(早已被广泛研究并接受,图2)。
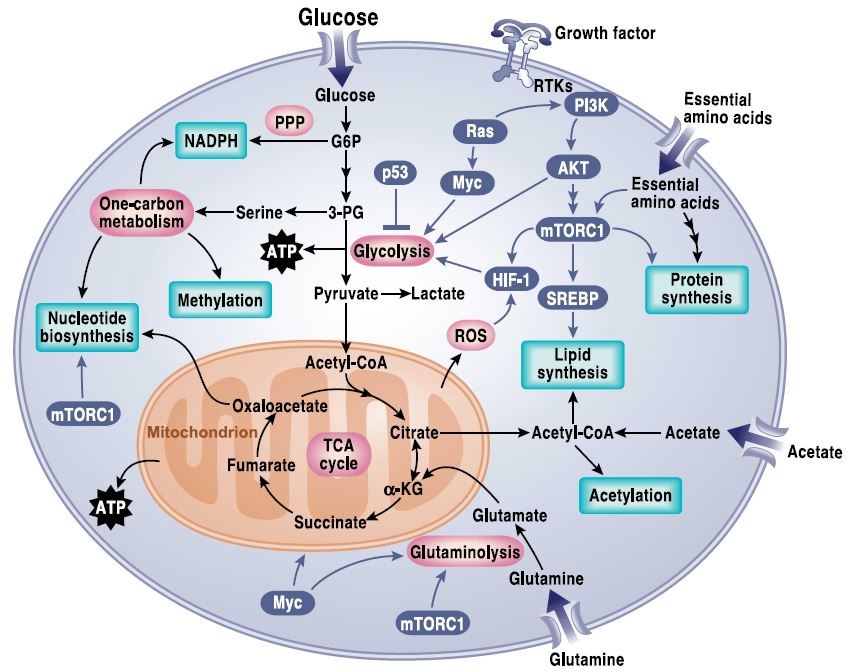
图2. Signaling pathways that regulate cancer metabolism.10
另一方面,越来越多的研究表明代谢通路也可以调控信号转导通路(Metabolism regulates cell signaling——新范式)。近年来,发现葡萄糖缺乏可促进KRAS野生型的细胞获得KRAS(及其信号通路分子)的突变,首次表明细胞代谢异常可以导致原癌基因突变;13C标记的丙酮酸分子影像技术在动物体内也表明:糖酵解的代谢改变先于c-Myc-诱导的肿瘤形成;此外,a-羟基戊二酸竞争性抑制多种a-酮戊二酸依赖的双加氧酶活性,进而诱发癌症。这些实验结果凸显了细胞代谢异常在肿瘤发生发展、治疗和预后中的重要作用,也完善了细胞代谢异常与肿瘤发生发展互为因果的概念。肿瘤细胞除了需要改变代谢的状态来应答癌基因信号通路传递的增殖信号之外,一些代谢酶的突变也可以直接导致肿瘤的发生(IDH1、SDH、FH等)。一些致癌代谢物(oncometabolite)不断被发现(如2-Hydroxyglutarate, Succinate, Fumarate, Succinylacetone)11;代谢物可以调控信号转导的观念也逐渐被接受(图3)。
举一个具体的例子来说明代谢通路与信号通路之间的交互作用(crosstalk between metabolism and signal transduction):缺氧诱导因子1(hypoxia-inducible factor 1, HIF-1)可结合于HRE元件而上调糖酵解途中代谢酶的表达,从而促进糖酵解;同时,代谢物丙酮酸和乳酸能抑制PHD活性从而增强HIF-1蛋白稳定性,进一步促进糖酵解。而糖异生代谢酶FBP1可以结合于HIF的抑制结构域,阻止其核转位,抑制其转录活性,从而抑制肿瘤发生12。In summary, signal transduction and metabolic pathways operate within an integrated network to cooperatively define cellular outcomes.

图3. Candidate Oncogenic Mechanisms of Succinate and Itaconate8.
Lorenzo Galluzzi和 Guido Kroemer认为肿瘤细胞的代谢重编程不应被视为恶性肿瘤的独立标志,而应视为肿瘤发生发展中紧密伴随的现象,与肿瘤发生的许多环节(甚至全部环节)都不可分割13。(The metabolic rewiring of neoplastic cells should not be considered as a self-standing hallmark of malignancy, but rather as a phenomenon that intimately accompanies, allows for and cannot be mechanistically separated from many, if not all, aspects of oncogenesis. )他们的主要依据如下:
(1) Several metabolic intermediates such as ATP, acetyl-CoA, a-ketoglutarate, and reactive oxygen species(ROS) play a major role in cell-intrinsic as well as cell-extrinsic signaling pathways.
(2) Multiple proteins with prominent metabolic functions such as cytochrome c (which operates as an electron shuttle in the mitochondrial respiratory chain) and the M2 isoform of pyruvate kinase (PKM2, which catalyzes the last step glycolysis) participate in signal transduction.
(3) Several proteins initially viewed as “pure” signal transducers including (but not limited to) the antiapoptotic Bcl-2 family members BCL-XL and MCL1 also impact on metabolic functions such as the handling of Ca2+ ions at the endoplasmic reticulum and the enzymatic activity of the F1F0 ATP synthase.
肿瘤细胞十大重要特征中的多个特征与其独特的代谢模式密切相关。肿瘤细胞为了更好地适应肿瘤生长环境中氧气供给的波动,提供肿瘤异常增殖分裂所需的原材料,抵抗氧化应激以及创造利于自己存活和转移的微环境,必须改变自己原来的代谢模式:
一是原料供给:肿瘤细胞特征之一是无限分裂增殖,这需要竞争体内有限的营养物质,为其提供ATP及合成蛋白质、脂类、核酸等生物大分子所需要的前体物质。糖酵解的代谢中间物,如6-磷酸果糖、3-磷酸甘油醛等的堆积,提供了合成这些生物大分子的前体物质;也使得与糖酵解通路相连的磷酸戊糖通路(PPP)获得更高的底物浓度,通路活性提高,所产生的戊糖是合成核酸的原料;产生的大量烟酰胺腺嘌呤二核苷酸磷酸(NADPH)则为脂肪酸的合成提供了底物,而脂肪酸是细胞膜的重要成份—磷脂的前体物质。氨基酸则依赖糖酵解中间代谢产物3-磷酸甘油醛等的合成。
二是抗氧化能力:PPP途径激活所产生的还原性的NADPH,保证了肿瘤细胞的抗氧化、抗细胞凋亡能力,对于控制细胞内活性氧(ROS)水平、耐受药物引起的氧化应激具有重要的意义。
三是微环境改造:糖酵解产生大量的乳酸分泌至细胞周围,酸性环境有利于肿瘤细胞的侵袭转移;同时乳酸作为能量供体,以旁分泌的方式维系营养缺乏肿瘤细胞的生长。
四是环境适应:肿瘤细胞常面临乏氧环境,依赖于线粒体的氧化磷酸化,则无法保证细胞生长所必需的ATP。而糖酵解不依赖于氧浓度的能量供给方式,使恶性增殖的肿瘤细胞具有更好的环境适应性。
五是产生排它效应:肿瘤细胞摄取大量葡萄糖的同时,使周围正常细胞的葡萄糖需求受到抑制,以类似进化的方法淘汰周围正常细胞,为自身争取到更大的生存环境、获取更多的营养物,以支持其恶性进展。
六是基因组不稳定性:DNA损伤应答反应(DNA damage response, DDR)对于维持基因组稳定性至关重要。已有糖代谢异常影响DNA损伤修复的综述14。2018年高大明团队揭示了mTORC1-S6K能量代谢途径通过抑制RNF168的功能来负调控DDR而造成基因组的不稳定,将细胞外生长信号与细胞内的DNA损伤修复/基因组稳定性联系起来13。
肿瘤代谢药物
代谢酶的异常包括:代谢酶自身的突变、代谢酶的蛋白质修饰(包括乙酰化、磷酸化、羟基化、泛素化和O-GcNAc糖基化等)、代谢酶的表观遗传调控等,改变了代谢酶的活性、蛋白稳定性、亚细胞定位、蛋白-蛋白相互作用,甚至产生新的非代谢功能来影响细胞的基因转录与信号通路。
举一个例:2017年8月1日美国FDA批准了Agios和Celgene公司共同开发的IDH2(异柠檬酸脱氢酶2)抑制剂AG-221(商品名为Enasidenib)用于复发性和难治性急性骨髓性白血病(AML)。Enasidenib也是第一个靶向肿瘤代谢治疗的药物,23%的病人有响应,中位持续时间高达8.2个月,每个月治疗费用高达25000美元。
Enasidenib是突变IDH2的首创抑制剂。IDH酶通常将异柠檬酸催化代谢成α-酮戊二酸。当IDH酶在癌症中突变时,它们也将α-酮戊二酸转化成2-羟基戊二酸,从而损害组蛋白去甲基化并最终导致细胞分化缺陷。在之前的一项关于enasidenib的临床试验中,研究人员招募了199名被诊断为带有IDH2突变的复发性/难治性AML患者。经研究表明,Idhifa为这类患者群体带来完全缓解(CR)和部分血液学改善的完全缓解率(CRh)为23%,中位数的缓解持续时间为8.2个月。(由于Enasidenib在临床试验表现出来的优异性,Agios公司2014年8月拿到了快速审批通道。)
自2009年Agios公司立项起,2013年迅速推入临床试验,4年后以迅雷不及掩耳之势被批准上市。凭借短短8年的研发时间也和诺华格列卫(伊马替尼)、辉瑞赛可瑞(克唑替尼)、强生/武田万珂(硼替佐米)并称为四大肿瘤传奇药物,一时间在学术界广为人知。
FDA同时批准了雅培的RealTime IDH2 Assay伴随诊断试剂盒。
细胞代谢如何调控细胞信号转导通路
1. 代谢酶的底物或(中间)产物可以参与信号转导调控。如富马酸16、衣康酸16、丙酮醛18、Succinylacetone (EMBO J, 2019)等通过对KEAP1蛋白的翻译后修饰激活NRF2信号通路。
此外,代谢物还可以调控肿瘤的表观遗传学19(图4-5)。
别构抑制、别构激活、反馈抑制?
ATP和ROS本身就是代谢物:能量?氧化还原稳态?微环境?pH?
Metabolites such as glucose, lactate, succinyl-CoA, acetyl-CoA and many others not only serve as intermediates in metabolic pathways, but also as second messengers affecting a range of cellular processes such as histone acetylation, protein glycosylation/ succinylation/ hydroxylation, redox homeostasis and the activity of various signaling pathway.
代谢物作为小分子配体参与免疫信号调控: SHMT2(Serine hydroxymethyltransferase 2,丝氨酸羟甲基转移酶2)是一碳代谢中的一个关键代谢酶,在氨基酸代谢以及核苷酸的合成过程中发挥重要作用。PLP(pyridoxal-5’-phosphate,维生素B6的活化形式)可以通过影响SHMT2二聚体和三聚体之间的转化来改变BRISC复合体的去泛素化酶活,最终参与到免疫信号的传导过程当中20。
杨巍维与李国辉课题组发现糖醛酸代谢通路中的尿苷二磷酸葡萄糖(UDP-Glc)与RNA结合蛋白HuR相互作用,竞争性抑制HuR对SNAI1 mRNA的稳定效应,从而抑制肺癌转移;EGFR信号激活可促使UGDH与HuR结合,并将UDP-Glc转化为UDP-GlcUA,从而解除了它对肺癌转移的抑制21。
代谢物(乳酸)还可以直接与蛋白(MAVS)结合,从而调控信号通路(详见图7)。
2. 代谢酶自身作为蛋白质直接参与信号转导调控。通过蛋白质相互作用,如M2型丙酮酸激酶(The M2isoform of pyruvate kinase,PKM2)对转录因子的调控22(图6)。而糖异生代谢酶FBP1可以结合于HIF的抑制结构域,阻止后者的核转位与转录活性。
Metabolic enzymes play much broader roles than currently understood.
脂代谢异常与肿瘤
增强的脂肪生成是肿瘤细胞的一个重要代谢特征。在胚胎生成过程中,脂肪酸的从头合成比较旺盛,但大多数成体细胞则是优先利用循环系统中的脂肪酸来合成功能性脂类。而对于肿瘤细胞而言,无论循环的脂肪酸是否充足,都有较多的内源性脂肪酸的合成。肿瘤细胞通过大量的合成脂类,一是促进细胞膜的形成,支持快速分裂;二是利用脂代谢中间产物或翻译后修饰,对增殖和生长信号通路进行正向调控。
肿瘤细胞通过大量的脂肪酸从头合成而获得新的膜结构,如:一些特殊的脂类成分形成脂筏结构,以促进细胞生长相关受体的活化;一些循环脂类则直接促进肿瘤细胞的生长和转移;一些脂类的中间产物如单酰辅酶A还参与了生长因子受体的转录调控。肿瘤细胞的脂肪酸从头合成还有助于产生参与调控原癌基因活性的脂类,如磷脂酰肌醇、磷脂酰丝氨酸、卵磷脂,它们在增殖、生长信号通路的激活和介导中具有重要作用,如P13K/AKT、Ras及Wnt等是肿瘤发生发展中的重要信号通路。
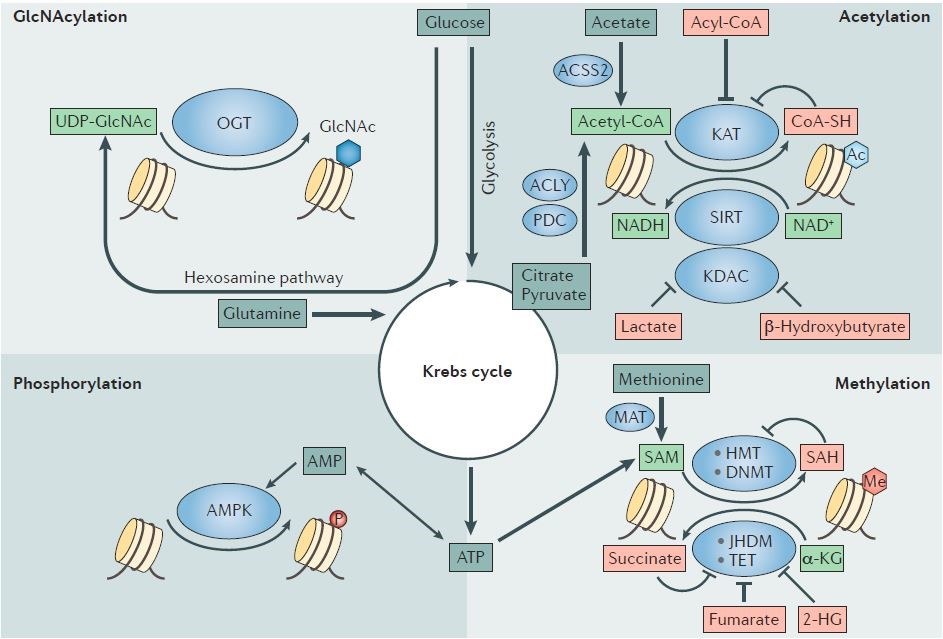
图4. Histone code writers require metabolites as ink to write epigenetic marks.

图5. 代谢与肿瘤表观调控之间的协作模式
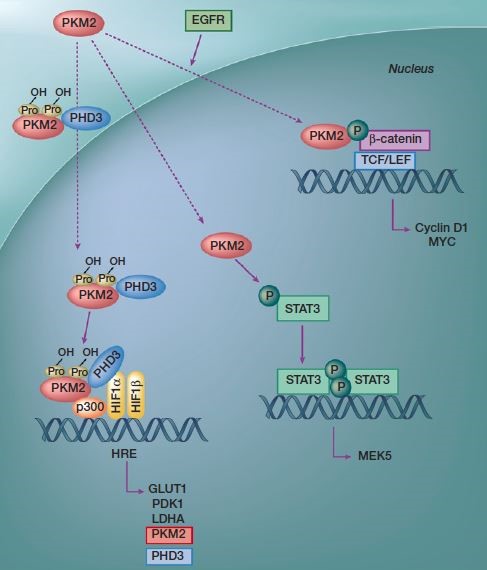
图6. PKM2的核内非糖酵解功能/非经典功能(调控基因转录)
线粒体与癌细胞之间的信号网络
线粒体生物学和肿瘤发生信号网络在多个层面上相互交叉3。
首先,经典的致癌和抑癌蛋白/信号通路可直接调控线粒体的功能。举个例子:著名的肿瘤抑制因子 p53,可以通过激活某些代谢基因的转录表达来调控细胞的代谢,限制糖酵解,驱动电子传递链的组装。在应对外界应激反应的过程中,p53 能够直接作用于线粒体而诱导细胞凋亡,这些都是它的肿瘤抑制作用。但是近年来的研究发现,p53也可以部分通过上调线粒体的脂肪酸氧化和呼吸作用来帮助细胞适应饥饿状态,从而帮助癌细胞存活。此外,还有 c-Myc、k-Ras、PI3K/Akt、AMPK 等等信号通路都会对线粒体的生物学功能产生重要的影响。
其次,从线粒体输出的信号也能够反过来影响细胞的功能和肿瘤发生。线粒体是重要的应激性感受器,发出的信号能够告诉细胞调整状态,适应它所处的环境变化。线粒体的代谢通路(例如三羧酸循环、β 氧化和电子传递链)所产生的代谢产物,能够通过染色质修饰和细胞质中的信号通路影响核基因的重塑,调控染色质的状态。另外,细胞对线粒体完整性的感知也是线粒体发出的重要调控信号,使细胞可以及时应对不健康/功能异常的线粒体所带来的危害。例如,正常线粒体产生的膜电势是蛋白质转运复合体进入线粒体基质和膜间隙必须的,膜电势的消失会影响蛋白转运,因此,如果蛋白转运缺陷非常严重,就会引发线粒体自噬去清除这些功能失常的线粒体。
最后,线粒体中某些发生突变的酶能够催化产生致癌代谢物,增强对染色体结构的影响,促进细胞癌变的发生。例如,癌细胞三羧酸循环中琥珀酸脱氢酶和延胡索酸水化酶因突变而丧失活性,会积累过量的琥珀酸和延胡索酸,从而起到稳定致癌蛋白转录因子的作用,使得这两种致癌代谢物的异常积累成为遗传性副神经节瘤综合征、遗传性平滑肌瘤综合征和肾细胞癌综合征的致病原因。
代谢性疾病与肿瘤
早在1959年,乔斯林(Elliott P. Joslin)等就报道了同时患有肿瘤和糖尿病的问题。2009年美国糖尿病学会和美国癌症协会联合发布公告:2型糖尿病(T2DM)与多种癌症的发生风险增高有关。德国癌症研究中心对125126 名因T2DM住院治疗的患者进行了T2DM与癌症危险关系的大型研究,发现在T2DM患者中,发病率增高的癌症有24种,其中胰腺癌和肝细胞癌最明显,结直肠癌、子宫内膜癌、乳腺癌也有较多报道和研究。此后多项大规模流行病学研究均发现糖尿病患者罹患恶性肿瘤的概率升高;且与无糖尿病的肿瘤患者相比,糖尿病、糖耐量异常的肿瘤患者预后更差,死亡风险增加。有流行病学研究了某医院17年确诊的胰腺癌患者,在确诊前2年内诊断有糖尿病的患者达76.4%;对糖尿病干预时,胰腺癌的诊断至少要推迟5年。提示糖尿病可能为胰腺癌的早期表现。但也有观点认为,糖代谢异常是胰腺癌的后果。临床上对糖代谢异常的患者进行长期的监测和筛查,可能提高胰腺癌的早期诊断率。此外,糖代谢、脂代谢、氨基酸代谢、肝肠循环稳态与肝癌密切相关。血清中异亮氨酸和亮氨酸等支链氨基酸含量高的人群,胰腺癌发病风险升高2倍以上。
糖代谢异常在肿瘤发生发展中的作用机制,除了前面介绍的高血糖的直接刺激、胰岛素抵抗及高胰岛素血症、胰岛素/IGFs轴之外,还包括:糖尿病自主神经病变、微血管病变及免疫功能受损、慢性炎症和氧化应激、肥胖和脂肪细胞因子(瘦素、脂联素、内皮素、TNF-α、IL-6、IL-17、VEGF、尿激酶型纤溶酶原激活物等)、血浆c肽水平、性激素、微量元素如铬、锌、锰、硒、镁、铁等的异常、遗传因素等。而恶性肿瘤侵袭或远处转移导致胰岛β细胞破坏又可并发或加重糖尿病,并形成恶性循环。值得注意的是,长期用抗糖尿病药二甲双胍(Metformin) 治疗的糖尿病患者,其肿瘤发病率明显降低。二甲双胍能降低血糖和胰岛素水平,可能与它影响线粒体功能及调节LKB1/AMPK信号通路有关。二甲双胍还可以抑制AMPK/P27信号轴,阻滞PCK1-KO细胞G1/S期转换,从而抑制肝癌细胞增殖。
对代谢性疾病与肿瘤关系的深入研究,有利于深入认识代谢与肿瘤的因果关系,对肿瘤的预防和提高早期诊断率具有重要的临床价值。
病毒感染与代谢重塑
病毒的生命活动很特殊,对细胞有绝对的依存性。其存在形式有二,一是细胞外形式,一是细胞内形式。病毒存在于细胞外环境中时,不显复制活性,但保持感染活性,是病毒体或病毒颗粒形式(可结晶)。病毒与缺乏复制所需的基本代谢机制的寄生虫相似,为了解决生存的基本问题,病毒进入宿主细胞内则解体而释放出核酸分子(DNA或RNA),通过操控/劫持宿主细胞代谢来获取复制、装配所需要的能量及物质原材料,借细胞内环境的条件以其独特的生命活动体系进行复制(增殖)。
曹雪涛课题组发现宿主细胞通过削弱ALKBH5的去甲基化活性积极地对病毒感染作出反应,这会导致增加的OGDH mRNA衰减和下降的OGDH蛋白表达,从而对细胞代谢状态进行重编程而使得宿主对病毒感染产生不依赖于IFN-I的抵抗力。下降的OGDH表达限制了三羧酸循环并减少病毒复制所需的衣康酸的产生,因而限制了宿主细胞中的病毒感染。他们认为m6A RNA修饰和代谢重塑之间通过ALKBH5-OGDH-衣康酸途径进行的交谈对细胞通过与先天反应无关的代谢重塑抵御入侵的病原体提供了机制上的新见解。(Science论文“N6-methyladenosine RNA modification–mediated cellular metabolism rewiring inhibits viral replication”)
天然免疫过程中I型干扰素(IFN)的产生在机体抗病毒感染以及肿瘤免疫监视过程中均发挥至关重要的作用。当病毒入侵机体或细胞内异常的核酸物质暴露时,体内相应的上皮细胞或免疫细胞通过其模式识别受体 (PRRs,pattern recognition receptors)(主要包括RLRs、STING 和TLRs等)结合相关模式分子(PAMPs,pathogen-associated molecular patterns),启动一系列免疫级联反应,产生I型干扰素(IFN)和其他细胞因子,帮助机体清除病原或者激活肿瘤免疫系统。
RNA病毒或细胞内异常存在的短链RNA通常被细胞内的RLRs(RIG-I-like receptors)探测识别,RLRs进而发生构象改变并被招募到线粒体外膜,与关键蛋白MAVS形成中央平台,继续传递信号给下游分子,促使TBK1和IKK激酶活化并磷酸化转录因子IRF3和NF-κB ,最终导致下游IFN和其他关键因子的表达。基于I型IFN在机体抗病毒免疫和抗肿瘤免疫反应中的重要作用,近年来,相关领域的科学家深入探索RLRs信号通路的调控机制,并发掘出一系列调节该通路的关键分子。
糖代谢是细胞内能量代谢的最主要方式。葡萄糖进入细胞后,在己糖激酶(Hexokinase,HK)等的催化作用下通过糖酵解代谢成丙酮酸。丙酮酸既可以进入线粒体参与三羧酸 (TCA) 循环和氧化磷酸化,亦可在无氧条件下由乳酸脱氢酶 (LDH) 催化产生乳酸。近年来,尽管已有一些证据表明,细胞内糖代谢与机体内一些免疫细胞如巨噬细胞、T细胞的功能调控密切相关.
林慧宽教授团队发现机体糖代谢过程和先天免疫RLRs信号通路的重要交互调控,鉴定出此过程中乳酸在细胞内的感应分子-MAVS23。先天免疫的关键接头蛋白MAVS能够结合糖酵解重要限速酶-HK2,且该结合在RLRs通路激活时被RIG-I破坏。通过靶向抑制乳酸生成过程,能够有效促进I型IFN产生和RNA病毒清除。
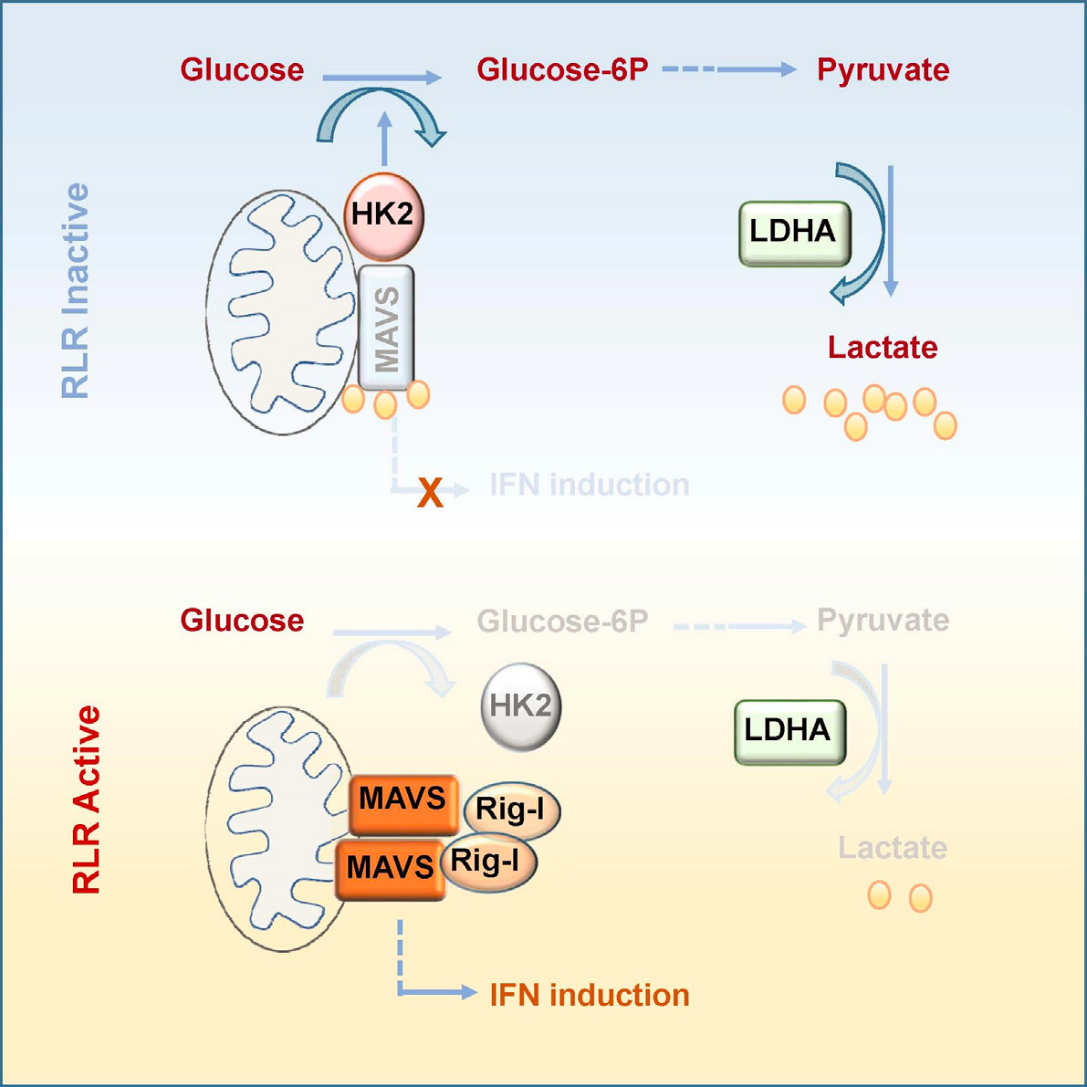
图7. 乳酸靶向MAVS蛋白抑制先天免疫RLR通路
黄灿华与雷群英教授团队发现糖酵解代谢酶在HPV诱导宫颈癌发生发展中的作用:糖酵解代谢酶LDHA(乳酸脱氢酶,lactate dehydrogenase A)通过感应细胞内ROS水平发生细胞核迁移,入核后获得非经典的代谢酶活性(催化α-酮丁酸到α-羟基丁酸,α-Hydroxybutyrate),并使得细胞核内的α-羟基丁酸积累,上调组蛋白H3K79三甲基化水平,表观调控Wnt信号通路的激活及细胞抗氧化相关基因的表达,从而促进宫颈癌细胞在氧化应激下的生存24。
HPV编码的癌基因E6引起宿主细胞O-GlcNAc转移酶(OGT)显著增高,c-MYC蛋白O-GlcNAc糖基化修饰水平升高,并增强c-MYC蛋白的稳定性,促进宫颈癌发生25。免疫细胞中葡萄糖代谢的增加不仅是急性炎症的标志性特征,而且还深刻地影响细菌感染和组织损伤后的疾病进程。Haitao Wen实验室发现水疱性口炎病毒(VSV)感染巨噬细胞后会增强己糖胺生物合成途径(hexosamine biosynthesis pathway,HBP)的代谢流量和下游MAVS蛋白的O-GlcNAc修饰(O-GlcNAcylation),证实HBP在抗病毒先天免疫中的重要作用26。此外,HCV27、HIV-128、HTLV-129、KSHV30、HSV31、HBV32等病毒都与宿主细胞O-GlcNAc修饰有关。
肿瘤代谢领域的重要科学问题
1. 探索代谢异常引发肿瘤的机制:代谢通路如何调控信号转导通路?代谢酶的改变和(或)特异的细胞代谢产物(或中间产物)影响哪些信号通路;其产生的蛋白质翻译后修饰;其导致的组蛋白甲基化/乙酰化、DNA甲基化等表观遗传改变;引起的基因组不稳定性等,是如何作用于特定的基因而导致肿瘤的发生?其对肿瘤干细胞的影响及其分子机制如何?肿瘤细胞如何感受营养状态并协调基因表达?代谢异常与NASH-HCC的关系?开发以代谢为靶标的代谢抑制性抗肿瘤药物。
2. 肿瘤代谢重编程的调控:包括原癌基因、抑癌基因对代谢的调控及其机制;生长信号改变与代谢异常的调控;代谢异常与自噬的关系;病毒感染对肿瘤代谢重编程的调控;炎症微环境在肿瘤代谢重编程中作用;肿瘤代谢异常与肿瘤放、化疗治疗的敏感性、抵抗与逆转。
(解析肿瘤细胞为什么代谢异常:染色体和染色质水平上的结构变化如DNA甲基化、转录水平调控、RNA水平如剪接和修饰转运、蛋白质翻译、酶的翻译后修饰、酶的稳定性、酶活力的调节、酶的辅助因子、酶的定位… …酶合成量的调节:底物对酶合成的诱导/阻遏,激素)
3. 肿瘤代谢组/代谢流研究:利用质谱等技术绘制出肿瘤的代谢图谱,尤其是比较肿瘤组织与正常组织、不同分期的同类肿瘤、不同肿瘤组织之间的代谢谱的差异,对肿瘤预防、早期诊断、预后判断和个体化治疗提供新的标志物。
4. 基于肿瘤代谢异常的分子靶点:基于肿瘤代谢酶异常的调控机制,发现代谢异常与肿瘤发生发展调控网络中的关键节点分子,并在临床肿瘤标本中加以验证,进一步确定其临床意义,研究其作为代谢干预靶点的可行性,针对所确定的关键靶点设计相应的代谢靶向干预策略。
5. 代谢性疾病与肿瘤之间的关系:肥胖、糖尿病中重要代谢调控因素(分子)在肿瘤发生发展中的作用及其机制;肠道稳态在肿瘤发生发展中的意义及其机制;肿瘤病人的治疗过程应该如何调控机体整体代谢?
参考文献:
1. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg Effect: The Metabolic Requirements of Cell Proliferation. Science. 2009;324(5930):1029-1033. doi:10.1126/science.1160809
2. Hanahan D, Weinberg RA. Hallmarks of Cancer: The Next Generation. Cell. 2011;144(5):646-674. doi:10.1016/j.cell.2011.02.013
3. Vyas S, Zaganjor E, Haigis MC. Mitochondria and Cancer. Cell. 2016;166(3):555-566. doi:10.1016/j.cell.2016.07.002
4. Zhao S, Lin Y, Xu W, et al. Glioma-Derived Mutations in IDH1 Dominantly Inhibit IDH1 Catalytic Activity and Induce HIF-1α. Science. 2009;324(5924):261-265. doi:10.1126/science.1170944
5. Xu W, Yang H, Liu Y, et al. Oncometabolite 2-Hydroxyglutarate Is a Competitive Inhibitor of α-Ketoglutarate-Dependent Dioxygenases. Cancer Cell. 2011;19(1):17-30. doi:10.1016/j.ccr.2010.12.014
6. Pollard PJ, Brière JJ, Alam NA, et al. Accumulation of Krebs cycle intermediates and over-expression of HIF1alpha in tumours which result from germline FH and SDH mutations. Hum Mol Genet. 2005;14(15):2231-2239. doi:10.1093/hmg/ddi227
7. King A, Selak MA, Gottlieb E. Succinate dehydrogenase and fumarate hydratase : linking mitochondrial dysfunction and cancer. Oncogene. 2006;25(34):4675. doi:10.1038/sj.onc.1209594
8. Yang M, Soga T, Pollard PJ. Oncometabolites: linking altered metabolism with cancer. J Clin Invest. 2013;123(9):3652-3658. doi:10.1172/JCI67228
9. Nagarajan A, Malvi P, Wajapeyee N. Oncogene-Directed Alterations in Cancer Cell Metabolism. Trends in Cancer. 2016;2(7):365-377. doi:10.1016/j.trecan.2016.06.002
10. DeBerardinis RJ, Chandel NS. Fundamentals of cancer metabolism. Science Advances. 2016;2(5):e1600200-e1600200. doi:10.1126/sciadv.1600200
11. Zhou Z, Ibekwe E, Chornenkyy Y. Metabolic Alterations in Cancer Cells and the Emerging Role of Oncometabolites as Drivers of Neoplastic Change. Antioxidants. 2018;7(1):16. doi:10.3390/antiox7010016
12. Li B, Qiu B, Lee DSM, et al. Fructose-1,6-bisphosphatase opposes renal carcinoma progression. Nature. 2014;513(7517):251-255. doi:10.1038/nature13557
13. Galluzzi L, Kroemer G. Preface: Oncometabolism: A New Field of Research with Profound Therapeutic Implications. In: Galluzzi L, Kroemer G, eds. Methods in Enzymology. Vol 542. Conceptual Background and Bioenergetic/Mitochondrial Aspects of Oncometabolism. Academic Press; 2014:xix-xxiii. doi:10.1016/B978-0-12-416618-9.10000-7
14. Leshets M, Silas YBH, Lehming N, Pines O. Fumarase: From the TCA cycle to DNA damage response and tumor suppression. Frontiers in molecular biosciences. 2018;5:68.
15. Xie X, Hu H, Tong X, et al. The mTOR–S6K pathway links growth signalling to DNA damage response by targeting RNF168. Nature cell biology. 2018;20(3):320.
16. Adam J, Hatipoglu E, O’Flaherty L, et al. Renal Cyst Formation in Fh1-Deficient Mice Is Independent of the Hif/Phd Pathway: Roles for Fumarate in KEAP1 Succination and Nrf2 Signaling. Cancer Cell. 2011;20(4):524-537. doi:10.1016/j.ccr.2011.09.006
17. Mills EL, Ryan DG, Prag HA, et al. Itaconate is an anti-inflammatory metabolite that activates Nrf2 via alkylation of KEAP1. Nature. 2018;556(7699):113-117. doi:10.1038/nature25986
18. Bollong MJ, Lee G, Coukos JS, et al. A metabolite-derived protein modification integrates glycolysis with KEAP1–NRF2 signalling. Nature. 2018;562(7728):600-604. doi:10.1038/s41586-018-0622-0
19. Kinnaird A, Zhao S, Wellen KE, Michelakis ED. Metabolic control of epigenetics in cancer. Nature Reviews Cancer. 2016;16(11):694-707. doi:10.1038/nrc.2016.82
20. Walden M, Tian L, Ross RL, et al. Metabolic control of BRISC–SHMT2 assembly regulates immune signalling. Nature. 2019;570(7760):194-199. doi:10.1038/s41586-019-1232-1
21. Wang X, Liu R, Zhu W, et al. UDP-glucose accelerates SNAI1 mRNA decay and impairs lung cancer metastasis. Nature. June 2019. doi:10.1038/s41586-019-1340-y
22. Tamada M, Suematsu M, Saya H. Pyruvate Kinase M2: Multiple Faces for Conferring Benefits on Cancer Cells. Clinical Cancer Research. 2012;18(20):5554-5561. doi:10.1158/1078-0432.CCR-12-0859
23. Zhang W, Wang G, Xu Z-G, et al. Lactate Is a Natural Suppressor of RLR Signaling by Targeting MAVS. Cell. May 2019. doi:10.1016/j.cell.2019.05.003
24. Liu Y, Guo J-Z, Liu Y, et al. Nuclear lactate dehydrogenase A senses ROS to produce α-hydroxybutyrate for HPV-induced cervical tumor growth. Nature Communications. 2018;9(1). doi:10.1038/s41467-018-06841-7
25. Zeng Q, Zhao R-X, Chen J, et al. O-linked GlcNAcylation elevated by HPV E6 mediates viral oncogenesis. Proceedings of the National Academy of Sciences. 2016;113(33):9333-9338. doi:10.1073/pnas.1606801113
26. Li T, Li X, Attri KS, et al. O-GlcNAc Transferase Links Glucose Metabolism to MAVS-Mediated Antiviral Innate Immunity. Cell Host & Microbe. 2018;24(6):791-803.e6. doi:10.1016/j.chom.2018.11.001
27. Herzog K, Bandiera S, Pernot S, et al. Functional microRNA screen uncovers O-linked N-acetylglucosamine transferase as a host factor modulating hepatitis C virus morphogenesis and infectivity. Gut. May 2019:gutjnl-2018-317423. doi:10.1136/gutjnl-2018-317423
28. Jochmann R, Thurau M, Jung S, et al. O-Linked N-Acetylglucosaminylation of Sp1 Inhibits the Human Immunodeficiency Virus Type 1 Promoter. J Virol. 2009;83(8):3704-3718. doi:10.1128/JVI.01384-08
29. Groussaud D, Khair M, Tollenaere AI, et al. Hijacking of the O-GlcNAcZYME complex by the HTLV-1 Tax oncoprotein facilitates viral transcription. PLOS Pathogens. 2017;13(7):e1006518. doi:10.1371/journal.ppat.1006518
30. Jochmann R, Pfannstiel J, Chudasama P, Kuhn E, Konrad A, Stürzl M. O-GlcNAc transferase inhibits KSHV propagation and modifies replication relevant viral proteins as detected by systematic O-GlcNAcylation analysis. Glycobiology. 2013;23(10):1114-1130. doi:10.1093/glycob/cwt028
31. Angelova M, Ortiz-Meoz RF, Walker S, Knipe DM. Inhibition of O-Linked -N-Acetylglucosamine Transferase Reduces Replication of Herpes Simplex Virus and Human Cytomegalovirus. Longnecker RM, ed. J Virol. 2015;89(16):8474-8483. doi:10.1128/JVI.01002-15
32. Jie Hu, Qingzhu Gao, Yang Yang, Jie Xia, et al. Hexosamine biosynthetic pathway promotes the antiviral activity of SAMHD1 by enhancing O-GlcNAc transferase-mediated protein O-GlcNAcylation. Theranostics, 2021, 11(2):805-823.
Further Reading:
https://m.sciencenet.cn/blog-446272-1302942.html
上一篇:新冠病毒SARS-CoV-2大流行中跨系重组体(inter-lineage recombinants)的产生和传播
下一篇:适应性免疫在清除新冠病毒和保护感染中的作用Correlate of protection from SARS-CoV-2