博文
血清磷对疾病和普通人群的潜在影响(2):回到基础
|
无机磷酸盐对多种细胞过程至关重要,如能量代谢、骨形成和生物分子(包括磷脂和核酸)的合成。然而,升高的血清磷(以无机磷酸盐的形式)已成为血管钙化等的关键风险因素。
血清磷对疾病和普通人群的潜在影响(1):回到基础
https://blog.sciencenet.cn/blog-526326-1325776.html
3. 高磷血症与疾病
3.1 磷酸盐对血管钙化(Vascular calcification,VC)发展和进展的影响
3.2 磷酸盐对普通人群、CKD和糖尿病心血管疾病和预后的影响
3.3 磷对非糖尿病和糖尿病CKD发展和进展的影响
3.4 骨质疏松症和慢性肾脏疾病矿物质和骨骼疾病
3.5 继发性甲状旁腺功能亢进
3.6 钙磷遗传性代谢紊乱的分子基础
3. 高磷血症与疾病
3.1 磷酸盐对血管钙化(Vascular calcification,VC)发展和进展的影响
无机矿物在各种生物细胞内外的形成和沉积称为生物矿化。硬组织(如骨或牙本质)中的生物矿化通常被认为是一个生理过程;然而,软组织(如血管、关节和内部器官,包括肌肉、肝脏或大脑)中无机矿物的积累被认为是病理性或异位生物矿化。在正常情况下,软组织不会矿化,但由于老化和其他病理条件,软组织会钙化,从而导致发病率和死亡率。在矿化脊椎动物结缔组织中发现的主要生物矿物是磷酸钙盐【4】。
心血管结构的病理性钙化或血管钙化与多种疾病(如遗传病、糖尿病和慢性肾病)有关,是衰老的常见后果【4】。血管钙化,即磷酸盐钙晶体在心血管系统上的沉积,主要在血管、心肌和心脏瓣膜中,是决定全世界患者发病率和死亡率的最重要因素之一。在血管中,钙化沉积物存在于主动脉壁的不同层中,并与特定的病理学相关。内膜钙化发生在动脉粥样硬化病变中,与血管平滑肌细胞和巨噬细胞相关【17】;而内侧钙化(所谓的“蒙克伯格内侧硬化”)发生在主动脉壁的中间层,与胶原/弹性蛋白纤维和血管平滑肌细胞有关【18】。 关于血管钙化的发病机制,已经提出了不同的机制,包括(1)抑制丧失,(2)钙和磷稳态,(3)血管细胞的骨软骨分化,(4)凋亡,(5)循环成核复合物/旁分泌因子,以及(6)基质降解。由此可见钙和磷稳态很关键(图9. https://blog.sciencenet.cn/blog-526326-1325776.html)【4】。
无机磷酸盐对多种细胞过程至关重要,如能量代谢、骨形成和生物分子(包括磷脂和核酸)的合成。然而,升高的血清磷(以无机磷酸盐的形式)已成为血管钙化的关键风险因素。体外实验表明,在高磷酸盐浓度下培养的血管平滑肌细胞中有磷酸钙沉积【19】。这一观察结果首先被解释为磷酸盐转运增加的结果,随后细胞内磷酸盐浓度增加。然而,一些研究表明,磷酸盐转运体饱和于正常的血清磷酸盐水平。此外,更多的研究表明,磷酸钙晶体的形成是一个被动的物理化学过程,不需要任何细胞活动,这表明磷酸盐稳态的重要作用(图5. https://blog.sciencenet.cn/blog-526326-1325776.html )。值得注意的是,在磷酸盐诱导的血管钙化中,血管平滑肌细胞的命运有两个主要后果。第一个涉及凋亡依赖性基质矿化,在培养的人类血管平滑肌细胞和儿科透析患者的动脉中都检测到这种矿化【20】。第二种是向成骨表型的深刻转变。为了支持这一观点,体外研究表明,高磷酸盐导致骨软骨生成标记物(如BMP-2和Runx2/Cbfa1,一种诱导骨基质主要成分表达的转录因子)的表达。然而,最近的研究表明,磷酸钙沉积可诱导血管平滑肌细胞和主动脉壁向成骨表型的转变和凋亡,表明所述的活性机制可能是对磷酸钙晶体过度形成和沉积的反应【4,18,21】。
在脊椎动物中,血浆和其他细胞外液被磷酸盐和钙过饱和,导致自发的磷酸钙沉淀【18】。因此,磷酸钙沉积抑制剂的合成对生存至关重要,包括焦磷酸盐(PPi)和几种蛋白质(如基质Gla蛋白、胎球蛋白A和骨桥蛋白)【17】。 基质Gla蛋白是一种矿物质结合的细胞外基质蛋白,主要由血管平滑肌细胞和软骨细胞合成,是第一种在体外和体内被认为是血管钙化抑制剂的蛋白质【22】。基质Gla蛋白含有几种维生素K依赖性羧化/γ-羧基谷氨酸(Gla)氨基酸残基,这些残基负责钙离子的高亲和力结合。值得注意的是,基质Gla蛋白缺陷小鼠表现出动脉和软骨的自发钙化,一些研究报告了尿毒症、糖尿病、动脉粥样硬化和高血压患者血浆基质Gla蛋白与血管钙化之间的可能关联。胎球蛋白A是一种循环血浆糖蛋白,也具有结合钙的能力,并具有抗炎特性。值得注意的是,胎球蛋白A基因敲除小鼠自发地在心脏、血管、肾脏、睾丸和皮肤上形成软组织钙化。然而,血清胎球蛋白-A水平与血管钙化之间的关系尚不清楚【23】。骨桥蛋白是一种富含唾液酸的糖蛋白,首先从骨骼中纯化,是一种已知的非胶原骨基质蛋白,可调节钙化。与基质Gla蛋白一样,骨桥蛋白也在骨发育和重塑过程中调节钙化。此外,人主动脉和冠状动脉粥样硬化斑块中的巨噬细胞、平滑肌和内皮细胞也表达骨桥蛋白。然而,骨桥蛋白mRNA水平的上调与血管钙化无关,这表明骨桥蛋白可能不是钙化所必需的。此外,一些研究表明骨桥蛋白不是主动脉壁钙化的内源性抑制剂【4】。
另一方面,细胞外焦磷酸盐是体外和体内磷酸钙晶体形成和生长的主要内源性物理化学抑制剂。细胞外焦磷酸盐通过与新生羟基磷灰石晶体的亲和结合发挥作用,在微摩尔浓度下完全抑制【18】,比生理性钙或磷酸盐浓度低1000倍以上。细胞外焦磷酸盐的含量足以完全阻止羟基磷灰石形成生理性钙或磷酸盐浓度。然而,由于缺乏抑制能力,细胞外焦磷酸盐合成的丧失或血浆磷酸盐浓度的增加(高磷血症)导致血管钙化【24】。例如,研究表明,在早衰小鼠模型中,标准血液透析后血浆焦磷酸盐减少。因此,一些研究表明,每天注射外源性焦磷酸盐可预防实验大鼠和小鼠模型的内侧血管钙化,包括早衰和肾功能衰竭。值得注意的是,增加内源性细胞外焦磷酸盐合成的几种治疗策略可防止早衰小鼠主动脉壁中层发现的过度血管钙化【25】。因此,焦磷酸盐缺乏是血管钙化的关键风险因素【26】,表明焦磷酸盐内稳态和细胞外焦磷酸盐代谢在血管钙化中起着重要作用(图10)。因此,了解参与细胞外焦磷酸盐代谢的酶和转运体的作用可以为预防血管钙化提供潜在的未来治疗靶点【4】。

图10 提出了不同巨噬细胞亚型在动脉粥样硬化斑块钙化中的作用。
经典巨噬细胞(VSMC)中诱导组织非特异性碱性磷酸酶(TNAP)表达。此外,巨噬细胞(M2巨噬细胞)的存在可诱导血管平滑肌细胞表达外核苷三磷酸二磷酸水解酶1(eNPP1)。Pi:磷酸盐;PPi:焦磷酸盐。
钙化是动脉粥样硬化的常见并发症,涉及主动脉平滑肌细胞、单核细胞浸润和动脉壁内巨噬细胞积聚【M1巨噬细胞)和替代巨噬细胞(M1巨噬细胞促进炎症、抑制细胞增殖并导致组织损伤,而/血管平滑肌细胞体外共培养系统中,巨噬细胞通过诱导表型变化(包括基质矿化和D受体激活剂(骨化三醇和帕里骨化醇)促进巨噬细胞10)【4】。
在最近的一项研究【27】中,作者表明M2巨噬细胞也具有抗钙化特性,这主要是因为它们合成细胞外焦磷酸盐的能力增强。与M1巨噬细胞相比,M2巨噬细胞通过增加eNPP1的表达和活性释放更多ATP并增加焦磷酸盐的合成。此外,血管平滑肌细胞与M2巨噬细胞共培养可增加血管平滑肌细胞中eNPP1的表达和活性。相比之下,血管平滑肌细胞与M1巨噬细胞的共培养增加了血管平滑肌细胞中TNAP的表达和活性【27】。另一项研究还表明,高磷血症可以激活巨噬细胞,形成一种不同的新巨噬细胞类型【28】。磷酸盐诱导的巨噬细胞(MPi)表达M2标记物,并具有与M2巨噬细胞相似的活性,包括通过精氨酸酶1降解精氨酸、更高的代谢活性和增加的抗氧化剂生成(图10)。因此,与M2巨噬细胞一样,MPi巨噬细胞也通过增加细胞外焦磷酸盐的利用率而具有抗钙化特性。相比之下,动脉粥样硬化病变中的磷酸钙晶体,包括羟基磷灰石,可以诱导巨噬细胞极化为M1巨噬细胞[91]。这些发现表明,在动脉粥样硬化斑块的钙化过程中涉及两个不同的环境和步骤,类似于在中间钙化过程中也发现的两个步骤【18】。然而,还需要进一步深入研究【4】。
血管平滑肌细胞的表型转化是VC过程中的一个关键事件,外泌体在其中起着重要作用。在正常生理条件下,血管平滑肌细胞(VSMC)表现出收缩表型,并通过主动释放含有内源性钙化抑制剂的外体来调节微环境稳态,如胎球蛋白a、基质Gla蛋白(MGP)、骨保护素(OPG)和骨形态发生蛋白-7(BMP-7),从而抑制心血管(CV)疾病的发生。然而,在机械损伤、氧化应激、细胞凋亡和磷代谢紊乱等病理因素的刺激下,血管平滑肌细胞转化为合成表型,成骨分化的相关因素被激活,如OPN、骨钙素(OCN)、骨形态发生蛋白-2(BMP-2)、ALP、,因此,促进细胞转化为具有与成骨细胞相关特征的成骨细胞/软骨样表型。钙化外显体的释放随着MGP和胎球蛋白-A的消耗以及由磷脂酰丝氨酸(PS)和膜联蛋白组成的蛋白质-脂质复合物的富集而增加。蛋白质-脂质复合物通过提供矿物质成核位点将外质体转化为钙化病灶。矿物质沉积和钙化是通过钙化的外体与ECM中的弹性蛋白和胶原纤维相互作用形成的,这促进了VC的发生。 研究表明,外质体参与启动矿物质沉积、促进VSMC表型转化、介导miRNA转运、自噬和氧化应激反应等过程,从而调节VC的过程(图11)【29】。

图11 外泌体促进细胞外矿物质沉积,并在细胞间运输microRNA以诱导VC。
3.2 磷酸盐对普通人群、CKD和糖尿病心血管疾病和预后的影响
磷过量可能会导致严重的不良医疗后果。最明显的是对心血管(CV)疾病的影响,主要通过磷酸盐改变血管平滑肌细胞表型的能力及其对病理性血管、瓣膜和其他软组织钙化的贡献。慢性肾病(CKD)是最常见的慢性病,表现为磷酸盐稳态的持续紊乱。糖尿病及其引发的糖尿病肾病(DKD)仍然是全世界CKD和终末期肾病(ESRD)的主要病因(图12)【1】。CKD-MBD)是一种严重的矿物质代谢紊乱,在疾病过程中发展,对骨骼健康和心血管系统产生不利影响(图12)。
DKD通常被认为是CKD和ESRD的主要病因【30】。心血管疾病(CVD)是CKD患者死亡的主要原因。当考虑心血管疾病的后果时,CKD的病因很重要——CKD的根本原因、肾损伤指数(如:蛋白尿、GFR降低)和心血管疾病风险之间存在着强烈的相互作用。换句话说,与继发于肾小球肾炎或多囊肾病的CKD患者相比,具有相当程度的蛋白尿和/或GFR但患有糖尿病的患者发生CV事件和CV死亡的风险要高得多。由高血糖、高脂血症、慢性炎症、氧化应激、肠道失调引起的细菌代谢产物和许多其他因素导致的严重内皮功能障碍,触发并促进糖尿病患者,尤其是DKD患者的动脉粥样硬化。更好的糖尿病代谢控制可以显著减缓糖尿病微血管和大血管并发症的进展,这对心血管疾病和CKD(DKD)的发展至关重要。高磷血症与所有CKD范围的死亡风险增加有关。在最重要的研究中,Chang等人发现,磷摄入量超过1.4 g/天和磷密度超过0.35 mg/kcal与全因死亡风险增加相关(磷密度定义为膳食磷量与每日总热量摄入之间的比率)。高磷密度(>0.35 mg/kcal)但不摄入磷也与CV死亡率增加相关【1】。
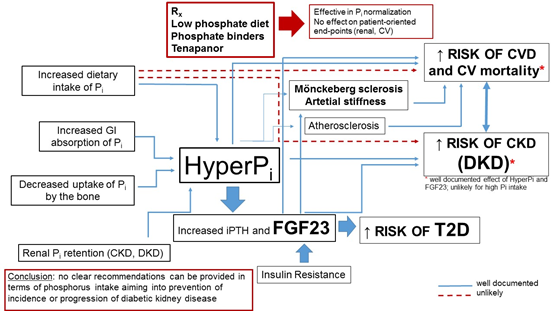
图12. 糖尿病患者CKD-MBD相关的数据,并分析高磷血症、CKD-MBD的某些生物标志物和高磷酸盐摄入对糖尿病和DKD患者预后的可能联系.
3.3 磷对非糖尿病和糖尿病CKD发展和进展的影响
在早期糖尿病(即肾功能保存良好)患者可能经历磷酸盐耗竭,而不是磷酸盐积累,因为在高血糖的情况下,近端肾小管细胞对磷酸盐的再吸收效率较低,并且可能发生高磷尿【31】。磷酸盐耗尽可能导致细胞能量平衡受损,类似于组织缺血。糖尿病和高血糖控制不佳的患者尤其如此,主要影响胰岛素不能控制葡萄糖摄取的细胞。这种情况可能激活刺激促红细胞生成素合成和释放的途径,促红细胞生成素是一种有助于抵抗缺血的必需激素。糖尿病患者的血清血红蛋白保存完好,但促红细胞生成素合成增加【31】。在一些研究中,高磷血症(甚至高正常血清磷酸盐)已被确定为不同病因CKD患者CKD进展的独立预测因子,在一定程度上,磷酸盐和FGF23对预后的影响可能取决于其与蛋白尿的关系【1】。
随着GFR降低,对较低磷酸盐过滤的适应以及蛋白尿或炎症导致的肾小管细胞Klotho表达的降低是CKD-MBD的关键驱动因素【32】。Klotho是一种主要由肾小管表达的跨膜或分泌蛋白,是磷尿激素成纤维细胞生长因子23(FGF23)的共同受体。肾脏Klotho表达的早期降低和排泄磷酸盐的需要导致血清FGF23水平随着GFR的降低而逐渐升高。在近端小管中,FGF23减少磷酸盐重吸收,从而促进磷尿,并减少骨化三醇的合成。骨化三醇利用率的降低将限制肠道对磷酸盐和钙的吸收(图7. https://blog.sciencenet.cn/blog-526326-1325776.html )。此外,Klotho具有FGF23独立的肾脏保护和抗衰老作用,并且在Klotho水平较低的情况下,过量的FGF23具有不良的心血管非靶向效应。较低的骨化三醇浓度和由于肠道钙吸收减少导致的低钙血症趋势促进PTH分泌和甲状旁腺功能亢进。这些适应性反应可导致骨损伤,但可防止高磷血症(正常血清磷酸盐范围为2.5–4.5 mg/dL),直到GFR非常低,此时必须规定饮食磷酸盐限制和磷酸盐粘合剂,以限制肠道中的磷酸盐吸收,从而限制高磷血症的不利影响。事实上,高磷血症增加了继发性甲状旁腺功能亢进的严重程度,导致骨病、血管钙化、心血管事件和死亡率的增加(图13,14)【33】。

图13。代谢性骨病病理生理学的基本组成部分和治疗干预的目标。雌激素缺乏导致的骨质疏松症与破骨细胞因子(包括白细胞介素1(IL-1)、白细胞介素6和肿瘤坏死因子α(TNF-α)的产生增加以及核因子κB(NF-κB)的激活有关,导致骨吸收增加。甲状旁腺激素(PTH)水平在很大程度上在一生中保持正常(如血清钙[Ca]和无机[Pi]浓度)。慢性肾病-矿物质和骨骼疾病(CKD-MBD)主要是一种矿物质稳态紊乱,导致激素变化,包括甲状旁腺功能亢进和代谢性骨病。抗再吸收药物靶向破骨细胞(OCs),即骨吸收细胞。含氮双膦酸盐结合到骨表面,尤其是那些正在进行主动吸收的骨表面,然后它们被破骨细胞选择性地内化,并干扰影响其吸收活性和存活的特定功能。Denosumab结合并抑制RANKL(核因子-κB配体受体激活剂)与RANK结合,从而影响破骨细胞的分化、活性和存活,从而导致破骨细胞从骨表面流失。骨合成代谢药物特立帕肽和阿巴帕肽靶向成骨细胞(OBs),即成骨细胞。Romosozumab是一种人源化单克隆抗体,可结合并抑制硬化蛋白,硬化蛋白是一种骨细胞分泌的糖蛋白,可降低成骨细胞功能,从而减少骨形成。罗莫珠单抗抑制硬化蛋白可刺激骨形成并减少骨吸收【34】。
3.4 骨质疏松症和慢性肾脏疾病矿物质和骨骼疾病
慢性肾病-矿物质和骨骼疾病(CKD-MBD)是KDIGO于2005年创造的一个术语(肾脏疾病:改善全球预后),旨在强调钙、磷、甲状旁腺激素(PTH)和成纤维细胞生长因子23(FGF-23)代谢紊乱可能导致全身性疾病,如果不治疗,后果可能会恶化,可能导致骨代谢紊乱(肾性骨营养不良)、血管钙化和心血管(CV)死亡(图13)【34】。
在CKD的早期阶段,FGF23下调1α-羟化酶的活性并增强24羟化酶的活性,从而导致1,25-二羟维生素D[1,25(OH)2D3][35,36]的合成减少。随着肾功能的恶化,血浆FGF23水平逐渐升高。其分泌早于钙、磷或PTH水平的变化,因此现在被认为是CKD-MBD最早可检测的生物标志物之一【35】。
3.5 继发性甲状旁腺功能亢进
骨骼疾病是慢性肾脏病(CKD)、肥胖和肠道吸收不良的常见并发症。继发性甲状旁腺功能亢进症(SHPT)是指甲状旁腺激素(PTH)分泌的适当增加,由潜在疾病引起的血钙降低或磷酸盐浓度升高所驱动【36】。
肾功能恶化与磷酸盐存留有关,导致低钙血症、高磷酸盐血症和1,25(OH)2D3降低,所有这些都促进甲状旁腺激素(PTH)分泌,从而导致磷酸盐排泄增加,并在CKD晚期发展为继发性甲状旁腺功能亢进【37】.高水平的FGF23可降低高磷血症,同时降低1,25(OH)2维生素D水平。骨化三醇的缺乏与肠道钙吸收减少有关,这会导致低钙血症,降低维生素D受体的组织水平,导致对骨化三醇介导的调节产生抵抗,刺激PTH分泌,并导致继发性甲状旁腺功能亢进(图14)【37】。
关于饮食建议对继发性甲状旁腺功能亢进影响的现有证据证实了以减少磷酸盐摄入为特征的饮食的益处,避免低钙和维生素D摄入(推荐摄入量分别为1000-1200 mg/天和400-800 UI/天)。降低继发性甲状旁腺功能亢进风险的合理方法是根据现有的危险因素和伴随的医疗条件进行个性化饮食操作。需要更多的研究来评估平衡饮食对高危患者继发性甲状旁腺功能亢进的管理和预防的长期效果(图14)【36】。

图14 继发性甲状旁腺功能亢进的机制
3.6钙磷遗传性代谢紊乱的分子基础
钙(Ca)和磷(P)在许多骨骼和骨骼外生物过程中起主导作用(图5. https://blog.sciencenet.cn/blog-526326-1325776.html )。他们血清中的正常范围反映了他们在人类健康中的关键作用。信号“航行”始于甲状旁腺表面的钙敏感受体(CaSR),它捕捉细胞外游离钙的“振荡”,并将信号传递到下游。甲状旁腺激素(PTH)、维生素D、成纤维细胞生长因子(FGF23)和其他受体或离子转运体协同工作,并在骨骼、肾脏和肠道之间建立高度调节的信号通路,以确保维持钙和磷稳态(图9. https://blog.sciencenet.cn/blog-526326-1325776.html )。任何偏离这一精心安排的方案都可能导致由生化和/或临床特征表现的轻微或严重的病理。遗传性钙磷代谢紊乱是罕见的。然而,延误诊断或误诊可能会影响患者的生活质量甚至预期寿命。解开涉及钙和磷信号传导的分子途径的线索,以更好地理解遗传改变与生化和/或临床表型之间的联系,并有助于诊断和早期治疗干预(图15)【38】。
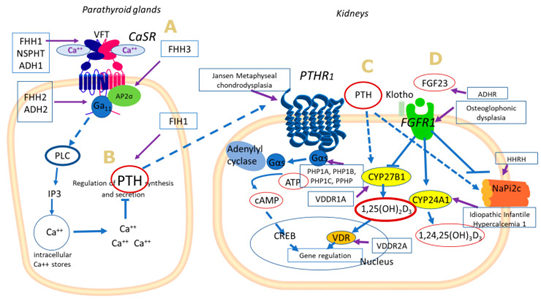
图15 与遗传性钙/磷代谢紊乱相关的选择性分子改变示意图。(A) 在甲状旁腺中,Ca2+或其他相容配体激活CaSR,诱导Gαq/11介导的磷脂酶C(PLC)激活,增加肌醇1,4,5-三磷酸(IP3),并导致细胞内Ca2+动员,作为不同细胞依赖性作用的二级信使,如PTH合成调节。(B) PTH通过其受体PTHR1作用于靶器官(肾脏),并通过G蛋白、轴GαS-腺苷酸环化酶-cAMP-蛋白激酶A(PKA)激活。产生的cAMP作为细胞第二信使,促进靶基因的转录。(C) PTH通过CYP27B1活化促进1,25(OH)2D3合成,并通过抑制NaPi-2c(和NaPi-2a)共转运蛋白抑制Pi重吸收。(D) FGF23通过其受体FGFR1介导其作用,抑制1,25(OH)2D3肾脏合成和Pi重吸收,同时通过激活CYP24A1促进1,25(OH)2D3分解代谢【38】。
主要参考文献
血清磷对疾病和普通人群的潜在影响(1):回到基础
https://blog.sciencenet.cn/blog-526326-1325776.html
17. Atherosclerosis. 2020;306:68–74
18. Arterioscler. Thromb. Vasc. Biol. 2018;38:2137–2147.
19. Circ. Res. 2000;87:E10–E17.
20. Bone. 2001;28:1–8.
21. Exp. Cell Res。 2014;323:198–208
22. Curr. Med. Chem. 2020;27:1647–1660.
23. Int. Urol. Nephrol.50:137–142
24.Eur. Heart J. 2017;38:1801–1804.
25. EMBO Mol. Med. 2020;12:e12423.
26. Kidney Int. 2018;93:1293–1297.
27. Am. J. Physiol. Cell Physiol. 2016;310:C788–C799.
28. Arterioscler. Thromb. Vasc. Biol. 201030:321–326
29. Ann Transl Med. 2021 Apr;9(7):579.
30. Diabetes Care. 2021;44:89–97.
31. Curr. Diabetes Rev.2010;6:323–333.
32. Adv. Ther. 2020;37:62–72.
33. Nutrients. 2021 Apr 13;13(4):1273.
34. Am J Kidney Dis. 2021 Oct;78(4):582-589.
35. Kidney Int. 2011;79:1370–1378.
36. Nutrients. 2021 Jul 7;13(7):2328.
37. Nutrients. 2021 Jun 16;13(6):2065.
38. Genes (Basel). 2021 May 13;12(5):734.
https://m.sciencenet.cn/blog-526326-1329243.html
上一篇:信人易,被信难!被信是很高的能力体现
下一篇:见小曰明,守柔曰强