博文
219 无论接种方案或途径如何,HDCV和PVRV都具有良好的安全性和有效性
||
无论接种方案或途径如何,HDCV和PVRV都具有良好的安全性和有效性
摘要
与传统的3周方案相比,较短时间的狂犬病暴露前预防(PrEP)方案可能提供更好的便利性和可行性,例如在疫苗难以获得的地区或狂犬病流行地区的旅行者。在这项多中心、开放标签、对照试验中,570名年龄在2-64岁的健康参与者被随机分组:1周PrEP(疫苗接种天数D0和7;组1)或经典的3周PrEP方案(D0、D7和D21第2组),每次就诊时肌肉注射1.0 mL人二倍体细胞培养狂犬病疫苗(HDCV );1周PrEP,两点皮内(ID)接种,0.1 mL/点接种HDCV(第3组);或在每次就诊时使用一剂0.5 mL肌肉(IM)剂量(第4组)或两位点0.1 mL ID剂量(第5组)的Vero细胞狂犬病疫苗(PVRV)进行为期1周的PrEP。一年后,参与者接受模拟暴露后预防性(PEP)疫苗接种(两次肌肉ID剂量的HDCV或PVRV,间隔三天)。狂犬病病毒中和抗体滴度和血清转化(滴度≥ 0.5 IU/ mL)率在PrEP后14天和最长1年,以及PEP前和后进行评估。在整个研究过程中评估了安全性。在最后一次PrEP注射后14天,血清转换率很高(在第1、3-5组中从96.7 %到97.2 %不等;并且在组2 (3周PrEP)中达到100 %。在最后一次疫苗注射后14天的血清转换率方面,未证明第1组相对于第2组的非劣效性(主要目的)。在模拟PEP后,所有组都表现出快速和强有力的免疫反应,除一名参与者外,所有参与者都实现了血清转化(滴度≥ 0.5 IU/ mL)。不存在安全性问题,各组疫苗的耐受性相似。
使用HDCV或PVRV的1周IM或ID PrEP方案提供了有效的启动,使各年龄组在1年后对模拟PEP产生快速而强烈的记忆反应。
ClinicalTrials.gov号码:NCT03700242。
世卫组织通用试验号码(UTN): U1111-1183-5743。
关键词
增强稳定性 人二倍体细胞疫苗 暴露前预防 模拟暴露后预防 狂犬病疫苗接种方案 Vero细胞狂犬病疫苗
1. 介绍
狂犬病是一种病毒动物传染病疾病,在临床症状出现后几乎总是致命的。狂犬病病毒主要通过受感染哺乳动物(主要是犬)咬伤或抓伤后的唾液传播。在150个受影响的国家中,狂犬病感染每年导致约59,000人死亡,其中大约一半的死亡发生在亚洲。
人狂犬病预防主要依赖于暴露后预防(PEP)和暴露前预防(PrEP)疫苗接种。许多基于细胞的狂犬病疫苗可用于PrEP和PEP,包括人二倍体细胞疫苗(HDCV)和纯化的Vero细胞狂犬病疫苗(PVRV ),前者于20世纪70年代中期获得上市许可。这两种疫苗都具有良好的安全性和有效性。建议暴露于狂犬病的高风险人群使用PrEP,如生活在狂犬病流行区的偏远人群,每年犬咬伤发生率> 5 %,或已知存在吸血蝙蝠狂犬病,以及处于职业风险的个人。然而,PrEP的成本,例如在常规的儿童免疫计划中,限制了它在低收入地区的使用。也建议去狂犬病流行地区的旅行者做好PrEP。现有信息表明,0.4 %(范围0.01-2.3%)的去狂犬病流行区旅行的人在逗留的每个月都有被咬伤的风险。尽管如此,相对较少人报告知道狂犬病PrEP(29 %)和PEP (27 %),或报告在旅行前接种疫苗(8-12%的游客),尽管旅行前接种疫苗似乎在外籍人士中更常见(31 %的外籍人士)。虽然疫苗费用是旅行者不接种疫苗的首要原因,但另一个问题是,在最后一刻出行的人可能没有足够的时间在出发前完成一系列疫苗接种。
PrEP旨在引发对狂犬病的长期免疫,以允许对PEP的快速记忆免疫反应。此外,在潜在的狂犬病暴露后,先前未接种疫苗的个体需要在一至四周内接种多剂疫苗,对于III类暴露的个体,施用狂犬病免疫球蛋白(RIG)。而那些以前接受过PrEP的人可以接受简化的PEP方案,只需间隔三天接种两次疫苗,不需要RIG。
历史上,PrEP疫苗接种方案包括在第0天、第7天、第21天或第28天进行三次肌肉注射(IM )( 3-或4周,3次就诊方案),尽管皮内(ID)接种也被认为是一种可接受的替代方案。然而,已经开发了需要更少注射次数和门诊随访次数的逐渐缩短的方案,以提高依从性和降低成本,而不损害疗效。较短的方案也有助于在短时间内旅行的人接种狂犬病疫苗。因此,世界卫生组织(WHO)在2018年推荐了1周的暴露前疫苗接种方案(D0和D7的剂量)。美国免疫实践咨询委员会(ACIP)最近更新了他们关于1周2次(D0和D7)IM PrEP方案的建议,根据个人暴露于狂犬病病毒的风险水平可能增加剂量(建议风险最高的人进行2剂PrEP[IM;D0,D7]和加强剂(如果滴度低于0.5 IU/ mL)以及那些处于升高但未持续的风险中的人,2剂疫苗且无滴度检查或加强剂)。虽然狂犬病疫苗的标准接种途径是肌肉注射,但世卫组织推荐ID接种,并在一些国家获得批准,尤其是在亚洲。由于HDCV和PVRV在更短的PrEP方案中的常规使用预计将变得更加广泛,因此需要对使用更短的IM或ID疫苗接种方案进行的HDCV和PVRV进行进一步评估。
在这项对菲律宾年龄≥ 2岁的健康个体进行的研究中,首先评估了1周IM PrEP与HDCV的经典3周IM方案相比的非劣效性。还评估了HDCV 1周ID PrEP,PVRV 1周IM或ID PrEP,以及两种疫苗和两种注射途径在模拟PEP长达一年后的抗体持久性、既往免疫应答和安全性。
2. 方法
2.1. 研究设计和参与者
这是一项从2018年9月到2020年4月在菲律宾的两个临床中心进行的III期开放、对照、随机研究(clinicaltrials.gov,NCT03700242)。本研究遵循《赫尔辛基宣言》和《人用药物注册技术要求协调国际会议(ICH)良好临床实践指南(GCP)》确立的原则,以及所有当地和/或国家法规和指令。书面的知情同意,或年龄小于18岁的人的同意以及父母的同意,在进行任何研究程序之前获得参与者的同意。
年龄≥ 2岁的健康个体有资格入选。排除标准包括:怀孕、有怀孕或哺乳风险;在登记时或首次接种疫苗前4周内参与另一项临床试验;在第一次研究疫苗接种前四周或任何研究疫苗接种后四周内接种任何疫苗(以下情况除外,流感疫苗研究疫苗接种前2周),或试验前任何时间接种狂犬病疫苗;收到免疫球蛋白类或血液制品;已知或疑似先天性或获得性免疫缺陷或收到免疫抑制治疗在前六个月内;已知的超敏反应任何疫苗成分;接受用于疟疾化学预防的药物治疗超过4周,有或没有其他抗疟疾治疗,部分治疗在接种疫苗前2周内接受,禁忌ID疫苗接种。
2.2. 随机化和盲法
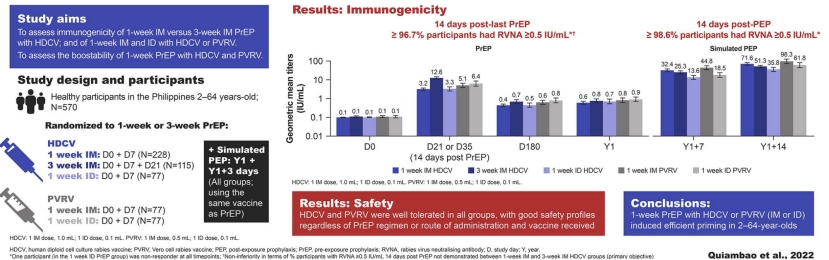
这是一项不设盲法的开放性研究。参与者被随机分配,分配比例为6:3:2:2:2,使用置换区组法生成的可刮式随机列表,按站点分层(图1):第1组收到单IM剂量(每支1.0 mL)HDCV (Imovax狂犬病;赛诺菲巴斯德,法国里昂)D0和D7;第2组接受单次肌肉注射剂量(每次1.0 mL)的HDCV (Imovax狂犬病;赛诺菲巴斯德,法国里昂)D0,D7和D21;第3组在D0和D7接受两个ID剂量的HDCV (2 × 0.1 mL);第4组接受单次肌肉注射剂量(0.5 mL)的PVRV(VERORAB;赛诺菲巴斯德,法国里昂)D0和D7;第5组接受两次ID剂量(2 × 0.1 mL)的PVRV,D0和D7。
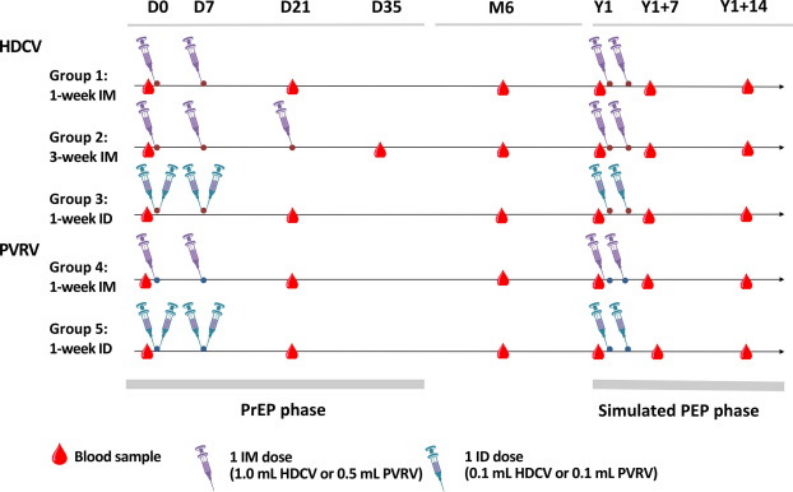
图1. 研究设计HDCV、人二倍体细胞培养狂犬病疫苗;PVRV,纯化Vero细胞狂犬病疫苗;IM,肌内;ID,皮内;PrEP暴露前预防;PEP,暴露后预防。
在最后一次PrEP注射后一年(Y1),参与者接受用于预免疫个体的模拟PEP,包括单次IM或ID剂量的HDCV或PVRV,在Y1和Y1 + 3天接种。对于模拟的PEP,参与者接受相同的疫苗和剂量,通过相同的途径接种,如分配给暴露前接种(图1)。
2.3. 疫苗
HDCV和PVRV均以冻干粉末形式提供,用于在使用前立即复溶。每剂疫苗含≥ 2.5 IU灭活狂犬病毒(WISTAR狂犬病PM/WI 38 1503-3 M株);每个HDCV剂量在1 mL无菌注射用水中重新配制,并且每个PVRV剂量在0.5 mL 0.4 %的NaCl中复溶。单个疫苗批次用于制备剂量的每个疫苗(HDCV批次#N1E29,4.1 IU/mL抗原;PVRV批号N1L79,8.3 IU/mL抗原)和PEP剂量(HDCV批号R1D11,6.2 IU/mL;PVRV批号#P1D06,12.2IU/mL);使用ie国立卫生研究院评估效力在活生物体内人用狂犬病疫苗批签发的效力试验。对于肌内注射,HDCV和PVRV分别使用完整的1 mL和0.5 mL剂量,而每个剂量使用0.1 mL ID注射。
研究注射接种于手臂的三角肌区域,每次就诊时肌肉注射剂量在两侧之间交替,而在同一次就诊时给予的两次ID剂量在不同的手臂中接种。
2.4. 免疫原性评估
用于免疫原性评估的血样在PrEP接种疫苗前(D0)和14天(第1组和第3-5组为D21,第2组D35)和最后一次注射后6个月。在PEP阶段,在第一次模拟PEP注射之前,在Y1 + 7天和Y1 + 14天采集血样。使用快速荧光灶抑制试验(RFFIT)测量狂犬病毒中和抗体(RVNA)滴度,在主办方的全球临床免疫学实验室(美国宾夕法尼亚州斯威夫特沃特)并使用LabTek载玻片。RFFIT分析的定量下限(LLOQ)为0.2 IU/ mL;血清阳性定义为RVNA滴度≥ 0.2 IU/ mL。
2.5. 免疫原性结果
主要目的是证明与传统的3周IM方案相比,1周IM PrEP方案在免疫原性方面的非劣效性血清转化最后一次PrEP注射后14天进行评级。因此,主要终点是RVNA滴度≥ 0.5 IU/ mL(血清转换的可接受阈值)通过RFFIT对组1的D21和组2的D35进行测量。次要免疫原性终点包括所有组在最后一次PrEP注射前(D0)和14天、6个月和Y1后以及PEP前后(第一次PEP注射后Y1、Y1 + 7天、Y1 + 14天)的RVNA滴度和血清转化。计算最后一次疫苗注射后14天与基线的RVNA滴度比,以及第一次模拟PEP注射后7天和14天与最后一次疫苗注射后1年的滴度比。
2.6. 安全结果
将所有组的PrEP和模拟PEP方案的安全性作为次要目标进行评估。监测参与者在每次注射后30分钟内发生的即时自发全身不良事件(AE)。参与者或其父母或法律代表在日记卡中记录每次注射后7天内(或第一次和第二次PrEP注射之间以及第二次PEP注射后7天内)出现的请求注射部位(疼痛、红斑和肿胀)和全身性(发热、头痛、不适、肌痛)反应。不请自来的非严重注射部位反应也在最后一次PrEP和PEP注射后28天内被记录。请求反应和主动提供的不良事件的强度按三分制进行分级,并记录为治疗这些事件所采取的任何措施。评估了在PrEP或模拟PEP期间(最后一次PrEP或PEP注射后28天内)发生的任何严重不良事件(SAE ),以及在PrEP结束和PEP开始之间发生的所有SAE、死亡和危及生命的SAE。研究人员将研究注射和每个主动不良事件或SAE之间的因果关系评估为相关或不相关。
2.7. 统计方法
如果两组间两个比例的差异的95 % CI的下限> 5 %,则证明HDCV 1周IM PrEP方案与3周方案相比(第1组对第2组)的免疫原性非劣效性。差异的95 %可信区间是在没有连续性校正的情况下使用Wilson评分法计算的。
假设每组中RVNA滴度≥ 0.5 IU/ mL的参与者比例为99 %,第1组和第2组的随机化比例分别为2:1,则需要第1组中的193名可评估参与者和第2组中的97名参与者提供约90 %的功效,以使用Farrington和Manning方法检验零假设。假设15 %的参与者不可评估,那么第1组共有228名参与者,第2组共有114名参与者。第3、4和5组的样本量被任意设置为76名参与者。
次要终点的统计分析是描述性的。在每个时间点按组总结安全性和免疫原性数据。主要的安全性和免疫原性参数用它们的95 % CI来描述。使用精确二项式方法(Clopper-Pearson方法)计算比例的CIs。免疫原性和安全性也由以下年龄组描述:2至11岁、12至17岁和18至64岁。几何平均滴度(GMT)和CIs是使用log10转换滴度的正态近似值计算的,随后进行反向转换。
免疫原性分析在按方案分析集(PPAS)上进行,并在全分析集(FAS)上确认。定义了两种PPAS,PrEP PPAS和模拟PEP PPAS。这些参与者符合方案规定的纳入和排除标准,在规定的时间内完成了PrEP或PEP,分别提供了有效的PrEP和PrEP在暴露或PEP血清样本,并且对于PrEP PPAS,在基线时血清呈阴性(RVNA滴度< LLOQ仅PrE PPPAS)。在最后一次PrEP注射后14天至模拟PEP方案开始之间暴露于狂犬病病毒的参与者,但未从研究中排除,不包括在PPAS分析中。还定义了两种FAS,PrEP FAS和模拟PEP FAS,包括分别在PrEP或PEP期间接受至少一剂研究疫苗的所有参与者。在安全性分析集(SafAS)上进行安全性分析,安全性分析集定义为在PrEP (PrEP SafAS)或PEP (PEP SafAS)期间接受至少一剂研究疫苗的人。
用SAS软件9.4版(SAS Institute,Cary,North Carolina,USA)进行统计分析。
3. 结果
3.1. 参与者
有570名参与者登记并随机分组:第1组n = 228,第二组n = 115,第三组n = 77,第4组n = 75,第5组n = 75。所有参与者接受了至少一剂PrEP疫苗,并被纳入PrEP FAS 524名(91.9 %)参与者被纳入暴露前PPAS。共有544名(94.5 %)受试者参加了1年(Y1)访视,其中30名受试者在PrEP期和PEP期之间报告了至少1项明确的禁忌症(主要是与狂犬病病毒的潜在接触),阻止了模拟PEP疫苗接种。其余514名参与者接受第一次模拟PEP注射:第1组n = 200,第二组n = 107,第三组n = 68,第4组n = 68,第5组n = 7。所有这些参与者都在Y1时提供了接种前血样。PEP PPAS包括488名(85.6 %)参与者。总体而言,28名(4.9 %)参与者中止了研究。其中大多数是由于自愿退出,而不是由于AE (n = 17,3.0 %)或不符合方案(n = 7;1.2 %);3名(0.5 %)参与者失访,第1组中有一名(0.2 %)出现了与研究疫苗无关的致命性SAE。
研究组之间纳入时的年龄分布相似(表1)。多数(n = 314,55.1 %)的参与者年龄在18-64岁之间,165人(28.9 %)年龄在2-11岁之间,91人(16.0 %)年龄在12-17岁之间;没有年龄≥ 65岁的参与者。男性和女性的比例总体上是平衡的(47.2 %比52.8 %),在大多数群体中,除了第2组男性比女性少(41.7 %比58.3 %)。有57名(10.0 %)受试者过去或现在至少有一项相关病史(如登革热、高血压、上呼吸道感染),17名(3.0 %)受试者至少有一项持续病史(主要是高血压和上呼吸道感染),组间无差异。
表1. 基线时的参与者特征(D0;PrEPFAS)。
第一组 | 第二组 | 第三组 | 第四组 | 第五组 | 全部 | |
性别,n (%) | ||||||
男性的 | 115 (50.4) | 48 (41.7) | 36 (46.8) | 34 (45.3) | 36 (48.0) | 269 (47.2) |
女性的 | 113 (49.6) | 67 (58.3) | 41 (53.2) | 41 (54.7) | 39 (52.0) | 301 (52.8) |
年龄 | ||||||
平均值(标准偏差) | 22.5 (13.6) | 24.1 (14.7) | 19.2 (13.0) | 22.6 (14.2) | 23.8 (15.3) | 22.5 (14.1) |
年龄,均值 | ||||||
2至11年 | 66 (28.9) | 35 (30.4) | 26 (33.8) | 16 (21.3) | 22 (29.3) | 165 (28.9) |
12至17岁 | 35 (15.4) | 11 (9.6) | 12 (15.6) | 19 (25.3) | 14 (18.7) | 91 (16.0) |
18-64岁 | 127 (55.7) | 69 (60.0) | 39 (50.6) | 40 (53.3) | 39 (52.0) | 314 (55.1) |
≥65岁 | 0 | 0 | 0 | 0 | 0 | 0 |
第1组,1周HDCV IM接种方案;第2组,3周HDCV IM接种方案;第3组,1周HDCV ID接种方案;第4组,1周PVRV IM接种方案;第5组,1周PVRV ID接种方案。
FAS,全分析集;SD,标准差;HDCV,人二倍体细胞培养狂犬病疫苗;PVRV,纯化Vero细胞狂犬病疫苗;IM,肌内;ID,皮内;PrEP暴露前预防。
n,满足所列特征的参与者数量;n,研究组(FAS)的参与人数。
3.2. PrEP方案的免疫原性
对于主要目标,在暴露前性PPAS中,在最后一次暴露前疫苗接种后14天出现血清转换的参与者比例,第1组为96.7 % (202/209),第2组为100.0 % (109/109)(组间差异为3.349 [95 % CI为6.751–0.464])。由于组间差异的双侧95 % CI的下限低于非劣效阈值,因此未证明组1与组2在血清转换率方面的非劣效性。在PrEP FAS中获得了类似的结果(96.7 % [207/214]对100.0%[112/112];组间差异为3.271 [95 %可信区间为6.597–0.445])。
尽管主要目标没有实现,RVNA几何平均滴度(GMTs IU/ mL)在暴露前FAS中从基线到最后一次暴露前接种后14天在所有组中增加(图2)。在基线(D0)时,11名参与者的滴度≥0.2 IU/ mL;第1、2和4组各3名,第3和5组各1名),其中7名患者的滴度≥ 0.5 IU/mL(第1、3、4和5组各1名,第2组3名)。最后一次暴露前疫苗接种后14天,第1组的GMT为3.18(95% CI 2.76–3.67),第2组为12.6(95% CI 10.8–14.7)。GMT比率(最后一次暴露前接种后14天,相对于D0)的范围从第1组的30.7到第2组的115。除了两名受试者(第1组和第5组各一名)外,所有受试者在最后一次暴露前疫苗接种后14天血清反应均呈阳性(效价≥ 0.2 IU/mL),所有受试者均获得了高血清转化率(≥ 96.7 %)(效价≥ 0.5 IU/mL)(暴露前疫苗组;图3)。对于每种疫苗,IM与ID 1周PrEP方案之间的RVNA反应是可比的,PVRV与HDCV 1周PrEP组的GMT倾向于略高,ID组比IM组更显著(图3).
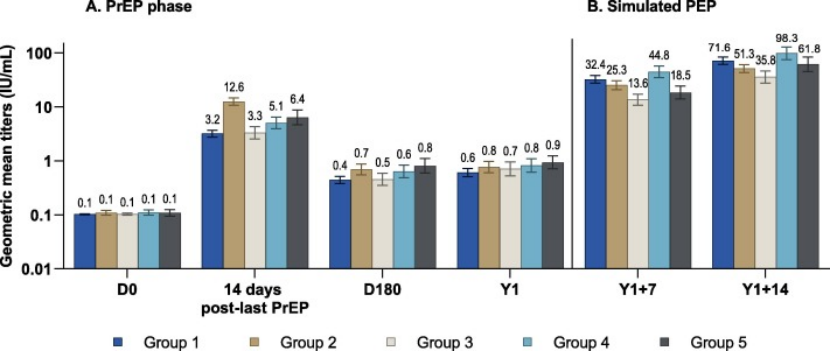
图2. 病毒中和抗体几何平均滴度(A)在暴露前疫苗接种(PrEP FAS)后14天、6个月和1年,或(B)在模拟PEP (PEP FAS)后7天和14天误差条表示95 %置信区间;D,天;PEP,暴露后预防;PrEP,露前预防;Y1,第1年;第1组,1周HDCV IM接种方案;第2组,3周HDCV IM接种方案;第3组,1周HDCV ID接种方案;第4组,1周PVRV IM接种方案;第5组,1周PVRV ID接种方案。
图3. 血清转化比率(A)在暴露前疫苗接种(PrEP FAS)后14天、6个月和1年,或(B)在模拟PEP (PEP FAS)血清转化后7天和14天,病毒中和抗体滴度≥0.5 IU/ mL;误差棒表示95 %置信区间;D,天;PEP,暴露后预防;PrEP,露前预防;Y1,第1年;第1组,1周HDCV IM接种方案;第2组,3周HDCV IM接种方案;第3组,1周HDCV ID接种方案;第4组,1周PVRV IM接种方案;第5组,1周PVRV ID接种方案。
在最后一次暴露前疫苗接种后14天和6个月之间,所有组的GMT都下降,此后一直保持相对稳定,直到Y1(图2)。在所有组中,在最后一次暴露前疫苗接种后14天和6个月之间,血清转换率也下降了(D180血清转换率从45.2 %到65.2 %),尽管大多数参与者在Y1时血清转换率为57.8 %到77.8%;PrEP FAS)图3)。
在PrEP FAS中,各年龄组之间的GMT在基线时是可比的,但在最后一次PrEP疫苗接种后14天,每个研究组的GMT往往随着年龄的增加而降低(最后一次PrEP疫苗接种后14天的GMT:对于2-11岁的参与者,各研究组的GMT为3.85-16.3;年龄在18-64岁的人为2.45至10.9岁)(表2)。在所有研究组中,所有儿童(2-17岁)在最后一次PrEP疫苗接种后14天血清转化。没有血清转换的11名参与者是成年人。在Y1时,每个研究组的GMT和血清转换率随着年龄的增加而降低。
表2. RVNA GMT和最后一次PrEP注射后14天的血清转换率,按年龄分类(PrEP FAS)。
第一组 | 第二组 | 第三组 | 第四组 | 第五组 | |
所有年龄 | |||||
GMT (95 %置信区间) | 3.18 (2.76; 3.67) | 12.6 (10.8; 14.7) | 3.30 (2.55; 4.28) | 5.06 (3.94; 6.50) | 6.38 (4.64; 8.77) |
血清转换,n; %(95 %可信区间) | 207; 96.7 (93.4; 98.7) | 112; 100.0 (96.8; 100.0) | 73; 98.6 (92.7; 100.0) | 69; 98.6 (92.3; 100.0) | 69; 97.2 (90.2; 99.7)) |
2至11岁 | |||||
GMT (95 %置信区间) | 4.70 (3.90; 5.67) | 16.3 (12.8; 20.6) | 3.85 (2.79; 5.30) | 8.37 (4.90; 14.3) | 8.89 (4.92; 16.1) |
血清转换,n; % (95 %可信区间) | 63; 100 (94.3; 100.0) | 34; 100 (89.7; 100.0) | 26; 100 (86.8; 100.0) | 15; 100 (78.2; 100.0) | 21; 100 (83.9; 100.0) |
12至17岁 | |||||
GMT (95 %置信区间) | 3.79 (2.72; 5.28) | 14.7 (7.73; 28.0) | 3.61 (1.78; 7.29) | 5.88 (3.49; 9.92) | 5.66 (3.59; 8.93) |
血清转换,n; % (95 %可信区间) | 34; 100 (89.7; 100.0) | 9; 100 (66.4; 100.0) | 11; 100 (71.5; 100.0) | 18; 100 (81.5; 100.0) | 14; 100 (76.8; 100.0) |
18至64岁 | |||||
GMT (95 %置信区间) | 2.45 (1.98; 3.02) | 10.9 (8.79; 13.4) | 2.89 (1.87; 4.49) | 3.84 (2.73; 5.39) | 5.51 (3.29; 9.22) |
血清转换,n; % (95 %可信区间) | 110; 94.0 (88.1; 97.6) | 69; 100 (94.8; 100.0) | 36; 97.3 (85.8; 99.9) | 36; 97.3 (85.8; 99.9) | 34; 94.4 (81.3; 99.3) |
第1组,1周HDCV IM接种方案;第2组,3周HDCV IM接种方案;第3组,1周HDCV ID接种方案;第4组,1周PVRV IM接种方案;第5组,1周PVRV ID接种方案。
CI,置信区间;FAS,全分析集;SD,标准差;HDCV,人二倍体细胞培养狂犬病疫苗;PVRV,纯化Vero细胞狂犬病疫苗;IM,肌内;ID,皮内;PrEP暴露前预防。
n,满足所列特征的参与者数量;N,研究组(全分析集)中的参与者数量。
3.3. PEP方案的免疫原性
所有组在模拟PEP后都表现出快速和强烈的抗体反应,表明不同暴露前接种方案的可加强性。在所有研究组中,第一次模拟PEP接种后7天的GMT增加到高于最后一次PrEP注射后14天观察到的水平(图2),并在最后一次PEP接种后14天进一步增加。在第7天和第14天的时间点,第1组(IM 1-周HDCV)的GMT(95% CI)均高于第3组(ID 1-周HDCV)(Y1+7:32.4[27.4–38.3]比13.6[10.7–17.3];y1+14:71.6[61.2–83.6]对35.8[27.8–46.2])。在Y1 + 7天,IM PVRV PEP(第4组)比ID PVRV PEP(第5组)的GMT也更高(44.8[35.1–57.1]比18.5[14.0–24.4]),在Y1 + 14天,这些组之间的差异不太明显(重叠95% ci)(98.3[75.0–129]比61.8[45.5–84.1])。Y1 + 7/Y1和Y1 + 14/Y1 GMT比率的范围分别为第5组的19.9至第1组的60.7和第5组的70.0至第1组的138。所有参与者在第一次模拟PEP注射后第7天和第14天的RVNA滴度≥ 0.5 IU/ mL(图3),除了第5组中的一名41岁男性参与者在模拟PEP后没有实现血清转化。该参与者在任何暴露前疫苗接种后也没有可检测的抗体反应(≥0.2 IU/ mL研究);然而,没有报告相关的病史。
总的来说,在所有研究组中模拟PEP后,在所有年龄组中都观察到了强烈的抗体反应。在第4组2-11岁的参与者中观察到最高的GMT:在第一次模拟PEP疫苗接种后7天和14天的GMT值分别达到106(95% CI 65.6-172)和214(95% CI 118-391)。
3.4. 安全性
总的来说,两组间HDCV和PVRV的安全性相似。在接种预防针或PEP疫苗后,没有立即报告未经请求的AE。
在PrEP阶段,请求注射部位组间报告的全身反应频率相似(图4A)。请求的频率(95 %置信区间)注射部位反应在任何注射后发生,各组之间的范围从第5组的20.0%(11.6–30.8),n = 15/75到第3组的37.7%(26.9–49.4),n = 29/77。疼痛是每组中最常报告的请求注射部位反应(组间范围为20.0%[11.6–30.8]至35.7[26.9–45.1])。诱发全身反应的频率范围从第5组的21.3%(12.7–32.3),n = 16/75到第3组的39.0%(28.0–50.8),n = 30/77。头痛、不适和肌痛是最常被报道的系统性反应。任何注射后3级诱发反应的发生率较低,第3组报告了1例3级注射部位反应(1.3%[95% CI 0.0–7.0]),各组间3级诱发全身反应的发生率为0.0%(0.0–4.8)至3.9%(0.8–11.0)。
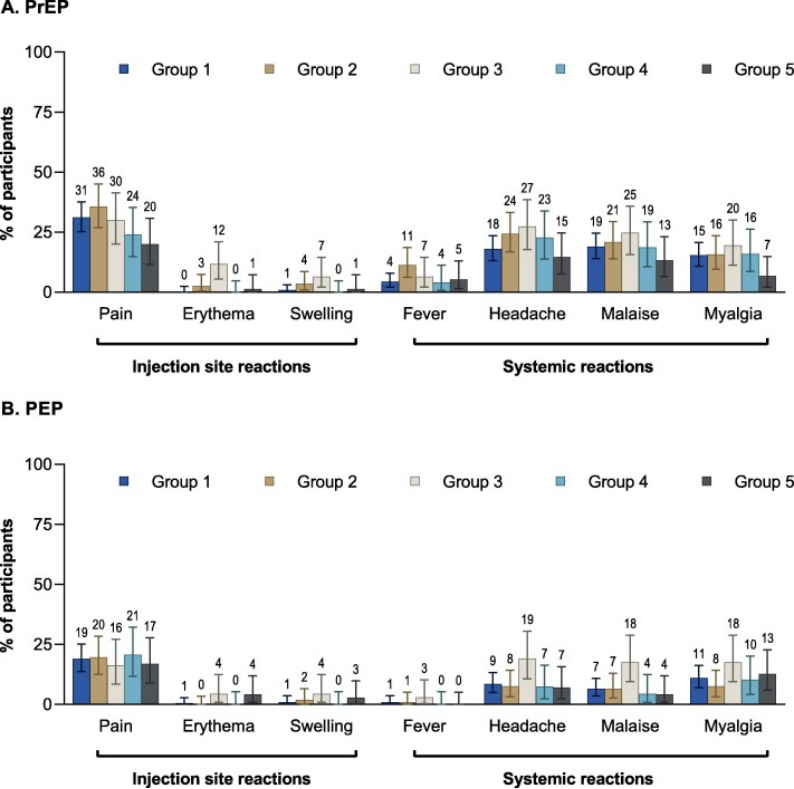
图4. 在(A)PrEP和(B) PEP疫苗接种期间,在任何注射后7天内发生的请求性不良反应——SafAS误差棒表示95 %置信区间;PEP,暴露后预防;PrEP暴露前预防;第1组,1周HDCV IM接种方案;第2组,3周HDCV IM接种方案;第3组,1周HDCV ID接种方案;第4组,1周PVRV IM接种方案;第5组,1周PVRV ID接种方案。
最后一次暴露前疫苗接种后28天内报告的自发非严重AE(每组< 20 %)或ARs(组间范围为0.9%[0.0–4.7]至2.7%[0.3–9.3])的频率在各组间相似。极少数参与者在第1、2和4组中报告了3级主动提供的非严重AE(≤2.6%),第3和5组中没有报告。第4组报告了1例3级主动非严重AR。没有参与者因AE而退出PrEP阶段。
在模拟PEP阶段(图4B),报告请求注射部位的参与者百分比(95 % CI)在各组间的范围从18.3%(10.1–29.3)到23.5%(14.1–35.4);疼痛是最常见的报告。报告出现请求全身反应的参与者的百分比(95 % CI)范围为12.2%(6.6–19.9)至25.0%(15.3–37.0)。最常报告的诱发全身反应是肌痛、头痛和不适。第2组、第3组和第4组中≤ 1.9 %的受试者报告了3级恳求反应,而第1组和第5组中无报告。每组中报告请求注射部位反应的参与者比例在第二剂后趋于下降;在每组中,在第二次接种后,那些报告引发全身反应的患者保持稳定或趋于减少。在每组中,不到5 %的参与者在最后一次PEP疫苗接种后28天内报告了不请自来的非严重AE,并且在所有组中相似。没有一个是三级。在任何组中都没有主动出现非严重不良反应的报告。
第1组中的一名2岁男性参与者在第二次注射PrEP(HDCV)190天后出现了致命的SAE,被诊断为社区获得性肺炎(首选术语,“肺炎”)。研究者评估该致命严重不良事件与研究疫苗无关。在PrEP期和模拟PEP期间,报告了另外两起被认为与研究注射无关的SAE:第2组中的两名(1.7 %)参与者均出现了与妊娠相关的SAE(胎儿宫内死亡和自然流产)。报告了13例妊娠(第1组6例,第2组3例,第3组4例),全部发生在准备接种阶段和模拟PEP之间;因此,他们不被视为暴露于研究产品。在PrEP或PEP疫苗接种阶段(末次疫苗接种后28天内)均未报告导致停药的死亡、SAE或AE。
4. 讨论
这项研究表明,HDCV和PVRV、IM或ID接种的1周和经典的3周PrEP方案在2-64岁的个体中诱导了令人满意的免疫应答。在最后一次疫苗注射后14天的血清转换率方面,未证明第1组相对于第2组的非劣效性(主要目的)。然而,一年后,在模拟PEP后的所有研究组中诱导了强烈的记忆反应,证明了由PrEP赋予的免疫引发的良好的可加强性。无论接种方案或途径如何,HDCV和PVRV都具有良好的安全性。
在目前的研究中,1周PrEP方案的免疫原性支持了一组数据,这些数据显示仅两剂狂犬病疫苗后就有足够的免疫反应和高血清转换率。在的研究中,与第2组(3周)相比,第1组(1周)在最后一次暴露前疫苗接种后14天的血清转换率略低,这可能与未致敏个体的免疫反应动力学有关,反应峰值通常在第一次疫苗接种后2至3周达到。用于比较两组的最后一次PrEP注射后14天的时间点允许第2组(3周+ 14天)比第1组(1周+ 14天)在第一次疫苗接种后有更长的时间达到峰值反应,即与第2组相比,第1组在PrEP后14天的终点可能没有足够的时间达到峰值反应。这至少可以部分解释为什么不能证明非劣性。
另一方面,在所有组中,在模拟PEP后,RVNA滴度迅速增加,除一名参与者外,所有参与者都观察到血清转化,这表明通过IM和ID途径施用HDCV和PVRV的1周PrEP可以有效诱导加强反应。这一发现与来自其他研究的结果一致,这些研究表明,就PEP疫苗接种后引发强有力的既往应答而言,短时间的1周、单次或2次就诊的PrEP方案(ID或IM接种)与长时间的3周或4周、3次就诊的方案一样有效。此外,de Pijper等人的一项小型观察性研究表明,即使在初次免疫接种后10年以上进行加强免疫接种,情况也是如此。一些先前的报告,包括对当前狂犬病疫苗免疫原性研究的综述,表明IM接种方案诱导更高的免疫原性抗体滴度而不考虑接种疫苗的参与者的年龄,但是这些差异在临床上并不相关。在该研究中,对于HDCV和PVRV,在PrEP中ID方案后的GMT略高,在模拟PEP中IM方案后的GMT略高于ID方案,尽管当在Y1 + 14时间点比较IM PVRV和ID PVRV时有重叠的96% CIs。观察到的GMT水平的微小差异没有临床意义,也不太可能影响保护。该结果还显示,与HDCV 1周PrEP ID组相比,PVRV组有较高GMT的趋势。更高的数量级抗体反应由于与0.1 mL HDCV剂量(全剂量的十分之一)相比,0.1 mL PVRV剂量(全剂量的五分之一)具有更大的测得效力,因此与HDCV ID组相比,在ID PVRV组中可能是预期的。值得注意的是,使用皮内接种提供的较小体积的简化狂犬病PrEP方案可能因此促进广泛的暴露前预防,作为高度狂犬病流行环境中现有儿童疫苗接种计划的一部分。
在所有研究组中,随着年龄的增加,在最后一次PrEP注射后14天,GMT和血清转换率有降低的趋势,并且这种趋势一直保持到Y1。这是意料之中的,因为在儿童研究中报道的GMT通常高于成人,并且可能与进行性相关免疫衰老。然而,这些变化与年龄的相关性可能是有限的,因为所有参与者,包括最大年龄组中的参与者(除了组5中的一名参与者)对短期模拟PEP具有快速和强有力的既往反应,使得所有人在第7天血清转化,无论HDCV或PVRV是否用于PrEP或是否通过IM或id注射接种。研究中使用的RFFIT测试之前已经过优化,以提高检测灵敏度和减少主观性,并经过充分验证,以确保稳健性。然而,众所周知,RFFIT受包括校准品在内的多种因素影响,并且在方法规范中经常观察到不同实验室之间的差异,很难将这些结果与以前的研究结果进行比较。
任何研究组都没有HDCV或PVRV的安全性问题。总的来说,使用HDCV或PVRV通过IM和ID途径进行的PrEP和模拟PEP注射具有良好的耐受性和良好的安全性。各组之间任何一次注射后的安全性相似。不同年龄组(2-11岁、12-17岁和18-64岁)的安全性没有显著差异。HDCV和PVRV的安全性和耐受性似乎与以前使用这些疫苗的研究一致。
在模拟PEP方案中显示了对1周PrEP的应答的加强稳定性,但是这些数据没有提供关于在现实世界中对狂犬病的保护程度的信息。另一个限制是比较了第1组开始PrEP后21天和第2组开始PrEP后35天的免疫反应。这是为了在最后一次接种和免疫原性评估之间给出相同的间隔;然而,自第一次接种以来的不同间隔可能加重了这些组中测量的抗体滴度的可变性。
总之,虽然无法证明在最后一次疫苗接种后14天的血清转化方面,1周PrEP方案与经典的3周PrEP方案相比具有非劣效性,但研究结果证明,HDCV和PVRV的1周PrEP方案(IM和ID)在各年龄组(2-64岁)中提供了有效的初始免疫,使得在模拟PEP疫苗接种后能够产生快速而有力的记忆反应。
来源:One-week intramuscular or intradermal pre-exposure prophylaxis with human diploid cell vaccine or Vero cell rabies vaccine, followed by simulated post-exposure prophylaxis at one year: A phase III, open-label, randomized, controlled trial to assess immunogenicity and safety
Vaccine. 2022 Aug 3;S0264-410X(22)00923-9. doi: 10.1016/j.vaccine.2022.07.037. Online ahead of print.
https://m.sciencenet.cn/blog-55647-1350429.html
上一篇:218 疫情导致儿童疫苗接种率大幅降低
下一篇:220 犹豫疫苗接种的时刻