博文
[转载]The Innovation | CRISPR/Cas9体系编辑线粒体DNA的直接证据
||
导 读
研发精准高效的线粒体DNA(mitochondrial DNA, mtDNA)基因编辑方法,一直是相关领域关注的热点和难题,对治疗线粒体疾病具有重要的意义。随着基因编辑技术的发展,目前已经可以通过向线粒体靶向转导DNA酶(如TALEN、ZFN等)或单碱基编辑器,实现部分mtDNA分子的编辑。但是,近年来广泛用于核基因编辑的CRISPR/Cas9体系是否可以编辑mtDNA,一直备受争议。近期,中国科学院昆明动物研究所姚永刚团队,通过建立线粒体靶向的CRISPR/Cas9体系,对细胞内的mtDNA分子进行编辑,并通过三代测序技术直接验证到成功编辑后的mtDNA分子,这为CRISPR/Cas9体系可以编辑mtDNA提供了最直接的实验证据。
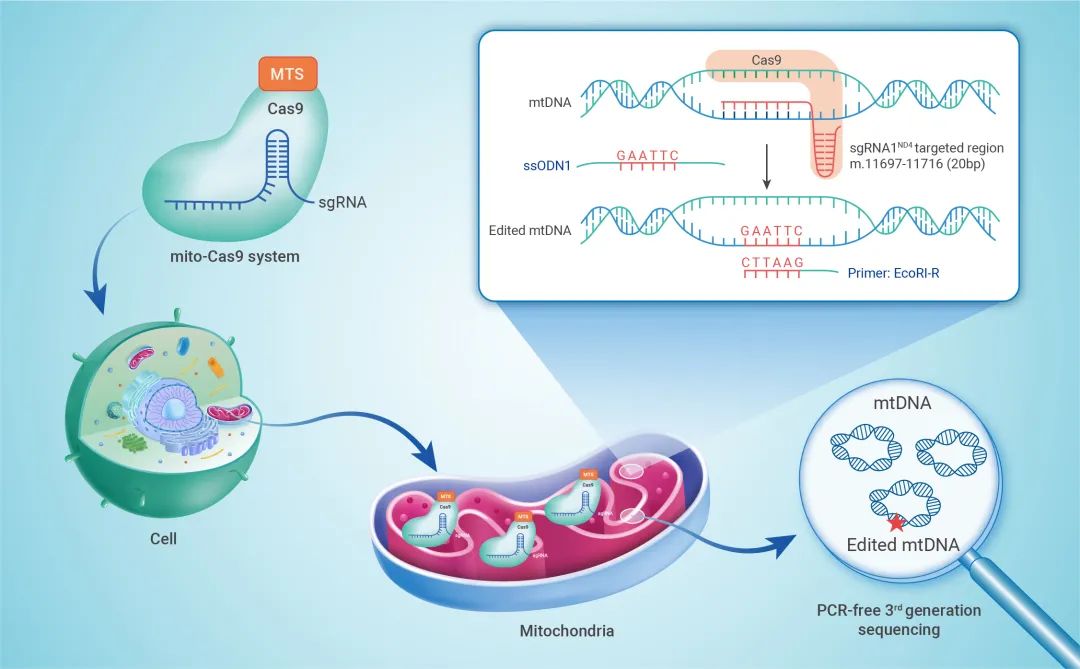
图1 靶向线粒体的CRISPR/Cas9体系可成功编辑细胞内线粒体的mtDNA分子
线粒体是细胞的能量代谢枢纽和信号转导交汇站,其功能异常往往会影响高耗能的组织器官(如神经和肌肉组织),也与其他细胞功能如抗病毒效应等密切相关。线粒体DNA(mitochondrial DNA, mtDNA)是线粒体中独立于核基因组的一套遗传物质。每个细胞根据自身功能的不同,可含有成百上万个mtDNA分子,其中部分mtDNA突变,构成了细胞内mtDNA分子的异质性。mtDNA突变被发现与多种疾病相关(包括神经退行性疾病、耳聋、肌肉萎缩等),目前这类疾病尚无有效的治疗方法。
随着基因编辑技术的发展,通过CRISPR/Cas9、单碱基编辑等技术,可实现核基因的高效编辑。但线粒体基因的高效编辑存在诸多难题,主要原因有以下方面:首先,线粒体是细胞中具有双层膜结构包被的细胞器。mtDNA位于线粒体内部,受到线粒体双层膜的保护,外源的基因编辑工具很难高效进入线粒体内部。其次,mtDNA不同于核基因组DNA,缺乏高效的DNA损伤修复机制,一旦受到双链断裂损伤,就会被降解。最后,根据细胞类型与功能的不同,每个细胞中mtDNA的拷贝数从几百到几万个不等,要同时实现对细胞中大多数mtDNA分子进行精准高效的编辑,是一个非常有挑战的难题。
幸运的是,多个研究团队研发了线粒体靶向定位的DNA酶(如TALEN、ZFN等),可以改变胞内mtDNA突变异质性的比例。近期研发的mtDNA单碱基编辑体系,也在细胞层次,以及动物和植物体内实现了mtDNA突变的单碱基编辑。由于单碱基编辑体系会改变同一编辑窗口中的其他碱基,导致编辑的精准性不足;同时,现有的mtDNA编辑技术,仅局限于修饰一定类型的基因突变,针对颠换、插入和缺失等类型的mtDNA基因变异,目前尚无解决方案。这些问题,限制了相关基因编辑技术在线粒体疾病动物模型建模和基因治疗等方面的应用。CRISPR/Cas9技术有望克服这些局限性。线粒体靶向的CRISPR/Cas9体系在近期研究中被报道可实现mtDNA的编辑,但这些研究都是基于基因扩增(PCR)的方式,来间接验证mtDNA分子是否被编辑。这一方法不能排除鉴定得到的被编辑的mtDNA分子来源于假阳性扩增的可能性,这也是为何关于CRISPR/Cas9技术能否编辑mtDNA,仍然备受争议的根本原因。
来自姚永刚团队的毕蕊博士等人,通过在Cas9蛋白上游融合线粒体引导肽,下游配置线粒体基因的3'-端非编码(3'-UTR)序列,优化建立了靶向线粒体的CRISPR/Cas9体系mito-Cas9。该体系转染细胞后,可以实现Cas9蛋白和相应的引导RNA(sgRNA)靶向线粒体的转运(图2)。

为了能够更好地检测到编辑后的mtDNA,研究人员在该体系中引入了包含“GAATTC”6个碱基插入的单链DNA(ssODN)同源重组模板,并通过荧光定量PCR的方式,发现mito-Cas9体系可介导“GAATTC”序列成功敲入到mtDNA中,表现为“GAATTC”特异的PCR产物在mito-Cas9体系实验组中显著增加(图3)。
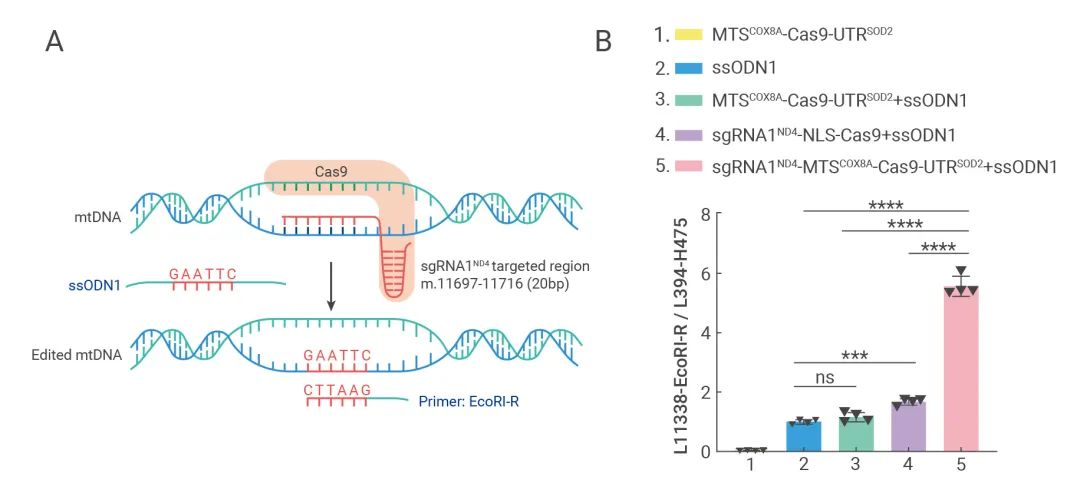
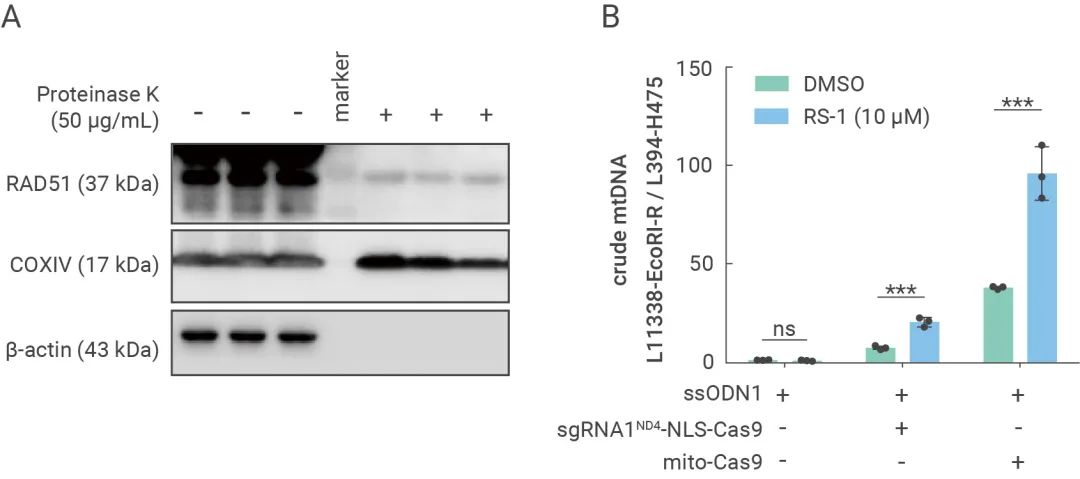
考虑到PCR技术的潜在扩增假阳性问题,研究人员对mito-Cas9体系编辑的细胞,进行了线粒体的提取,并从中分离得到mtDNA,利用PacBio和Nanopore两种三代测序技术,对提取的mtDNA分子进行了直接建库和测序。对测序获得的mtDNA分子全长序列分析后发现,部分mtDNA基因组中含有精准插入的“GAATTC”(图4)。由于采用的三代测序过程中,没有PCR扩增环节,因此,这一结果为mtDNA可以被CRISPR/Cas9体系编辑,提供了最直接的实验证据。

图4 无PCR扩增的三代测序检测到被CRISPR/Cas9体系编辑的mtDNA
为了体现该方法在mtDNA致病突变模型建立中的潜在应用,研究人员通过以上优化的体系,在HEK293T细胞中成功引入了mtDNA的致病变异m.3902_3908inv(图6)。这些结果,提示mito-Cas9体系在建立线粒体疾病细胞模型中具有一定的应用价值。

总结与展望
扫二维码|查看原文

本文内容来自Cell Press合作期刊The Innovation第三卷第六期以Article发表的“Direct evidence of CRISPR/Cas9-mediated mitochondrial genome editing” (投稿: 2022-01-04;接收: 2022-09-23;在线刊出: 2022-09-26)。
DOI: https://doi.org/10.1016/j.xinn.2022.100329
引用格式:Bi R., Li Y., Xu M., et al. (2022). Direct evidence of CRISPR/Cas9-mediated mitochondrial genome editing. The Innovation. 3(6),100329.
作者简介
毕 蕊,中国科学院昆明动物研究所副研究员,硕士生导师。主要从事疾病动物模型创建与阿尔茨海默病的遗传与分子机制研究,围绕细胞能量工厂线粒体相关基因开展了系列研究,发现系列线粒体基因变异影响线粒体功能,增加患病风险。现以第一或通讯作者(含并列)在Am J Hum Genet、Neuropsychopharmacology等国际期刊发表SCI论文18篇。主持国家自然科学基金青年基金和面上项目,入选中国科学院青年创新促进会会员。
期刊简介

扫二维码 | 关注期刊官微
The Innovation是一本由青年科学家与Cell Press于2020年共同创办的综合性英文学术期刊:向科学界展示鼓舞人心的跨学科发现,鼓励研究人员专注于科学的本质和自由探索的初心。作者来自全球48个国家/地区;每期1/4-1/3通讯作者来自海外;已被108个国家/地区作者引用。目前有195位编委会成员,来自21个国家;50%编委来自海外;包含1位诺贝尔奖获得者,33位各国院士;领域覆盖全部自然科学。The Innovation已被DOAJ,ADS,Scopus,PubMed,ESCI,INSPEC等数据库收录。秉承“好文章,多宣传”理念,The Innovation在海内外各平台推广作者文章。
期刊官网1(Owner):
期刊官网2(Publisher):
www.cell.com/the-innovation/home
期刊投稿(Submission):
www.editorialmanager.com/the-innovation
商务合作(Marketing):
marketing@the-innovation.org
https://m.sciencenet.cn/blog-68410-1360494.html
上一篇:[转载]The Innovation | 钯膜反应器的新应用:优势与挑战
下一篇:[转载]The Innovation | 结构重构助力理想丙烯/丙烷分离膜制备