博文
特殊的RNA抑制乳腺癌细胞的形成
 精选
精选
||
特殊的RNA抑制乳腺癌细胞的形成
诸平
据德国耶拿弗里德里希-席勒大学(Friedrich Schiller University Jena, Hans-Knöll-Str. 2, Jena, Germany)2024年1月16日提供的消息,特殊的RNA抑制乳腺癌细胞的形成(Special RNA suppresses the formation of breast cancer cells)。
乳腺癌是女性中最常见的癌症。乳腺癌的发展通常源于乳腺上皮细胞(epithelial cells in the mammary gland)——正是这些细胞在怀孕期间和怀孕后专门分泌乳汁。来自耶拿弗里德里希-席勒大学、中国深圳大学医学院(Shenzhen University Medical School, Shenzhen, China)和耶拿大学医院(Jena University Hospital, Am Klinikum 1, Jena, Germany)的一组研究人员仔细研究了这一专业化过程,并破译了一种在癌症发展中似乎也起重要作用的分子机制。基于这些研究结果,有可能开发出新的乳腺癌诊断程序和治疗方法。相关研究结果于2024年1月4日已经在科学杂志《细胞报告》(Cell Reports)上发表了他们的研究成果。详见Sijia Ren, Feng Bai, Viviane Schnell, Clara Stanko, Muriel Ritsch, Tino Schenk, Emanuel Barth, Manja Marz, Bin Wang, Xin-Hai Pei, Holger Bierhoff. PAPAS promotes differentiation of mammary epithelial cells and suppresses breast carcinogenesis. Cell Reports, 2024, 43(1): 113644. DOI: 10.1016/j.celrep.2023.113644. Available online 4 January 2024.
参与此项研究的除了来自德国耶拿弗里德里希-席勒大学,还有来自中国深圳大学医学院(Shenzhen University Medical School, Shenzhen, China)、中国深圳儿童医院(Shenzhen Children’s Hospital, Shenzhen, China);德国莱布尼茨老龄研究所-弗里茨·李普曼研究所(Leibniz-Institute on Aging–Fritz Lipmann Institute简称FLI, Beutenbergstr. 11, Jena, Germany)以及耶拿大学医院的研究人员。
开启和关闭RNA合成(Switching RNA synthesis on and off)
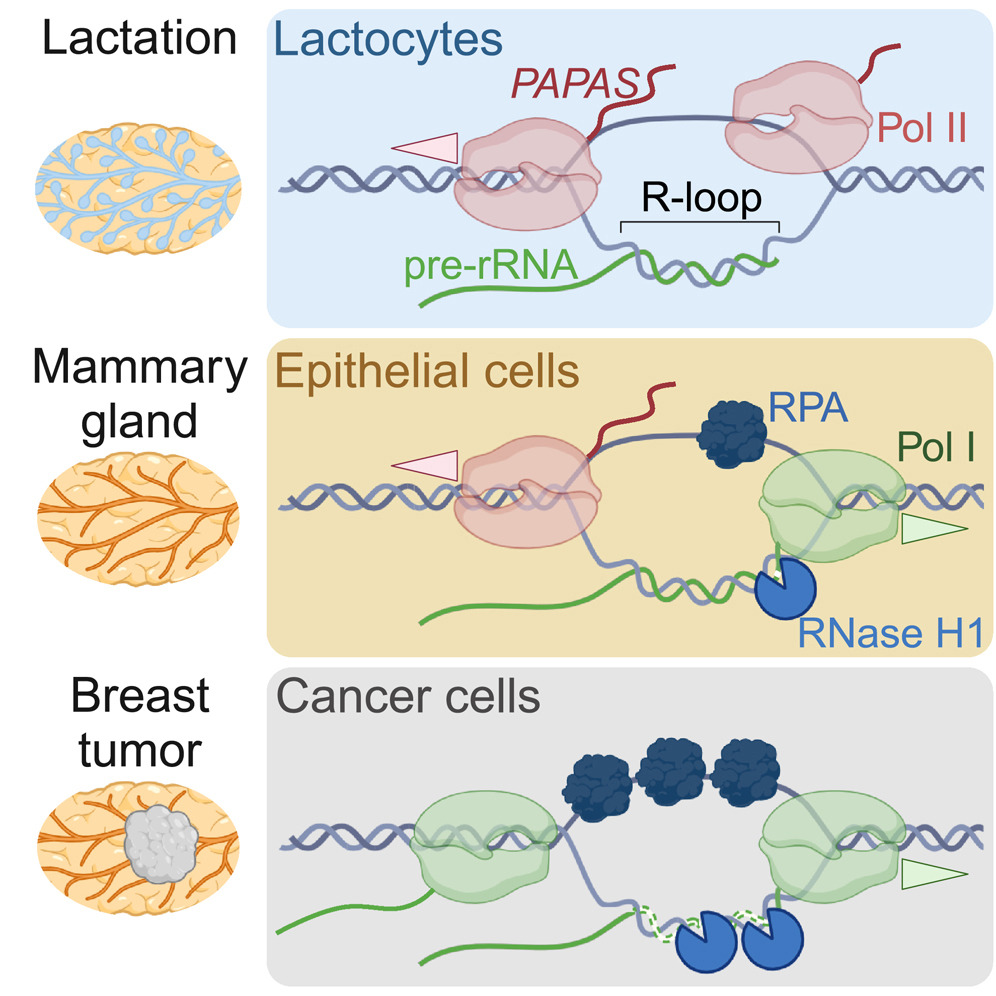
细胞分化(Cell Differentiation),即细胞的特化,是生物体的重要组成部分——只有通过这种特化,细胞才能承担不同的任务。在乳生成过程——由激素触发使乳腺产生乳汁的过程中——相关细胞首先繁殖。所需的蛋白质由核糖体(ribosomes)产生。核糖体的基本组成部分是核糖体RNA(ribosomal RNA),简称rRNA。如果需要更多的蛋白质,对rRNA的需求也会增加,其在细胞核中的合成也会相应增加。在乳生成结束时,特化细胞停止生长并再次减少rRNA合成。这种调控机制发生在表观遗传水平上,这意味着改变的不是DNA本身,而是它的包装,这是另一种RNA负责的。
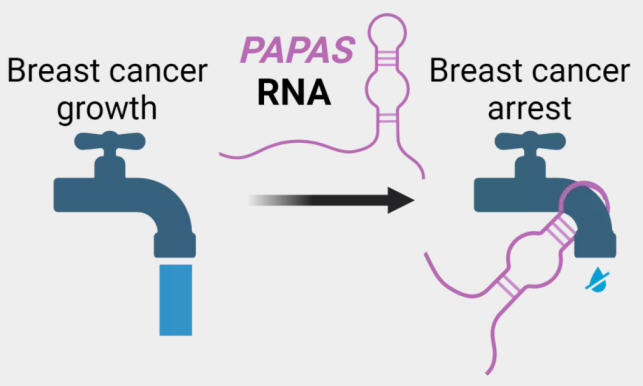
耶拿大学该项目的负责人霍尔格·比埃尔霍夫博士(Dr Holger Bierhoff)解释说:“我们已经发现了一种叫做PAPAS的长链非编码RNA,这是我几年前发现的,它作用于DNA的包装,减少rRNA的产生。更准确地说,PAPAS影响DNA活性区域的进入,并决定这些区域是否被复制成RNA。如果需要大量的核糖体和蛋白质,从而需要大量的rRNA,则会减少PAPAS的合成。如果要停止此过程,则增加PAPAS水平。”
耶拿的专家们还发现,PAPAS不仅在细胞增殖中起着重要作用,而且在特化中也起着重要作用。霍尔格·比埃尔霍夫说:“当我们通过基因操作关闭细胞中的PAPAS时,我们观察到,触及产奶细胞的发育不再正常。”
高PAPAS水平-低肿瘤生长(High PAPAS level - low tumour growth)
癌细胞中rRNA的合成也增加了,因为它们繁殖迅速,需要大量的蛋白质——相应地也需要大量的核糖体。“因此,我们问自己,我们观察到的调节机制是否也在乳腺癌的发展中发挥作用。答案显然是肯定的,”细胞生物学家霍尔格·比埃尔霍夫解释说。“当我们减少PAPAS合成并关闭细胞特化时,我们观察到这些细胞发展出了癌细胞的特征。”相比之下,研究人员在细胞培养和小鼠实验中发现,高水平的PAPAS可以减少肿瘤的生长和转移扩散。
但是癌细胞是如何设法关闭PAPAS的产生从而促进rRNA合成的呢? 霍尔格·比埃尔霍夫解释说:“我们还发现了一种机制,PAPAS的产生需要一个位于PAPAS基因开头的分子信号。这种信号结构受到特定蛋白质的调节,这些蛋白质可以分解或阻断这种结构。我们观察到这些蛋白质在乳腺癌细胞中的产量特别高。肿瘤越具有侵袭性,它们出现的就越多。”
耶拿的研究人员正在开发RNA疗法(Jena researchers are developing RNA therapy)
对于霍尔格·比埃尔霍夫来说,研究结果在两个方面是有希望的:“首先,我们看到PAPAS可以成为评估乳腺肿瘤侵袭性的有趣标记。这些信息可能被用作诊断工具,”他说。“其次,我们已经在致力于开发一种用于癌症治疗的RNA疗法(RNA therapy)。我们知道PAPAS调节rRNA合成的机制,我们也知道这需要RNA的哪个区域。现在,我们的想法是人工制造PAPAS的这一部分,将其包装在纳米颗粒中,并将其引入癌细胞,从而恢复其功能。通过这种方式,我们将减少癌症增殖所需的rRNA合成。”这种策略将类似于mRNA疫苗(mRNA vaccines),比如针对Covid-19的疫苗。然而,这里将应用调控RNA而不是蛋白质编码RNA。
本研究得到了深圳大学-耶拿弗里德里希-席勒大学生物医学联合博士点{SZU-FSU(Friedrich Schiller University)joint PhD Program in Biomedical Sciences}、中国国家自然科学基金会(National Natural Science Foundation of China 81972637)、中国广东省基础与应用基础研究基金项目(Guangdong Basic and Applied Basic Research Foundation 2019A1515011343)、中国深圳市科技计划项目(Shenzhen Science and Technology Program (JCYJ20190808115603580 and JCYJ20210324094611032) 、深圳大学(Shenzhen University)以及德国科学基金会(DFG SCHE1909/2-1)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
• The lncRNA PAPAS represses rRNA gene activity in mammary epithelial cells (MECs)
• Upregulation of PAPAS is required for lactogenic differentiation of MECs
• Breast cancer cells curb R-loop-dependent PAPAS synthesis
• Reconstitution of PAPAS in breast cancer suppresses tumor growth and metastasis
Extensive remodeling of the female mammary epithelium during development and pregnancy has been linked to cancer susceptibility. The faithful response of mammary epithelial cells (MECs) to hormone signaling is key to avoiding breast cancer development. Here, we show that lactogenic differentiation of murine MECs requires silencing of genes encoding ribosomal RNA (rRNA) by the antisense transcript PAPAS. Accordingly, knockdown of PAPAS derepresses rRNA genes, attenuates the response to lactogenic hormones, and induces malignant transformation. Restoring PAPAS levels in breast cancer cells reduces tumorigenicity and lung invasion and activates many interferon-regulated genes previously linked to metastasis suppression. Mechanistically, PAPAS transcription depends on R-loop formation at the 3′ end of rRNA genes, which is repressed by RNase H1 and replication protein A (RPA) overexpression in breast cancer cells. Depletion of PAPAS and upregulation of RNase H1 and RPA in human breast cancer underpin the clinical relevance of our findings.
https://m.sciencenet.cn/blog-212210-1418373.html
上一篇:打破物理学:对宇宙缺失碎片的激进探索
下一篇:重新思考H2O:水分子的发现与教科书模型相矛盾