博文
病毒的变与“不变”
|
病毒的变与“不变”
病毒作为严格寄生于宿主的生命体,为适应宿主的环境,通过突变改变其遗传信息来产生新的表型是其重要手段。尤其对于RNA病毒,由于其编码基因的限制(拥有最大病毒基因组的冠状病毒,基因组大小约30kb),突变成为其适应宿主、进化的重要途径。
病毒的突变机制
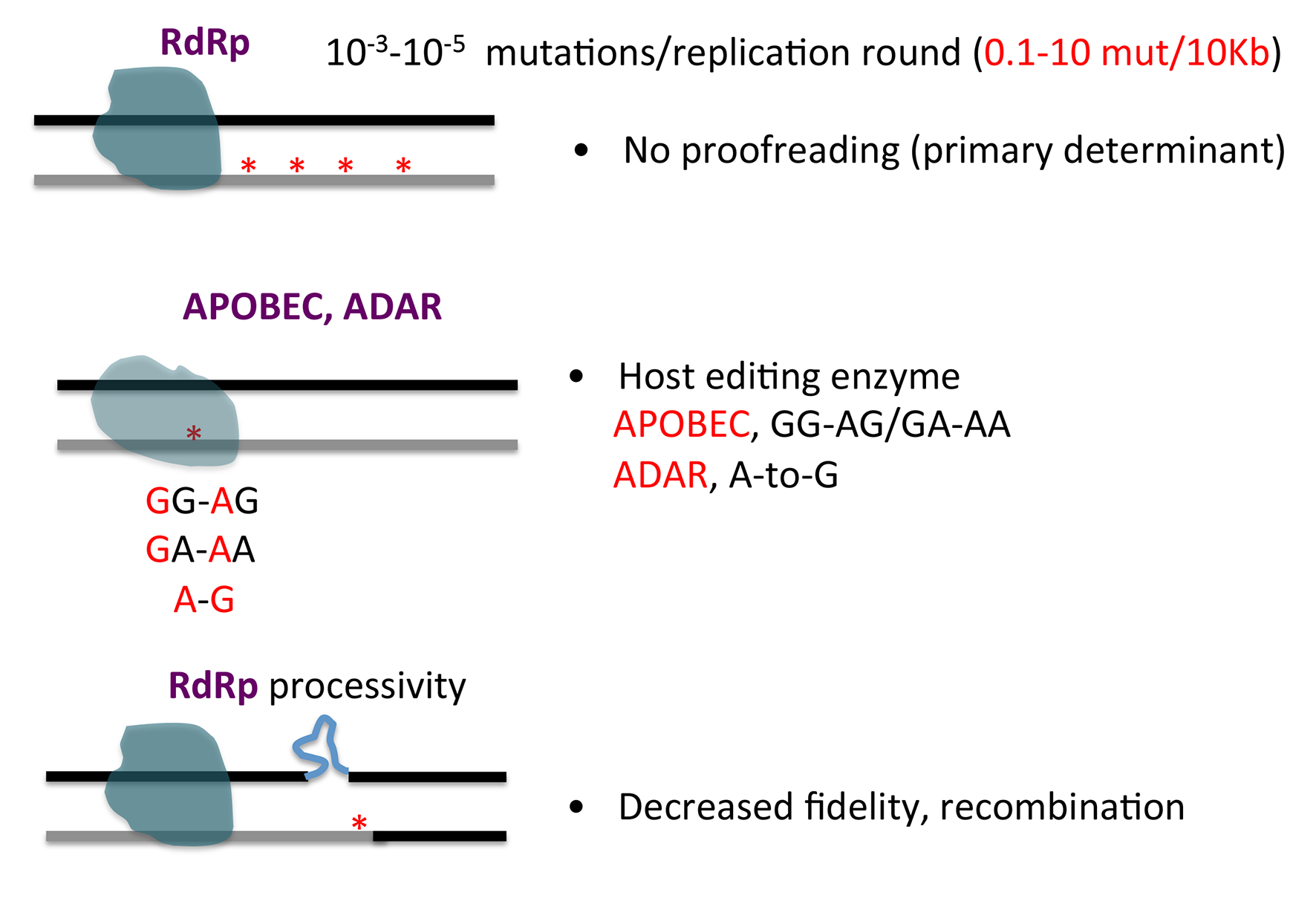
病毒的突变来源于多种机制(如下图所示),比如RNA病毒,遵守中心法则,其基因组复制过程所包含的RNA到RNA的转录及复制过程往往不能利用宿主已有的聚合酶,因此自身编码RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)。 RdRp不同于DNA聚合酶,没有3'-5'核酸外切酶活性,因此在复制过程中不能完成碱基错配修复功能,使得复制的保真性(fidelity)下降,易产生突变。实验数据估算,以长度为10kb的病毒基因组为例,病毒的RdRp每进行一轮复制,产生约0.1-10个突变。同时RNA病毒基因组上的特殊的二级或三级结构,会改变RdRp在模板上的进行性(processivity),导致复制酶保真性的降低,产生突变;或者导致复制酶在模板上的跳跃,产生重组(recombination)。除此之外,宿主细胞里的编辑酶如APOBEC (Apolipoprotein B mRNA editing enzyme catalytic polypeptide like )家族蛋白及ADAR家族蛋白,能编辑特定碱基,产生突变。宿主细胞内复制原料如4种核糖核酸的水平的不平衡也会影响RdRp复制的准确性,产生突变。
病毒的序列空间 (sequence space)
通过多轮病毒复制,随机突变的积累,使得病毒基因组的可能性大大增加,理论计算,以一个基因组长度为n的病毒为例,其病毒基因组有4n种可能性 (如下图所示)。这些所有可能的病毒基因组结合可以看成一个病毒序列空间(sequence space)。但由于病毒复制周期完成所需要的各种组装、相互作用的限制,使得最终能维持病毒复制周期,能容忍的病毒序列(Viable space)组合大大降低。也因此成为病毒突变的边界:突变不能杀死病毒自身。

病毒的适应力(Fitness)
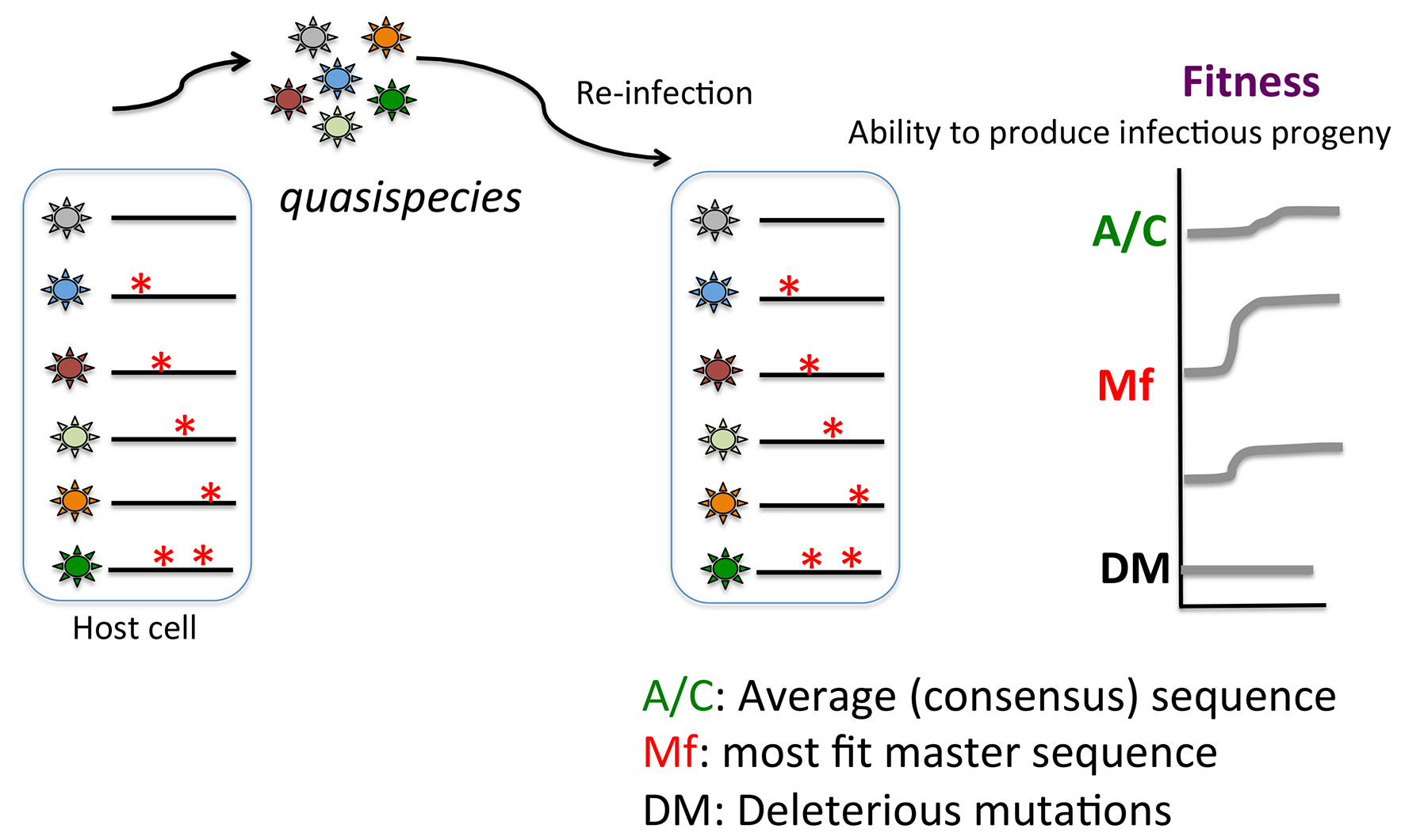
由于突变的存在,对于某一个病毒而言,其基因组包含的所有能容忍的病毒序列,各基因序列产生的病毒以一个群体(population)存在,这个群体里的各个病毒也被称为准种(quasispecies)(如下图所示)。病毒序列的多样性赋予表型的多样性,为应对宿主的选择压力提供更多可能性。当这些病毒包装释放后,再次感染新的宿主细胞,其在宿主细胞中表现出不同的适应力(Fitness)。病毒的适应力可以通过实验,测定病毒在特定宿主产生子代病毒的能力来评价。对于病毒的不同准种,其适应力各有不同。有表现最佳(most fit)的序列,或者有有害的突变(deleterious mutant)导致适应力大大下降。一般而言,病毒的平均序列或者共有序列(consensus sequence)的适应力往往不等于或者小于最佳序列的适应力。
病毒适应力的丢失 (Fitness loss)
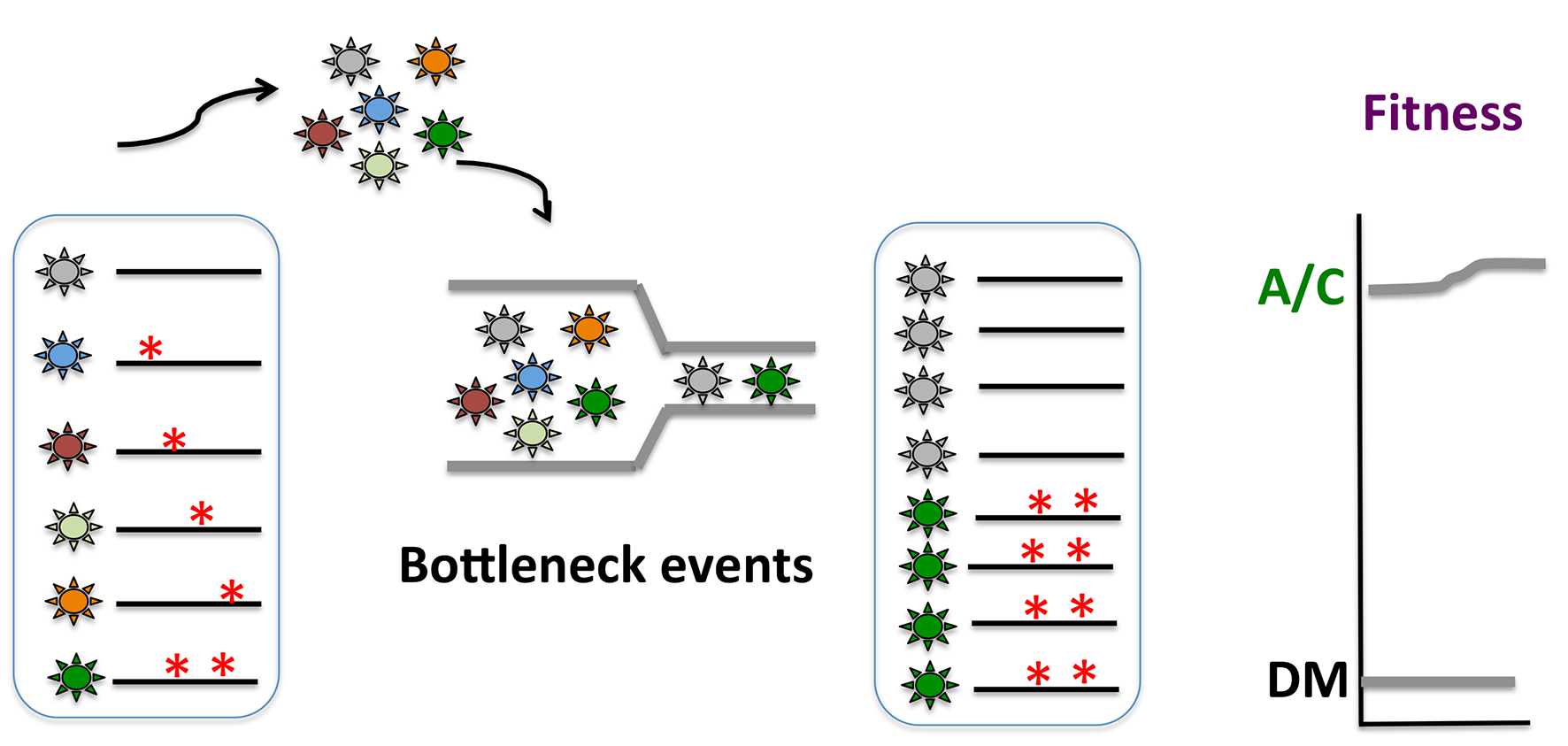
一种病毒在宿主细胞进行连续传代或者在不同宿主间进行传播时,病毒各准种组成的整个病毒群体由于“瓶颈效应”(bottleneck)的作用,导致整体适应力的降低,这个过程也被称为Muller’s Ratchet效应(如下图所示)。产生这一效应的原因是因为在病毒连续传代或者传播过程中,仅有部分的准种被选择,从而导致没被选者的准种的丢失以及其适应力的丢失。极端的瓶颈效应来自于病毒的空斑纯化(每次仅选择1到数个克隆)。通过连续传代导致的病毒适应力的降低最终可能导致病毒致病力的削弱,这也是生产减毒疫苗的一种策略。
病毒适应力的获得(Fitness gain)
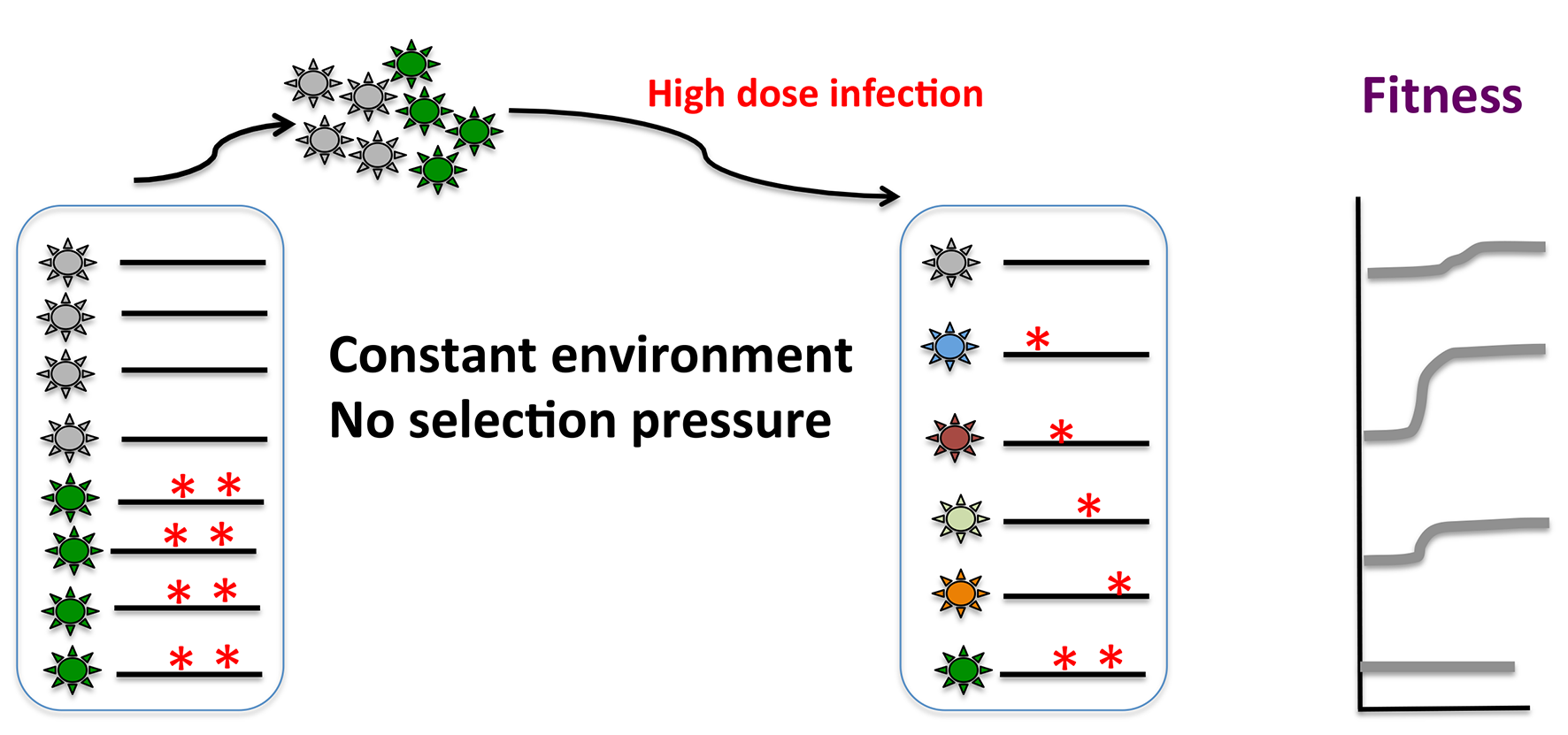
适应力低的病毒在某些情况下通过进化可以重新获得较强的适应力。如下图所示,比如在恒定的宿主环境,在没有选择压力或者较低的选择压力的情况下,高剂量的病毒感染宿主后,病毒通过突变以及各准种间的竞争,可产生适应力提高的新准种,导致整个病毒群体适应力的增加。此效应在实际应用中,比如减毒疫苗的生产中,提示应该尽量减少扩增过程,防止产生适应力更高的病毒,导致病毒毒力上升。
病毒传播方式与瓶颈效应
不同的病毒传播方式,由于传播剂量的不同,其产生的瓶颈效应不同。如下图所示,有研究以甲型流感病毒为例,发现通过空气传播,可能由于气溶胶中的病毒剂量低,其瓶颈效应显著,导致最终仅有极少数病毒准种能建立感染,在被感染的宿主中被检测到。但以接触传播(滴鼻)的方式,由于病毒的高剂量,瓶颈效应弱,最终大部分病毒准种均能建立感染,在被感染宿主中被检测到。
瓶颈效应与病毒毒力的进化
如上所述,瓶颈效应的存在导致病毒适应力的丢失。病毒在人群中传播,其与病毒毒力的进化如何?以空气传播的病毒为例,如下图所示,如果通过感染过程(气溶胶传播)中的瓶颈效应,导致高致病性(Highly pathogenic, HP)准种的感染,其后果可能不幸导致宿主的死亡或者宿主容易被发现、治愈;最后的结果是该高致病性的准种在人群中的比例大大降低,最后直至消亡。反之,如果瓶颈效应筛选的是低致病(Low pathogenic, LP)的准种,被感染的宿主表现为轻症或者无症状,其被发现的难度增加,病毒传播链延长,最后在人群中这类低致病的准种占据优势。因此,病毒整体的致病性或者毒力随着在人群中的传播逐步降低。
另一方面,仍然以呼吸道传播的病毒为例,病毒传播过程中的瓶颈效应还包括感染部位的选择,如下图所示,病毒感染的部位可能包括上呼吸道(Upper Respiratory Tract, URT)及下呼吸道(Low Respiratory Tract, LRT)感染。上呼吸道会筛选能在上呼吸高效感染的病毒准种(URT-favored),比如含有对上呼吸道上皮细胞更有亲和力的病毒;下呼吸道会筛选能在下呼吸高效感染的病毒准种(URT-favored)。相对而言,上呼吸的感染比下呼吸的感染和传播更高效,因此,在传播过程中,更容易感染上呼吸道的病毒准种在人群中的占比会逐步增加。由于上呼吸道的感染相比下呼吸道感染,其致病弱,也因此,病毒整体的致病性或者毒力随着在人群中的传播逐步降低。
宿主选择压力与病毒毒力的进化
如下图所示,病毒在宿主体内复制及传播面临选者压力,选择出更适应宿主的病毒准种(more-fit);同时新的突变受到如前所述的内在限制(如病毒组装及相互作用),使得新的突变不能很大程度的削弱病毒自身的复制及包装能力。内在限制弱的病毒区域可能有更高的突变可能;反之,参与病毒组装及相互作用的区域相对保守。宿主的选择压力与病毒的内在限制共同作用,使得病毒的序列空间进一步压缩。
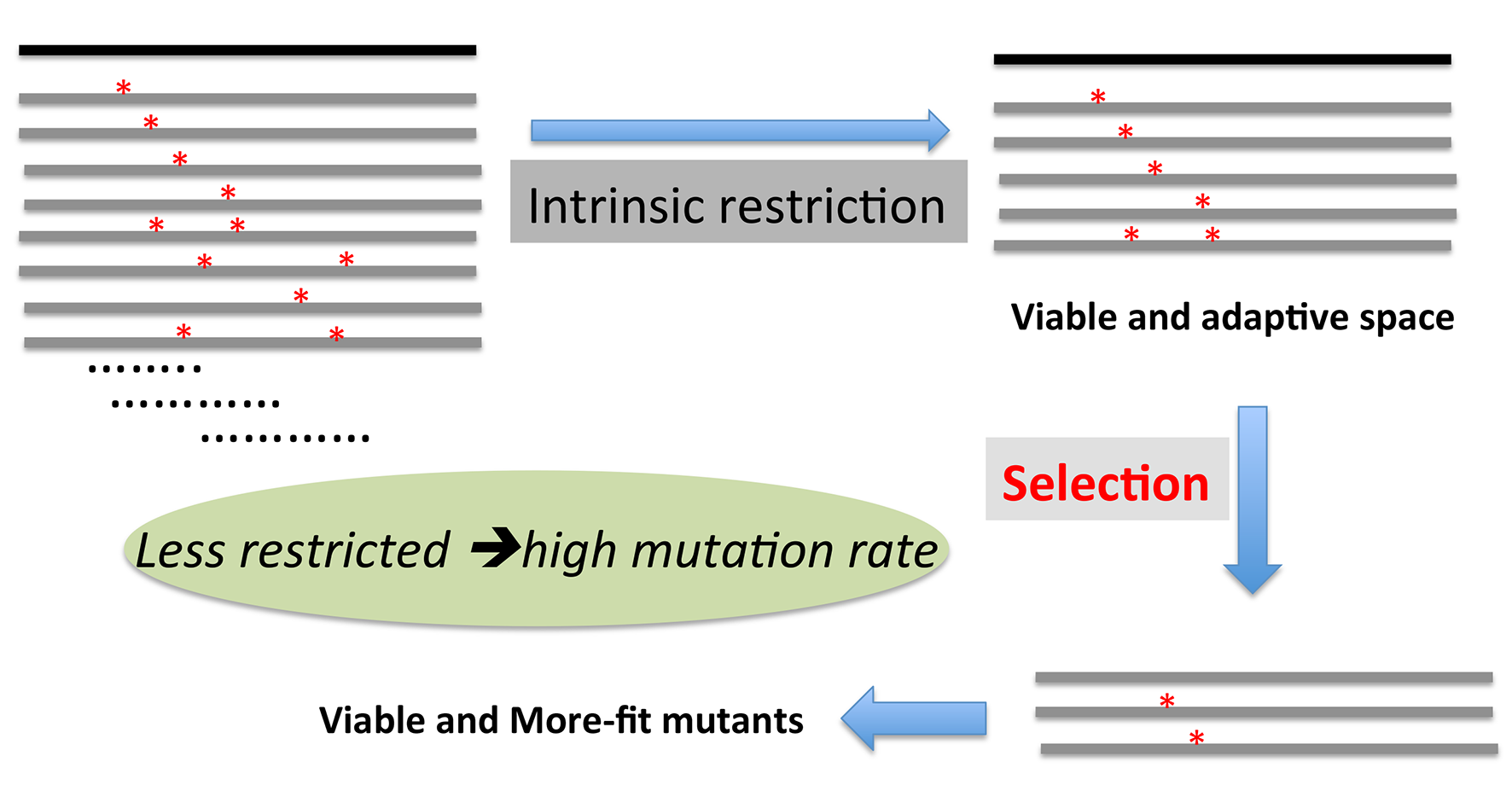
在人群中,如下图所示,随着病毒的传播导致的感染或者疫苗的推行形成的群体免疫压力(包括B细胞免疫及T细胞免疫),使得突破免疫压力需要产生的病毒突变不可避免以牺牲病毒的复制及包装为代价,结果造成病毒序列空间大大压缩,病毒的整体适应力急剧下降,最终导致病毒传播的逐步削弱或者消亡。
社会行为与病毒传播
认识到病毒传播中的瓶颈效应以及其对病毒毒力及致病性的影响,可以指导病毒传播的防控。如下所示,高剂量的病毒感染由于瓶颈效应较弱,可能不会导致病毒适应力的降低,反而可能通过进化,导致病毒适应力的增强。因此应该防止病毒直接接触的感染方式(比如无防护的密切接触,高强度的密切接触)。对于空气传播方式,大大降低气溶胶中病毒的含量(比如通风、口罩),可以在空气传播瓶颈效应的基础上更进一步降低感染几率或者削弱病毒的适应力以及毒力。
总之,病毒的传播和进化遵循客观规律,理解这些规律有助于增加人们的智慧,更从容的控制病毒传播。
2022年3月31日于上海浦西
参考文献:
1. E. Domingo, J. J. Holland. RNA virus mutations and fitness for survival. Annu. Rev. Microbiol. 1997, 51:151–78
2. JT. McCrone, AS. Lauring. Genetic bottlenecks in intraspecies virus transmission. Current Opinion in Virology, 2018, 28: 20-25
3. A. Varble, RA. Albrecht, S. Backes, et al. Influenza A Virus Transmission Bottlenecks Are Defined by Infection Route and Recipient Host. Cell Host & Microbe, 2014: 16: 691–700
4. R. Sanjuan, P. Domingo-Calap. Mechanisms of viral mutation. Cell. Mol. Life Sci, 2016 73:4433–4448
5. R. Geller, P. Domingo-Calap, JM. Cuevas, et al. The external domains of the HIV-1 envelope are a mutational cold spot. Nat. Commun, 2015, 6:8571
6. EA. Duarte, DK. Clarke, A. Moya, et al. Many-Trillionfold Amplification of Single RNA Virus Particles Fails To Overcome the Muller's Ratchet Effect. J Virol, 1993, 67(6): 3620-3623
7. IS. Novella, EA. Duarte, SF. Elena, et al. Exponential increases of RNA virus fitness during large population transmissions. Proc. Natl. Acad. Sci. USA, 1995, 92: 5841-5844
https://m.sciencenet.cn/blog-3386930-1331744.html
上一篇:我们需要发表什么样的文章
下一篇:不要“赖搞”