博文
热容与熵增原理在热力学中的几点应用
|
本文拟介绍热容与熵增原理在热力学中的几点应用,供参考.
热容( C)
热容是指纯pVT变化中,系统温度每变化1℃(或1K)所吸收(或释放)的热量,热容的定义式参见如下
式(1):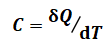 (1)
(1)
根据测量条件不同,可将系统热容(C)分为定压热容(Cp)与定容热容(CV)两种类型.
热容是容量性质,与物质的量有关;为研究方便,热力学又引入摩尔定压热容(Cp,m)与摩尔定容热容
(CV,m).
备注:纯pVT变化指无化学反应(或相变)发生的热力学过程, 下同.
1.1 摩尔定压热容(Cp,m)
恒压条件下,对于纯pVT变化,1摩尔某物质温度每变化1℃(或1K)所吸收(或释放)的热量,称该物质
的摩尔定压热容(Cp,m);可表示为: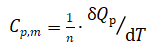 (2)
(2)
1.2 摩尔定容热容(CV,m)
恒容条件下,对于纯pVT变化,1摩尔某物质温度每变化1℃(或1K)所吸收(或释放)的热量,称该物质
的摩尔定容热容(CV,m);可表示为: (3)
(3)
由式(2)可得恒压条件下的纯pVT变化: (4)
(4)
由式(3)可得恒容条件下的纯pVT变化: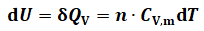 (5)
(5)
通常情况下物质的摩尔定压热容或摩尔定容热容数据已知(或可测),由式(4)及(5)可方便计算出纯
pVT变化过程的恒压热效应(Qp)或恒容热效应(QV).
[例1.]已知CO2(g)的Cp,m={26.75+42.258×10-3(T/K)-14.25×10-6(T/K)2}J·K-1·mol-1
(1)试计算300K至800K间CO2(g)的平均热容 ;
;
(2)1kg常压下的CO2(g)从300K恒压加热至800K时所需的热量(Q)[1]
解:
(1) 由式(4)可得:![]() (6)
(6)
将已知条件代入式(6),并积分可得:
ΔH=Qp
=n·[26.75×(800-300)+42.258×10-3/2×(8002-3002)-14.25×10-6/3×(8003-3003)]J=22692.2nJ (7)
又因为: (8)
(8)
结合式(7)与(8)可得:

(2) n=m/M=1000g/(44g·mol-1)=22.7273mol
将n代入式(8)可得:ΔH=Qp=22692.2×22.7273J=515.7318kJ
2. 熵增原理
熵增原理是指热力学过程发生时,隔离系统的熵永不减少.
如将封闭系统与封闭系统环境构成一新的隔离系统,则: (6)
(6)
式(6)中dSIso表示新建隔离系统熵变;dSClo代表封闭系统熵变;dSAmb代表封闭系统环境的熵变.
热力学通常规定:热力学过程发生在封闭系统内;在整个热力学过程,封闭系统环境的温度、体积、压强
均保持恒定,封闭系统环境获取的全部能量均用于改变其熵. 另需强调式(6)中封闭系统与封闭系统环境角色
固定,不能互换.[2]
依据热力学原理可得: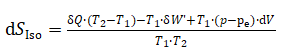 (7)
(7)
对于恒压或恒容条件下,封闭系统内发生的纯pVT变化,δW'=0;T1·(p-pe)·dV=0.
将上述两条件代入式(7),式(7)可被化简为: (8)
(8)
2.1 T2>T1
T2>T1,即环境温度高于封闭系统温度,式(8)结合熵增原理可知:如果封闭系统内纯pVT变化自
发,必需满足:δQ>0, 即封闭系统吸热,表明热量由环境流向封闭系统(热量由高温流向低温).
2.2 T2<T1
T2<T1,即环境温度低于封闭系统温度,式(8)结合熵增原理可知:如果封闭系统内纯pVT变化自
发,必需满足:δQ<0, 即封闭系统放热,表明热量由封闭系统流向环境(热量由高温流向低温).
2.3 T2=T1
T2=T1 ,即环境温度与封闭系统温度相等(也称恒温),代入式(8)可得:dSIso=0,此时封闭系统内
纯pVT变化称可逆过程(或平衡),本质为一状态点;此时热量不发生流动.
3. 结论
⑴对于纯pVT变化, ;
;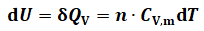 ;
;
⑵恒压(或恒容)条件下,对于纯pVT变化,热量从高温流向低温.
参考文献
[1]天津大学物理化学教研室编. 物理化学(第五版,上册).北京:高等教育出版社,2009,5:46-48.
[2]余高奇. 热力学第二定律研究.http://blog.sciencenet.cn/u/yugaoqi666.科学网博客,2021,8.
https://m.sciencenet.cn/blog-3474471-1373712.html
上一篇:温差是导致热量传递的原因吗?
下一篇:准静态过程与平均摩尔定压热容