博文
浅析热力学标态反应的实现途径
|
本文拟结合准静态过程假说,介绍理论上热力学标态反应的实现途径,供参考.
标准状态
标准状态是系统的特定存在状态,它要求系统中所有物种均处于标准状态. 具体要求如下:
气相物种:分压为100kPa的纯净物;
液相(或固相)物种:100kPa外压作用下的纯净物;
溶液:溶剂为100kPa作用下的纯净物,溶质活度为1(c=1mol·dm-3 或1mol·kg-1).
热力学标态反应
热力学标态反应是指某温度下,参加反应的所有物种,在整个反应进程,均处于标准状态.
例如:标态下金属锌与稀硫酸反应.
Zn(s)+2H+(aq)=Zn2+(aq)+H2(g) (1)
标态反应,要求整个反应过程,式(1)必须同时满足:
Zn(s)为纯净物;H2(g)分压为100kPa;H+(aq),Zn2+(aq)的活度均为1.
热力学标态反应的实现
需明确: 标态反应要求整个反应进程, 参与反应的所有物种均处于标准状态, 并且温度恒定,这与化学反应
的物理本质不符.
为理论上实现热力学标态反应, 准静态过程假说提供了热力学标准反应器,即:范特霍夫平衡箱. 参见如下
图1[1].
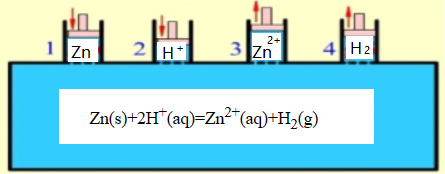
图1.范特霍夫平衡箱示意图
图1中范特霍夫平衡箱通常体积无限大,反应物与生成物的物质的量也无限多,温度、压强
(或容积)均恒定,并且反应已经建立了平衡;此时由加料口1及2分别加入25℃、1摩尔的纯金属
Zn和25℃、2摩尔的浓度为1.0mol·dm-3的反应物H+,反应结束后由出料口3和4分别导出25℃、1摩
尔的浓度为1.0mol·dm-3的生成物Zn2+和25℃、1摩尔的分压为100kPa的生成物H2,实现25℃、标态
下反应进度ξ=1mol的Zn(s)+2H+(aq)=Zn2+(aq)+H2(g)反应.
由于加入和导出的反应物或生成物的物质的量相对于平衡体系而言,基本可忽略,反应进程中平
衡箱的温度与压强(或容积)均可保持恒定,并且平衡体系组成也维持不变.
需明确,范特霍夫平衡箱是一种理想化热力学反应器,客观并不存在;表明热力学标态反应仅为
一理论模型.
4.热力学标态反应的意义
热力学标态反应尽管客观不能实现,但它有助于热力学过程自发性的判定,同时可用来计算化学反应(或
相变)的标准平衡常数、标准电动势及热分解温度等,因此热力学标态反应研究具有重要的理论意义.
5.结论
⑴标态反应要求某恒定温度下,整个反应进程,参与反应的所有物种均处于标准状态;
⑵热力学标态反应仅为一理论模型;
⑶热力学标态反应对热力学过程自发性的判定,计算化学反应(或相变)的标准平衡常数、标准电动势
及热分解温度等具有重要的理论意义.
参考文献
[1]余高奇. 范特霍夫平衡箱-理想热力学反应器. http://blog.sciencenet.cn/u/yugaoqi666. 科学网博客,2023,1.
https://m.sciencenet.cn/blog-3474471-1413355.html
上一篇:克劳修斯不等式的一组热力学推演公式
下一篇:原电池电动势温度系数的合理性探究