博文
生死命悬一分子
 精选
精选
|||
程序性细胞坏死是当前细胞生物学领域的重要方向,启动这一过程的蛋白RIPK1(receptor interactingprotein kinase 1)激酶,但这一蛋白也具有产生细胞凋亡和细胞存活的重要功能。过去曾经尝试用基因敲除的方法来分析这个分子,但是缺乏了该蛋白的动物根本无法存活,只能说明对生命具有重要作用,无法解析其具体功能。因此,科学家一直无法把握这个分子具体发挥的功能是什么。最近CNS等高端期刊,充分利用器官特异性基因敲除这一强大工具,相继对RIPK1的功能发起了攻势,获得了一些有价值的数据,让科学家逐渐了解了这个神秘分子的真面目,研究表明,这个分子确实是决定细胞生死的核心。
对于多细胞生物来说,细胞生死选择十分关键,不仅是形成精细组织结构的手段,也是对抗外来入侵的理想工具。决定细胞生死的蛋白往往是专用的,或者是促进死亡,或者是促进存活,不过科学家们发现,RIPK1是一个能决定细胞生死的双面分子。
这要说一下二十年前的故事,当时科学家已经发现,肿瘤坏死因子是一个能引起细胞凋亡的分子,细胞死亡是依赖多种caspase酶的主动死亡方式,科学家发现,如果将caspase活性全部抑制,确实能减少细胞发生凋亡,如果将这种细胞继续培养,奇怪的是这些细胞很快发生坏死,这种坏死也是一种程序化的死亡方式,与凋亡不同的是细胞发生崩解,这种细胞死亡方式属于坏死,科学家早就在机体内观察到类似现象,只不过原来一直认为这种死亡方式是一种意外,没想到产生这种现象竟然也需要按照计划开展。后来有哈佛大学华人科学家将这种死亡方式定义为程序性细胞坏死。
随着研究的增加,人们逐渐了解到,启动细胞凋亡和坏死的共同分子是RIPK1,只不过存在不同的下游信号途径,其实TNF不仅能促进细胞死亡,也能引起细胞的分化存活,分化和死亡绝对是两种不同的结局,但更有意思的是,启动存活的信号也是RIPK1启动。也就是说,科学家知道,这个神奇的RIPK1分子,在同样一种细胞内可以决定细胞的生死。这就带来了问题,具体到生物体,是死是活,可是性命攸关的大事,RIPK1激活后产生的具体后果是什么?
TNF产生三种后果的信号途径不同,独立通过NF-κB产生细胞分化存活,RIPK1通过FADD和caspase 8触发细胞凋亡,而RIPK1与RIPK3共同诱导细胞程序性坏死。过去研究显示,遗传改造的RIPK1缺陷小鼠出生后死亡。本认为这是因为促进细胞生存的因子NF-κB没能激活。但这些动物许多组织出现广泛细胞死亡和炎症。这说明导致动物死亡的原因可能是RIPK1本来就应该具有的一种功能,细胞死亡。
这显然十分奇怪,难道RIPK1真实的身份不是可以促进细胞死亡,去掉这种基因依然能出现细胞坏死,难道这种分子是保护细胞免于发生坏死的卧底?关于RIPK1自相矛盾结果,也让研究者们感到迷惑不解。
两个独立团队构建了肠道上皮缺乏RIPK1的小鼠模型,研究结果同期发表在Nature上。这些小鼠比全身缺乏RIPK1的小鼠活得长,但会在出生后头几周患上严重肠炎,并因此死亡。研究显示,肠炎的原因主要是小鼠对TNF的敏感性增强。组织学检测表明,肠上皮细胞出现了广泛凋亡。
研究发现,RIPK1缺陷细胞中NF-κB没有受到显著影响。因此,RIPK1缺陷细胞对死亡如此敏感,不是因为NF-κB受损。曾有研究指出,凋亡和坏死性凋亡都需要RIPK1,而NF-κB活化不需要。研究发现,肠炎与RIPK1的激酶活性无关,因为无激酶活性的RIPK1并不影响小鼠健康。尽管如此,当研究人员同时失活FADD–caspase-8介导的凋亡和RIPK3依赖的凋亡时,小鼠的肠炎被完全逆转。这些结果说明,RIPK1保护肠道细胞的功能不依赖其激酶活性。也就是说RIPK1引起细胞凋亡不需要激酶活性,是独立的功能。结果表明,RIPK1能通过抑制凋亡和坏死性凋亡,促进细胞的生存。该蛋白有双重功能,兼具细胞死亡促进子和抑制子的两种职能。
为什么会这样?研究人员发现,当TNF激活时,RIPK1缺陷型细胞丧失cIAP1、TRAF2和cFLIP的表达,它们都是激活NF-κB的必需分子。NF-κB活化会提升这些因子的水平,出现正反馈调节效应。RIPK1通过保护cIAP1、TRAF2和cFLIP等生存蛋白,为细胞生存提供保护伞。这些生存蛋白受泛素化调节,泛素化标记后被降解。RIPK1促进细胞生存不需要激酶功能,它可能存在某种“支架”,为生存蛋白避免被泛素化提供庇护所。RIPK1也可能直接抑制FADD–caspase-8介导的凋亡和RIPK3依赖的坏死性凋亡。
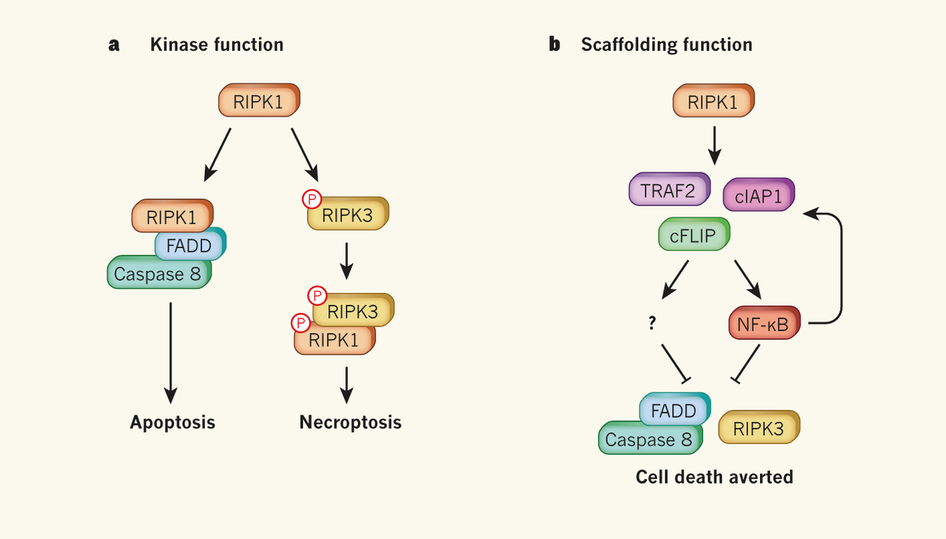
图蛋白RIPK1驱动细胞死有两条途径:激活FADD–caspase-8蛋白复合体引起凋亡,或者通过磷酸化的RIPK1和RIPK3互作导致坏死性凋亡。RIPK1诱导细胞死亡的这些过程需要其激酶活性。RIPK1也能促进细胞生存。
程序性坏死是一种由死亡受体介导的caspases非依赖性细胞死亡模式,通常在凋亡被抑制的情况下发生,具有坏死细胞的形态学特征。同细胞凋亡一样,程序性坏死受细胞内信号调节,激酶受体相互作用蛋白激酶1RIPK1和受体相互作用蛋白激酶3(RIPK3)是其关键的调控因子。

程序性细胞坏死是近年细胞生物学和组织病理学领域的研究热点,与细胞凋亡不同,细胞坏死的最显著特征是细胞内容释放,这往往会引起炎症反应。程序性细胞坏死在胚胎发育、组织稳态、免疫炎症反应等方面具有重要作用。由于程序性细胞坏死和细胞凋亡炎症反应往往相伴存在,相互影响,许多细胞信号也同时产生这些效应,因此应该弄清楚这些分子在机体产生具体效应中的整体和准确效应。8月17日《自然》杂志发表德国科隆大学MariusDannappel等的一篇论文,试图回答这些问题,该论文最近受到非常大的关注,甚至超过日本Stap细胞的论文,处于排行榜首位。

RIPK1不仅是程序性细胞坏死发生发展中具有重要作用,也是炎症反应和细胞凋亡的关键信号分子,该蛋白酶活性是驱动RIPK3介导的程序性细胞坏死的关键因素。最新这一研究目的是探讨RIPK1非酶活性状态,通过抑制表皮细胞凋亡和程序性细胞坏死,在调节组织稳态和对抗炎症等方面的功能。小鼠肠上皮细胞特异RIPK1基因敲除可导致该细胞凋亡、细胞绒毛萎缩、肠道杯状细胞和潘氏细胞的丢失等病理表现,动物会幼年夭折。上述病理效应不依赖于细菌和MyD88信号途径,但是能被TNFR1基因缺陷部分反转。上皮细胞FADD阻断能抑制肠上皮细胞凋亡,预防肠上皮细胞特异RIPK1基因敲除动物幼年夭折。但是,动物肠上皮细胞同时敲除RIPK1和FADD仍然存在RIPK3依赖的程序性细胞坏死、潘氏细胞的丢失和结肠区域性糜烂性炎症。RIPK1非酶活性基因转入能延迟FADD基因敲除导致的肠上皮细胞或角质形成细胞炎症反应。结果提示,FADD基因敲除导致的RIPK3依赖细胞程序性坏死只部分需要RIPK1酶活性。上皮细胞特异RIPK1基因敲除可启动角质形成细胞凋亡和细胞程序性坏死,导致严重皮肤炎症,这种变化可被RIPK3基因敲除反转,但不能被FADD基因敲除反转。

这些研究结果说明,RIPK1能抑制RIPK3依赖细胞程序性坏死。细胞程序性坏死确实是启动炎症反应的关键因素,细胞凋亡没有这一效应。或者说,RIPK1是肠道上皮和皮肤细胞存活、细胞稳态和炎症的管家调节因子。
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13608.html#affil-auth
https://m.sciencenet.cn/blog-41174-825900.html
上一篇:健康只要三个字
下一篇:2014年拉斯克奖公布