中国科学院孟广勋团队、上海交通大学赵立平教授和张晨虹团队合作在Nature Communications上发表了题为“Microbiota-derived acetate enhances host antiviral response via NLRP3” 的研究成果。该研究通过一系列体内和体外实验,揭示了流感病毒感染过程中肠道菌群代谢产物乙酸盐通过NLRP3增强I型干扰素的产生而抵抗病毒感染的机制,为呼吸道病毒感染的预防和治疗提供了新策略。
致病性病毒感染是人类健康面临的一个重大挑战。宿主对呼吸道病毒的免疫反应与菌群和微生物代谢密切相关。另外,宿主对甲型流感病毒(IAV)的防御涉及NLRP3炎症小体的激活,然而,NLRP3发挥保护功能的机制尚需深入解析。研究团队研究了流感病毒感染过程中NLRP3 介导乙酸盐产生菌增强IFN-I诱导的机制,发现肠道菌群代谢产物乙酸盐通过增强IFN-I合成抵抗流感病毒感染,此过程需要NLRP3与乙酸盐受体GPR43相互作用,这种相互作用会促进线粒体抗病毒蛋白(MAVS)的寡聚以及MAVS下游的干扰素调节因子3(IRF3)的磷酸化。提示乙酸盐-GPR43-NLRP3-MAVS-IFN-I信号轴是对抗呼吸道病毒感染的一个潜在治疗靶点。
研究团队首先发现,与Nlrp3-/-小鼠同笼饲养的WT小鼠(Co-WT)比单独饲养的WT小鼠(Sinlge-WT)更抗流感(下图1a);然而,与WT同笼饲养的Nlrp3-/-小鼠(Co-Nlrp3-/-)与单独饲养的Nlrp3-/- 小鼠(Single-Nlrp3-/-)一样仍然易感流感(下图 1a)。这暗示在同笼饲养期间Co-WT从Co-Nlrp3-/-小鼠获得了抗流感的菌株,这个/这些菌株需要NLRP3存在时才能发挥抗流感功能。抗生素处理上述四组小鼠后再感染流感病毒,结果表明正是同笼饲养期间Co-WT小鼠从Co-Nlrp3-/-小鼠获得的菌株增强了Co-WT抵抗流感病毒感染的能力(下图 1b)。
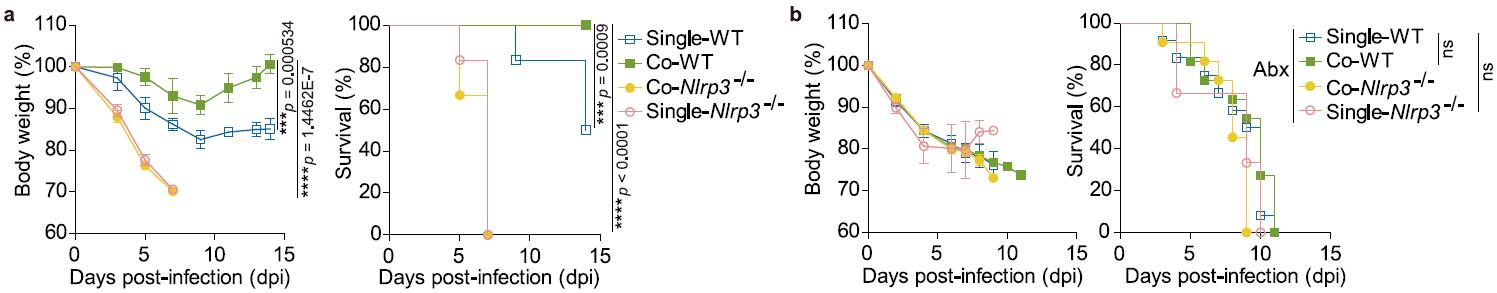
图1
接下来,他们分析了四组小鼠的肠道菌群结构(下图2左),并从Nlrp3-/-小鼠的肠道菌群中分离到一株假长双歧杆菌(Bifidobacterium pseudolongum) NjM1,该菌株能产生乙酸(下图2右)并在野生型小鼠体内抵抗IAV感染(下图3a, b, c)。
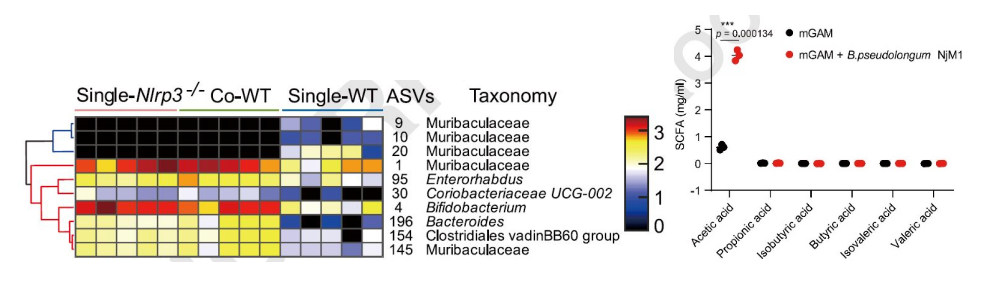
图2
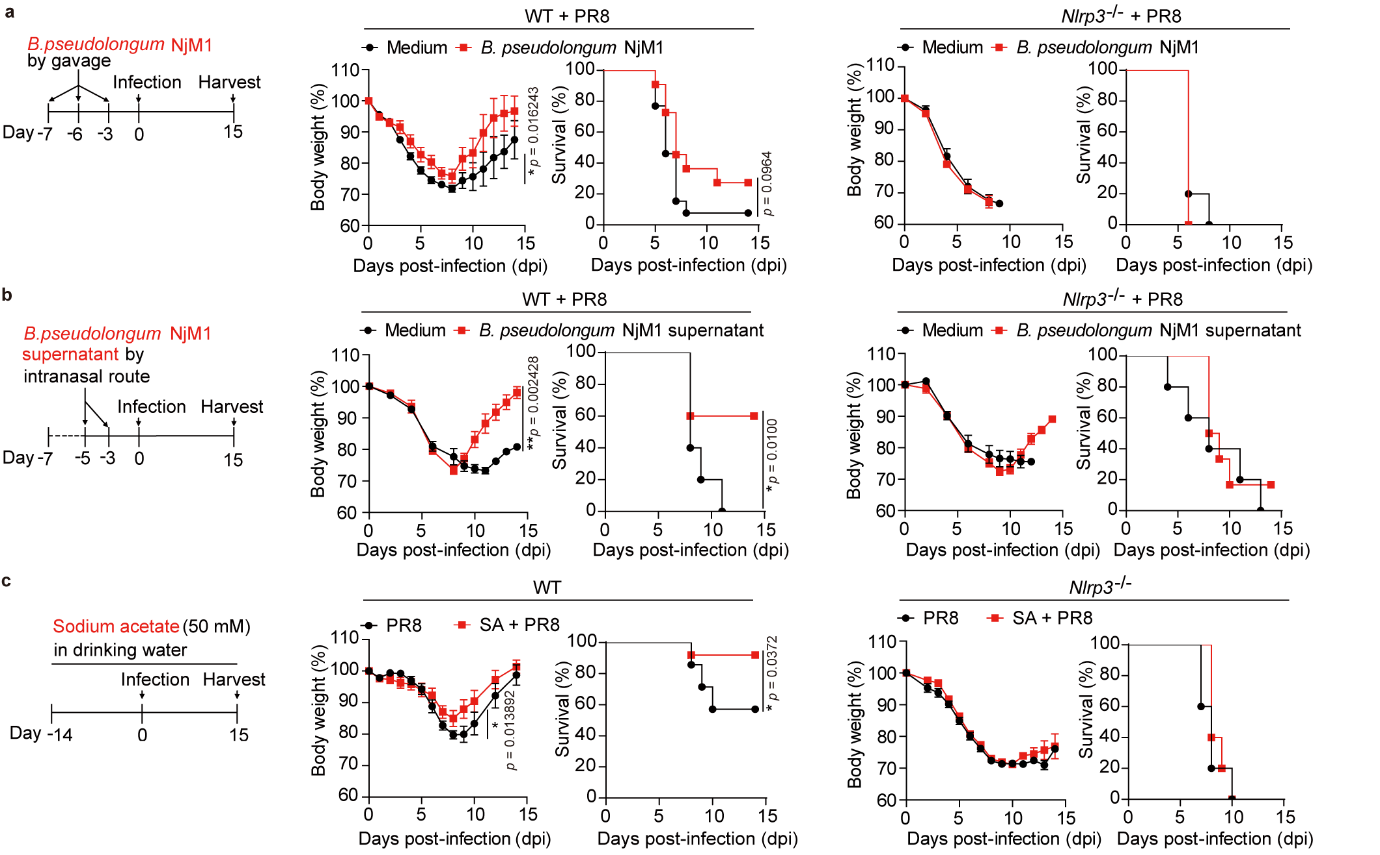
图3
研究人员进一步解析了其代谢产物乙酸盐如何抵抗流感病毒感染,发现乙酸盐增强IFN-I诱导(下图右)并依赖I型干扰素信号通路控制流感病毒复制(下图a, b,c)。
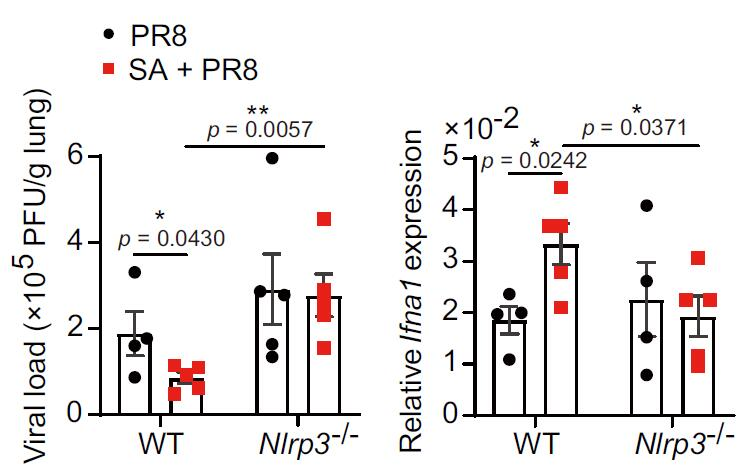
图4
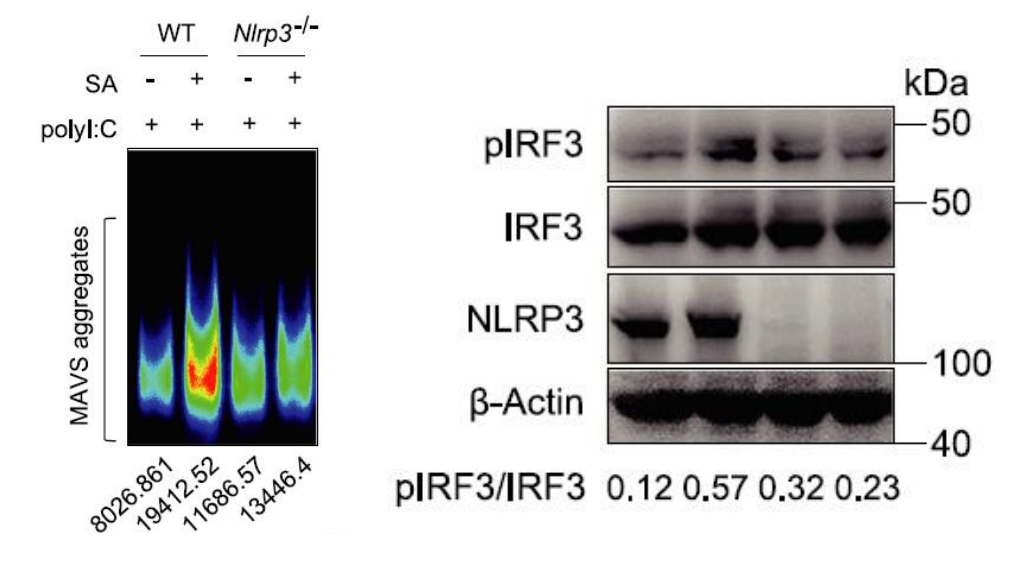
最后,研究人员用一系列体内和体外实验探究了乙酸盐增强IFN-I诱导的分子机制,结果显示:乙酸钠是通过MAVS-TBK1-IRF3信号轴增强IRF3的磷酸化(pIRF3)而增强IFN-I产生的(下图f-l),在此过程中,NLRP3桥接GPR43促进MAVS寡聚(下图左、右和模式图)。



模式图. NLRP3介导肠道菌代谢产物乙酸盐增强I型干扰素产生而抵抗病毒感染
综上所述,本研究通过同笼饲养野生型小鼠(WT)和Nlrp3-/-小鼠,将共生菌群、菌群代谢产物和天然免疫中的关键分子NLRP3联系在一起:(1)分离并鉴定了一株新菌-假长双歧杆菌NjM1(Bifidobacterium pseudolongum NjM1)。流感病毒感染时,NjM1可以产生乙酸(盐)通过GPR43和NLRP3增强肺部I型干扰素的产生,从而抑制病毒复制;(2)发现并阐明了介导乙酸(盐)增强I型干扰素产生的重要免疫分子和信号轴,即Acetate-GPR43-NLRP3-MAVS-TBK1-IRF3-IFN-I;(3)发现NLRP3参与乙酸(钠盐)增强的I型干扰素的产生。
中国科学院孟广勋研究员、上海交通大学赵立平教授和张晨虹研究员为论文的共同通讯作者。
英文摘要:Pathogenic viral infections represent a major challenge to human health. Host immune responses to respiratory viruses are closely associated with microbiome and metabolism via the gut-lung axis. It has been known that host defense against influenza A virus (IAV) involves activation of the NLRP3 inflammasome, however, mechanisms behind the protective function of NLRP3 are not fully known. Here we show that an isolated bacterial strain, Bifidobacterium pseudolongum NjM1, enriched in the gut microbiota of Nlrp3−/− mice, protects wild-type but not Nlrp3 deficient mice against IAV infection. This effect depends on the enhanced production of type I interferon (IFN-I) mediated by NjM1-derived acetate. Application of exogenous acetate reproduces the protective effect of NjM1. Mechanistically, NLRP3 bridges GPR43 and MAVS, and promotes the oligomerization and signalling of MAVS; while acetate enhances MAVS aggregation upon GPR43 engagement, leading to elevated IFN-I production. Thus, our data support a model of NLRP3 mediating enhanced induction of IFN-I via acetate-producing bacterium and suggest that the acetate-GPR43-NLRP3-MAVS-IFN-I signalling axis is a potential therapeutic target against respiratory viral infections.
全文链接:https://www.nature.com/articles/s41467-023-36323-4
参考资料:Niu, J., Cui, M., Yang, X. et al. Microbiota-derived acetate enhances host antiviral response via NLRP3. Nat Commun 14, 642 (2023). https://doi.org/10.1038/s41467-023-36323-4
转载本文请联系原作者获取授权,同时请注明本文来自汪凯科学网博客。
链接地址:https://m.sciencenet.cn/blog-446272-1418185.html?mobile=1
收藏


