博文
浙江大学徐平龙团队揭示核酸免疫识别的线粒体功能及分子机制
 精选
精选
||
北京时间2020年11月10日凌晨0时,浙江大学徐平龙实验室在Molecular Cell上发表了题为“TBK1-mediated DRP1 targeting confers nucleic acid sensing to reprogram mitochondrial dynamics and physiology”的研究论文。
该工作揭示了核酸天然免疫识别(innate nucleic acid sensing)通过MAVS-TBK1-DRP1信号轴调控线粒体形态和生理功能的重要发现。

核酸天然免疫识别是一类进化上高度保守的细胞生物学和免疫学机制,存在于几乎所有类型的细胞中。核酸识别不仅对宿主细胞抵抗外源微生物感染至关重要,也在自身免疫性疾病、慢性炎症疾病和肿瘤免疫中有重要功能。但是至今为止,对核酸免疫的细胞层面上的功能,除了细胞自噬、细胞分化/转分化和细胞衰老外,所知还很有限。另一方面,是否核酸免疫识别能够主动控制线粒体这一关键的细胞器的形态和功能,也不清楚。
线粒体是细胞的能量供应单位。线粒体动力学,通过线粒体持续而快速的融合和分裂,控制线粒体在能量代谢、细胞器完整和细胞命运决定等多个重要进程的关键功能。通过超高分辨率显微技术,徐实验室意外发现在RNA免疫识别活化过程中,线粒体呈现显著融合的形态。
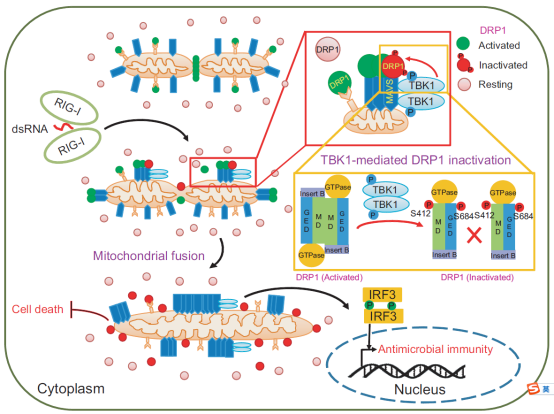
核酸免疫识别MAVS-TBK1-DRP1信号轴控制线粒体的形态与功能
这一现象需要核酸识别的关键激酶TBK1以及调控线粒体分裂的关键因子DRP1。定位于线粒体外膜的RNA识别关键接头分子MAVS在激活后,招募DRP1到MAVS信号复合体,随后被复合体中的TBK1高度磷酸化修饰。其中,TBK1对DRP1蛋白S412和S684位点的磷酸化能有效阻止DRP1形成高次序聚合的环状结构,因而使其完全丧失并显性抑制(dominant negative)正常DRP1分裂线粒体的功能。
徐实验室发现,因DRP1失活形成的高度融合的线粒体是MAVS形成高次序聚集以及RNA免疫识别信号正常激活的必要条件。他们在基因敲入(Knock-In)小鼠、斑马鱼、小肠类器官等模型中也发现,阻断MAVS-TBK1-DRP1信号轴,能够强烈抑制抗病毒免疫应答。另一方面,TBK1-DRP1信号也在细胞营养应激诱导的线粒体动力学调控和细胞命运决定中起关键功能。利用基因敲入或AAV载体在小鼠中人工模拟TBK1-DRP1信号轴的激活,则能观察到与DRP1先天突变病人相似的缺陷表型。
因此,工作首次揭示了核酸免疫识别对关键细胞器形态与功能的控制,这是核酸天然免疫生物学功能研究的重要进展。研究工作鉴定了MAVS-TBK1-DRP1-mitochondrial dynamics这一全新的信号通路与细胞器结构/功能耦合的核酸识别信号轴,并揭示了该信号轴是RNA免疫识别中的关键环节。
此外,该工作也揭示了线粒体动力学以及DRP1蛋白活性的全新调控机制以及该机制的细胞和生理功能。这些新发现是核酸免疫识别在信号机制与功能基础理论上的突破,也为发展抗病毒和自身免疫疾病的防治手段提供了新的理论与实验依据。
实验室博士后陈莎莎,刘盛铎和博士生王俊贤为论文共同第一作者,徐平龙教授为通讯作者。该研究工作也得到了秦骏教授、宋海教授、邹键教授、欧阳松应教授、冯新华教授等合作者的大力支持。研究得到国家杰青基金、自然科学基金委重点项目等科学基金的资助,在浙江大学开展并完成。
相关论文信息:
https://doi.org/10.1016/j.molcel.2020.10.018
https://m.sciencenet.cn/blog-3423233-1257761.html
上一篇:王红阳院士团队发现NAD+代谢调节肿瘤免疫逃避和改善免疫治疗新机制
下一篇:任超然/李浩洪/苏国辉合作揭示光疗增强空间记忆的神经通路机制