博文
“燃烧热的测定”实验辨析
|
“苯甲酸/萘”燃烧热的测定是物理化学最基础的实验,该实验结果的自洽强有力支撑了热力学理论的科学性。本文将探讨“苯甲酸/萘”燃烧热测定实验的本质,进一步明确热力学计算体系的虚拟性。
1. 实验原理
称取一定量的苯甲酸(萘)试样置于氧弹内,并在氧弹内充入1.5 - 2.0MPa的氧气,然后通电点火燃烧。燃烧时放出的热量将传给水和量热器,由水温的升高(ΔT)即可求出试样燃烧放出的热量:Q=K·ΔT
式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。称为量热计的水当量。其值由已知燃烧热的苯甲酸(标样)确定,即:K =Q /ΔT
式中ΔT应为体系完全绝热时的温升值,实际量热体系不可能完全绝热,因而实测的ΔT需用雷诺温度作图法进行校正。
1.1 ΔT的校正
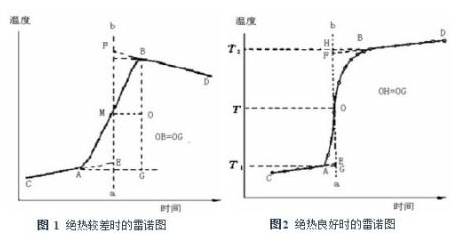
将实验测量的体系温度与时间数据作图,得曲线 CAMBD,见图 1,取A、B两点之间垂直于横坐标的距离的中点O作平行于横坐标的直线交曲线于M点,通过M点作垂线ab,然后将CA线和DB线外延长交ab线于E和F两点。F点与E点的温差.即为校正后的温度升高值 △T 。
有时量热计绝热情况良好,燃烧后最高点不出现如图2所示,这时仍可按相同原理校正[1]。
1.2 仪器水当量K
k =(m苯基酸▪Q1+l▪Q2)/ΔT (1)
式(1)中:m ━━ 苯甲酸重量;
Q1 ━━ 苯甲酸热值 (Qv =26480 J·g-1);
l ━━ 烧掉的引火丝长度;
Q 2 ━━ 引火丝热值 (Qv =8.4 J·cm-1)。
1.3 萘的燃烧热Q
Q=(k▪ΔT-l▪Q2)/m萘 (2)
2. 实验结果与讨论
2.1实验数据
2.1.1 实验数据Ⅰ
实验测得数据Ⅰ为:14.0℃,1.1306g苯甲酸完全燃烧,升温1.832K,消耗引火丝8.00cm。
由式(1)可得:
k =(m苯基酸▪Q1+l▪Q2)/ΔT=(1.0006g×26480J▪g-1+8.00cm×8.4J▪cm-1)/1.832K=16378.5J·K-1
另测得:1.0039g萘完全燃烧,升温2.467K,消耗引火丝7.10cm。
由式(2)可得萘的燃烧焓值为:
Q=(k▪ΔT-l▪Q2)/m萘 =(16378.5J▪K-1×2.467K-7.10cm×8.4J▪cm-1)/1.0039g=40189.4J·g-1
2.1.2 实验数据Ⅱ
实验测得数据Ⅱ为:14.0℃,1.1314g苯甲酸完全燃烧,升温1.908K,消耗引火丝6.30cm。
由式(1)可得:
k =(m苯基酸▪Q1+l▪Q2)/ΔT=(1.1314g×26480J▪g-1+6.30cm×8.4J▪cm-1)/1.908K=15674.3J·K-1
另测得:1.0033g萘完全燃烧,升温2.5687K,消耗引火丝7.00cm。
由式(2)可得萘的燃烧焓值为:
Q=(k▪ΔT-l▪Q2)/m萘 =(15674.3J▪K-1×2.5687K-7.00cm×8.4J▪cm-1)/1.0033g=40071.5J·g-1
2.2 结果讨论
两次所得萘的燃烧热数据平均值为:(40189.4+40071.5)/2=40130.5J·g-1
实验所测萘的恒容摩尔燃烧热为:40130.5×128.18=5143.924kJ▪mol-1
萘的燃烧热反应为:C10H8(s)+12O2(g)=10CO2(g)+4H2O(l)
依题:ΔCHm=Qv+Δn▪RT,Δn=10mol-12mol=-2mol
ΔCHm=-5143.924-2×8.314×298.15×10-3=-5148.9kJ·mol-1
与25℃萘的燃烧焓理论值-5153.9kJ·mol-1之间绝对误差为5.02kJ·mol-1,相对误差为0.10%。
备注:由于一定范围内温度对燃烧热值影响不大,故博文忽略了温度对燃烧热的影响。
上述结果表明在实验误差范围内,萘的燃烧热数据理论值与实测值较好吻合.
然而热力学标准燃烧热定义为标态及298.15K时一摩尔物质完全燃烧时的反应焓变。萘的实际燃烧过程首先温度不恒定(水温必须上升,否则测不出热量值),萘的燃烧温度也不是环境温度;其次在萘的燃烧过程,系统压强也不可能保持100kPa不变(标准状态);这表明用弹式量热计(氧弹)所测燃烧热为萘的真实燃烧热,与其标准摩尔燃烧热无关。
3. 结论
萘的标准摩尔燃烧热(ΔCHθm)数据无法通过实验测得;热力学计算为虚拟计算,计算结果不等同客观事实。
参考文献
[1]武汉科技大学化学与化工学院物理化学教研室. 物理化学实验讲义,2014.
https://m.sciencenet.cn/blog-3474471-1299013.html
上一篇:热力学平衡态、可逆过程及化学平衡
下一篇:水溶液中离子热力学数据的通用性