博文
卡诺热机效率的合理性
|
热机是指介质从高温热源吸热、向低温热源放热并对环境作功的循环操作机器,通常认为热机可实现热功转换. 热机效率:η=-W/Qh (1)
式(1)中η代表热机效率,W为热机对环境做的功,Qh表示热机工质从高温热源吸收的热量.
1. 卡诺循环
1824年,法国人卡诺设计出卡诺循环,并将之用于解释热机效率. 本文将围绕卡诺循环的热力学机制,分析卡诺热机效率(η)的不合理性.
卡诺循环参见图1.[1]
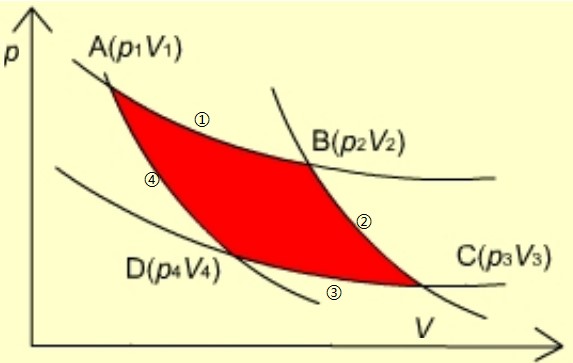
Fig.1 Carnot cycle
卡诺热机由理想气体工质、高温(T1)环境及低温(T2)环境三部分组成。其循环包括理想气体连续四个热力学过程,即:①恒温可逆膨胀; ②绝热可逆膨胀; ③恒温可逆压缩及④绝热可逆压缩. 每个过程的热力学机制及能量关系如下.
1.1 恒温可逆膨胀
过程①为理想气体由A→B,此时高温环境温度为T1.
由热力学第一定律可得:dU=TdS-pdV=0
则:Q1=-WV,1=∫pdV=nRT▪ln(V2/V1) (2)
依题:V2>V1,由式(2)可得:Q1>0, WV,1<0
表明过程①发生,理想气体从高温环境吸热,并对高温环境做功,理想气体内能不变.
1.2 绝热可逆膨胀
过程②为理想气体由B→C, 温度将由T1下降至T2.
由热力学第一定律可得:dU=δWV,2=n▪CV,m▪dT
上式积分可得:ΔU2=WV,2=n▪CV,m▪(T2-T1)<0
表明过程②发生,系统体积膨胀,系统对环境做功,功为负, 理想气体内能减少.
1.3 恒温可逆压缩
过程③为理想气体由C→D,此时低温环境温度为T2.
由热力学第一定律可得:dU=TdS-pdV=0
则:Q3=-WV,3=∫pdV=nRT▪ln(V4/V3) (3)
依题:V4<V3,由式(3)可得:Q3<0,WV,3>0
表明过程③发生,理想气体被压缩,从低温环境获取功,并向低温环境放热,其内能保持恒定.
1.4 绝热可逆压缩
过程④为理想气体由D→A,温度由T2升高至T1.
由热力学第一定律可得:dU=δWV=n▪CV,m▪dT
上式积分可得:ΔU4=WV,4=n▪CV,m▪(T1-T2)>0
表明过程②发生,系统体积被压缩,环境对系统做功,功为正, 理想气体内能增加.
2. 理想气体能量变化
卡诺循环中理想气体能量变化参见表1.
Tbl. 1 Energy changes in the four processes of the Carnot cycle

由表1可知,卡诺循环的每一个热力学过程能量均守恒,对于过程①,因对高温环境作功,系统从环境吸热,系统总能量并不增加;同理对于过程③,系统从环境得到功,为保持自身能量恒定,必须向低温环境放热,系统总能量也不发生变化; 过程②、④均为绝热过程,它们对系统作的功刚好抵消.
备注:卡诺循环中的"可逆过程"专指理想气体膨胀或压缩过程的任意瞬间,系统压强与外压恒相等.
3. 结论
卡诺循环的每一个热力学过程能量均守恒,并不涉及功热转化,与热机效率(η)无关.
参考文献
[1] 沈文霞. 物理化学核心课程(第二版).北京: 科学出版社, 2009.
https://m.sciencenet.cn/blog-3474471-1299911.html
上一篇:热力学数据源探究
下一篇:热力学第一定律研究