博文
摩尔定压热容、体积功与平衡常数在平衡态热力学中的作用探究
|
摩尔定压热容(Cp,m)、体积功(WT)与热力学平衡常数(Kθ)是平衡态热力学过程中少有的几个可实测的
物理量,本文拟结合热力学基本原理,探究它们在平衡态热力学发展中的作用.
1. 摩尔定压热容(Cp,m)
摩尔定压热容(Cp,m)是指一定温度下,单位物质的量某物质在恒压且有效功为0时,温度每升高无限小量
dT所需要的热量δQp. 物质的摩尔定压热容(Cp,m)定义式[1]参见如下式(1):
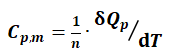 (1)
(1)
对于单纯的pVT变化(δW'≡0),平衡态热力学规定:
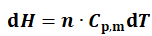 (2)
(2)
摩尔定压热容(Cp,m)概念的引入,极大方便了热力学单纯pVT变化过程焓变的计算,对平衡态热力学的迅
速发展和推广功不可没.
2. 体积功(WT)
某热力学过程参见如下图1:
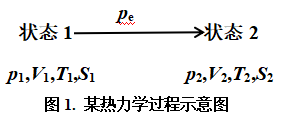
图1中pe代表环境大气压强(或外压).
通常情况下,热力学过程对应的pe值恒定,该过程体积功(WT):
δWT=-pe·dV (3)
式(3)积分可得:WT=-pe·(V2-V1)=-pe·ΔV (4)
利用式(4)可以非常方便计算出某热力学过程的体积功(WT),也增加了平衡态热力学的“客观性”,
拉近了平衡态热力学与真实世界的距离.
3. 热力学平衡常数(Kθ)
平衡态热力学规定:ΔrGθm=-RT·lnKθ (5)
lnKθ=-ΔrGθm/(RT) (6)
利用热力学基本原理,结合式(5)及(6)可以非常方便的计算出任意反应,任意温度下的热力学平衡常
数;另一方面由于平衡常数可实测, 这也从另一个方面增加了平衡态热力学的可信性.
4. 结语
由于平衡态热力学引入了诸如摩尔定压热容(Cp,m)、体积功(WT)及热力学平衡常数(Kθ)等真实可信的
物理量,平衡态热力学在长期演变过程中逐渐形成了一门虚实相间的学科,这也迫切需要广大热力学研究者潜
心治学,去伪存真,共同推动热力学学科健康稳定地向前发展.
参考文献
[1]天津大学物理化学教研室编. 物理化学(第五版,上册).北京:高等教育出版社, 2009,5:46-48.
https://m.sciencenet.cn/blog-3474471-1372092.html
上一篇:热力学等温方程与热力学过程关联探究
下一篇:理想气体恒温膨胀过程的两种热力学解析