博文
《细胞—干细胞》:钱莉团队发现神经特异因子Ascl1诱导高效心肌重编程
||
北京时间2022年10月6日晚23时,美国北卡罗莱纳大学教堂山分校 (UNC-Chapel Hill)钱莉教授团队在Cell Stem Cell发表题为“”Cross-lineage Potential of Ascl1 Uncovered by Comparing Diverse Reprogramming Regulatomes的研究论文。
在该论文中,研究人员通过对比三种不同的重编程过程(神经重编程,心肌重编程以及肝细胞重编程)中发生变化的表观遗传特征以及对应的上游转录因子,发现神经转录因子Ascl1具有诱导心脏相关基因表达的活性并可与Mef2c 协同高效诱导心肌成纤维细胞重编程为iCM(图一)。
北卡罗莱纳大学教堂山分校王昊飞博士以及Benjamin Keepers博士为论文共同第一作者,钱莉教授为通讯作者。


图1 工作模型
心肌梗死是过去20年来危害全球公共卫生健康的一类主要的心血管疾病。近些年来,中国城市居民的急性心肌梗死的发病率总体呈上升趋势, 每年新发至少50万。成人心肌细胞的再生能力极其有限,因此急性心肌梗死后缺血导致的心肌细胞损失是不可逆的继而最终可能导致心力衰竭甚至病人的死亡。近年来广受关注的直接重编程是指不经历多能干细胞阶段而从一种体细胞类型到另一种体细胞类型的细胞命运转变的过程。以往研究表明,通过诱导三个转录因子(Mef2c、Gata4 和 Tbx5)的表达,心脏成纤维细胞可以重编程为诱导心肌样细胞(iCM)从而在小鼠急性心肌梗死模型中修复受损心肌,改善梗死后的心脏功能。
为了对比三个不同重编程过程的表观遗传变化,研究人员利用染色质免疫沉淀-测序(ChIP-seq)以及转录组测序 (RNA-seq) 鉴定出了在三个重编程过程中被激活的增强子。对比之下,研究人员发现大部分被激活的增强子具有重编程过程的特异性。但也有例外, 在神经重编程的过程中除了神经细胞相关的通路被激活, 与心肌相关的通路也被激活。类似的现象也在研究人员对于超级增强子的对比中被发现。
之后研究人员对于在重编程过程中被激活的增强子进行了基序(motif)富集分析。结果表明,除了过表达的重编程因子,在重编程过程中也有大量非重编程因子的转录因子参与其中。通过在三个重编程过程中敲低这些转录因子的表达水平,研究人员发现Atf7 以及Tead4 可以同时参与在三个重编程过程。另一方面,研究人员在发现于Ascl1的基序富集于心肌重编程相关的增强子上进一步提示了Ascl1作为一个神经转录因子可能的心肌相关活性。
为了验证Ascl1的心肌相关活性,研究人员通过分析Ascl1在成纤维细胞中过表达引起的转录组变化发现:相比于传统的心肌重编程, Ascl1 可以特异性的激活更多的肌节蛋白的表达。当研究人员将Ascl1于Mef2c, Gata4,以及Tbx5进行排列组合后发现,Ascl1与Mef2c (A+M)两个转录因子就可以诱导心肌重编程并且相较于传统的MGT, A+M能够大幅度的提高重编程的效率。随后研究人员对于A+M重编程的心肌的功能进行了全面的测试。A+M重编程的心肌相较于MGT更早的出现完整的肌节结构并且能够自主跳动(图二)。通过单细胞测序,研究人员发现A+M与MGT采用了完全不同的重编程路径(Trajectory)A+M 在重编程的过程中除了会激活心肌细胞程序也会抑制与神经相关的通路。

图2 A+M 重编程的心肌细胞相较MGT更早出现完整的肌节结构
之后通过在A+M重编程过程中Ascl1 以及Mef2c的染色质免疫沉淀-测序,研究人员发现Mef2c与Ascl1之间具有协同作用。其具体表现在Mef2c可以增强Ascl1在心肌相关位点的结合同时减少其在神经相关位点的结合而Ascl1则可以诱导Mef2c结合至其单独表达无法结合的心肌相关基因(图3)。
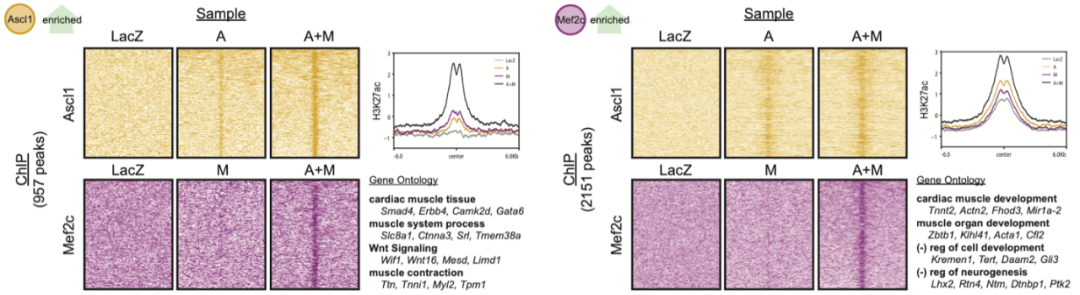
图3 Ascl1与Mef2c协同激活心肌相关增强子
综上,该项研究通过对比三个直接重编程过程的表观遗传的变化发现了共同调节因子的存在并且提示了神经特异转录因子Ascl1诱导心肌重编程的可能性。这一发现不仅揭示了直接重编程这一过程与生物发育过程中的细胞命运重塑的不同,也为研究人员优化直接重编程提供了崭新的思路:直接重编程因子的选择不用仅局限于与目的细胞谱系特异的转录因子中。
相关论文信息:
https://doi.org/10.1016/j.stem.2022.09.006
https://m.sciencenet.cn/blog-3423233-1358352.html
上一篇:《细胞—干细胞》:陈水冰等构建基于人诱导多能干细胞从事GWAS研究的平台
下一篇:《神经元》:骆利群/俞安洋/李介夫等开发哺乳动物细胞表面蛋白组原位标记方法