博文
《自然—细胞生物学》:南加州大学窦亚丽团队报道H3K4甲基化转移酶MLL1的首个非组蛋白底物
||
北京时间2023年11月10日,美国南加州大学Keck医学院及Norris癌症中心窦亚丽课题组在Nature Cell Biology上发表了题为Non-canonical MLL1 activity regulates centromeric phase separation and genome stability的研究长文。
该研究报道了MLL1的首个非组蛋白底物及其在维持癌细胞基因组稳定性中的作用,同时回答了长久以来关于COMPASS家族甲基化转移酶的分子靶标是否冗余这一谜题。

H3K4甲基化是提示基因活化状态的表观遗传修饰,在哺乳动物细胞中被6种不同的COMPASS家族复合物催化生成【1】。其中Mixed Lineage Leukemia 1 (MLL1)是该家族的重要成员,在干细胞功能,胚胎发育,和癌症中都受到广泛关注和研究【2,3】。例如造血干细胞中Mll1基因的重排会引起混合谱系白血病,而在一系列血液肿瘤及肝癌等固体肿瘤中Mll1基因又是高表达的,提示了它是潜在的促癌基因。然而对于MLL1的生物学功能,目前的认识还只停留于它的组蛋白H3K4甲基化转移酶功能,而对于它在转录调控以外的功能知之甚少。体外重组蛋白实验早已证明MLL1在组蛋白H3K4上的活性,但是基因敲除或酶活抑制的结果都表明,缺少MLL1的细胞不管是全局【4】还是它的下游基因【5】(例如Hox家族基因)启动子区域的H3K4甲基化水平都没有或很少受到影响。有趣的是,经过MLL1抑制剂处理的HeLa细胞很快就表现出基因组不稳定性(包括非整倍体aneuploidy和微核micronuclei的出现),这一现象也在MLL1敲除的MEF细胞中被观察到。
那么,MLL1会不会通过催化组蛋白H3K4以外的底物甲基化来行使它的生物学功能呢?
为了寻找潜在的MLL1的底物蛋白,作者首先利用基于SILAC(稳定同位素氨基酸标记)的无偏倚蛋白质组技术比较了野生型及MLL1敲除的MEF细胞中赖氨酸甲基化组,得到了MLL1的潜在底物列表。其中,作为甲基化水平最为依赖MLL1的潜在底物,有丝分裂蛋白Borealin,受到了作者的关注(图1左)。体外甲基化实验确认了Borealin可以直接作为底物被MLL1甲基化。随后作者鉴定到Borealin上赖氨酸K143为其被MLL1靶向的唯一位点。X-ray共结晶实验发现Borealin及组蛋白H3在MLL1的活性中心的构象有所不同(图1右),活性中心中的一组新的位点对于结合及甲基化Borealin至关重要。当作者突变了这些位点后发现其对于Borealin的甲基化活性大幅降低,而对于H3的活性则不受影响。有意思的是,其他COMPASS家族成员对于Borealin具有不同的靶向活性。其中,MLL2 (KMT2B)及SET1B (KMT2G)同样能够甲基化Borealin K143,而MLL4 (KMT2D)则靶向了Borealin上的不同位点。免疫共沉淀实验表明MLL1与Borealin的结合主要发生在有丝分裂期,而MLL2及SET1B与Borealin的结合主要发生在分裂间期,提示了MLL1是有丝分裂过程中调控Borealin的主要COMPASS成员。当同步化细胞到分裂中期或高表达MLL1时,作者观察到Borealin的甲基化水平提高了,而这种效应并没有在K143R突变体Borealin上观察到。
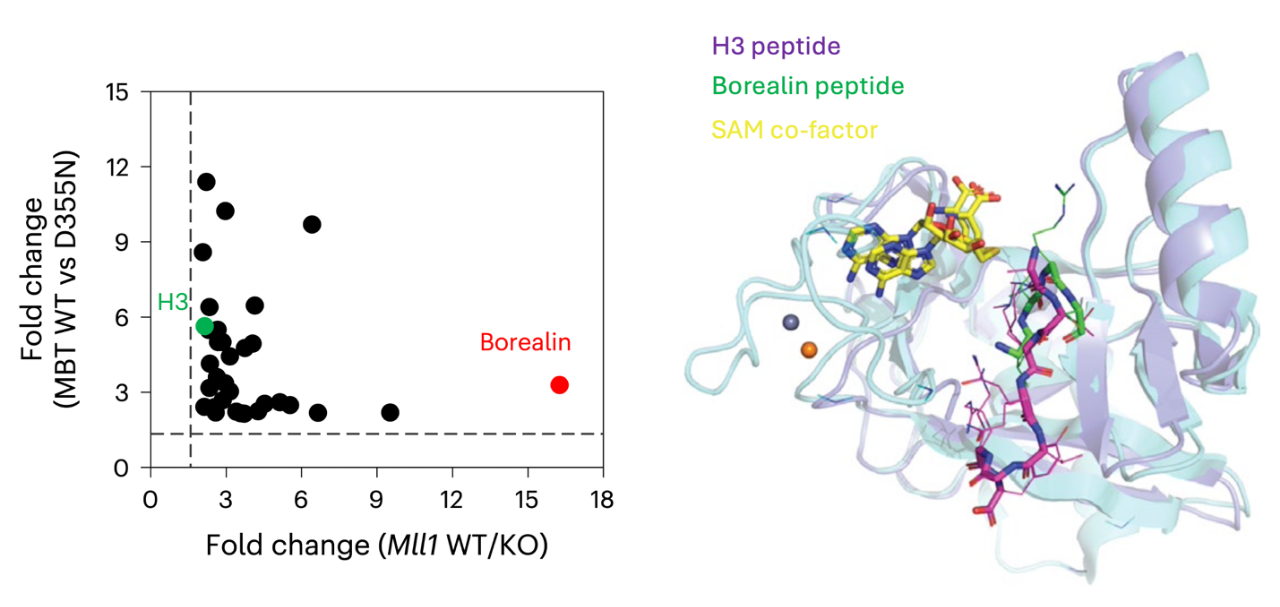
图1.左图:SILAC实验得到的MLL1的潜在底物蛋白。右图:X-ray晶体结构揭示的MLL1活性中心结合H3或Borealin片段的构象对比
Borealin是Chromosome Passenger Complex (CPC)复合物的成员,在有丝分裂中起到关键的调控作用。该复合物在分裂前期(Prophase)至中期(Metaphase)会汇聚于染色体中心粒内侧,通过其核心成员Aurora kinase B (AurkB)的磷酸化活性来指挥和协调有丝分裂的各个环节【6】。先前同样发表于Nature Cell Biology的研究成果表明CPC复合物会以液-液相分离的形式存在于中心粒内侧,而Borealin K143所在的无序结构域(IDR)对于CPC的相分离性质至关重要【7】。于是,作者通过体外甲基化结合相分离实验发现Borealin K143的甲基化会促进CPC相分离的发生。在敲降/抑制MLL1或表达Borealin K143R突变体的细胞中CPC在中心粒上的相分离变得不稳定(易于受到干扰并且受干扰后很难恢复,图2左),FRAP实验也证明了此时的CPC内部具有更高的流动性。由于中心粒是有丝分裂中期姐妹染色单体保持结合的位点,作者随后发现在CPC相分离不稳定的Borealin K143R突变体细胞中,无论纺锤丝的结合带来的张力有无,着丝点间距都变大了,甚至出现了分裂中期过早的姐妹染色单体分离。那么MLL1对Borealin的甲基化对于AurkB的活性有没有贡献呢?作者使用AurkB底物的磷酸化抗体发现在敲降/抑制MLL1或者表达Borealin K143R突变体的细胞中位于着丝点的AurkB底物的磷酸化都下降了,而依赖于AurkB活性的染色体错配纠正实验(Monastrol wash-out)更是显示K143R突变体细胞中大量未能正确排列的染色体。在评估了有丝分裂的各种异常之后,作者发现MLL1对于Borealin的甲基化是分裂中期染色体的正确排列和纺锤体的两极形态不可或缺的(图2右),而对于CPC在有丝分裂检查点激活(Spindle Assembly Checkpoint)等功能上则不是必须的。
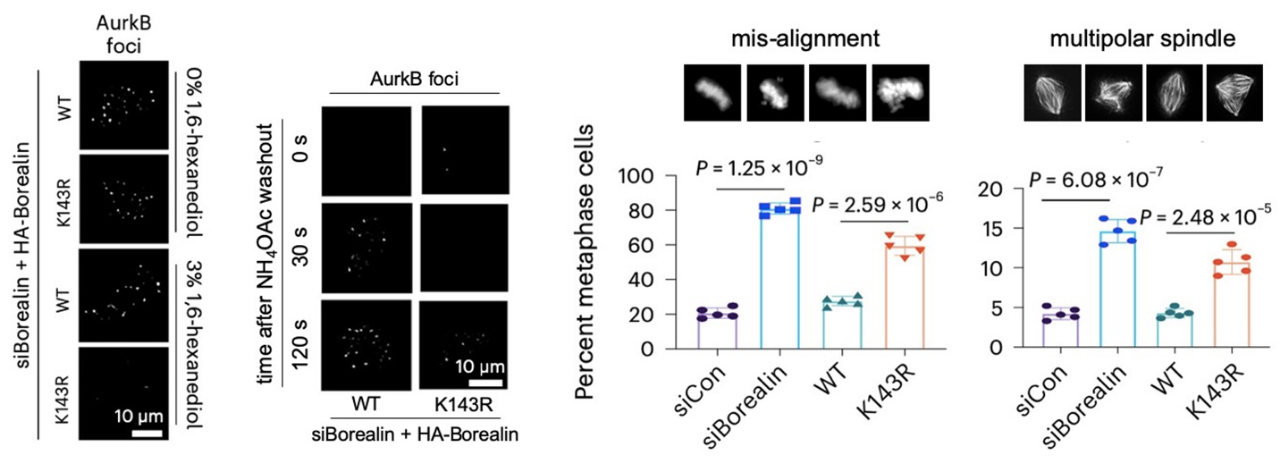
图2.左图:表达野生型或K143R突变体Borealin的HeLa细胞中AurkB信号在受到相分离干扰剂处理时及干扰后信号恢复过程的显微镜照片。右图:野生型或K143R突变体Borealin细胞中染色体排列及纺锤体形态的照片及定量
虽然非整倍体是癌症的重要特征,但是有丝分裂异常带来的大量非整倍体却会引起癌细胞基因组不稳定,形成应激并阻碍癌细胞的快速复制分裂【8】。作者利用DepMap数据库对癌细胞对于MLL1的生长依赖性及Borealin的表达量之间做了关联性分析,发现在肝细胞癌(HCC)中两者有着最显著的关联性,同时MLL1对肝癌细胞生长的影响是在139个表观遗传因子中与Borealin表达量最为相关的(图3左)。随后作者对TCGA数据中HCC肿瘤的非整倍体评分与MLL1的表达量做了分析,有意思的是,仅在Borealin高表达的肝癌中发现了两者之间的负相关性, 从侧面印证了MLL1是通过Borealin调控了癌细胞的基因组稳定性。为了进一步验证从临床数据中得到的相关性,作者在不同的HCC细胞系中敲降了MLL1,发现只有在CPC高表达的HCC细胞中出现了有丝分裂异常及非整倍体的增加(图3右),进而影响了癌细胞的增殖和成瘤性。MLL1的活性抑制及Borealin的敲降回补实验也验证了在CPC高表达的HCC中MLL1是通过Borealin的甲基化来维持癌细胞基因组稳定性并促进细胞增殖。
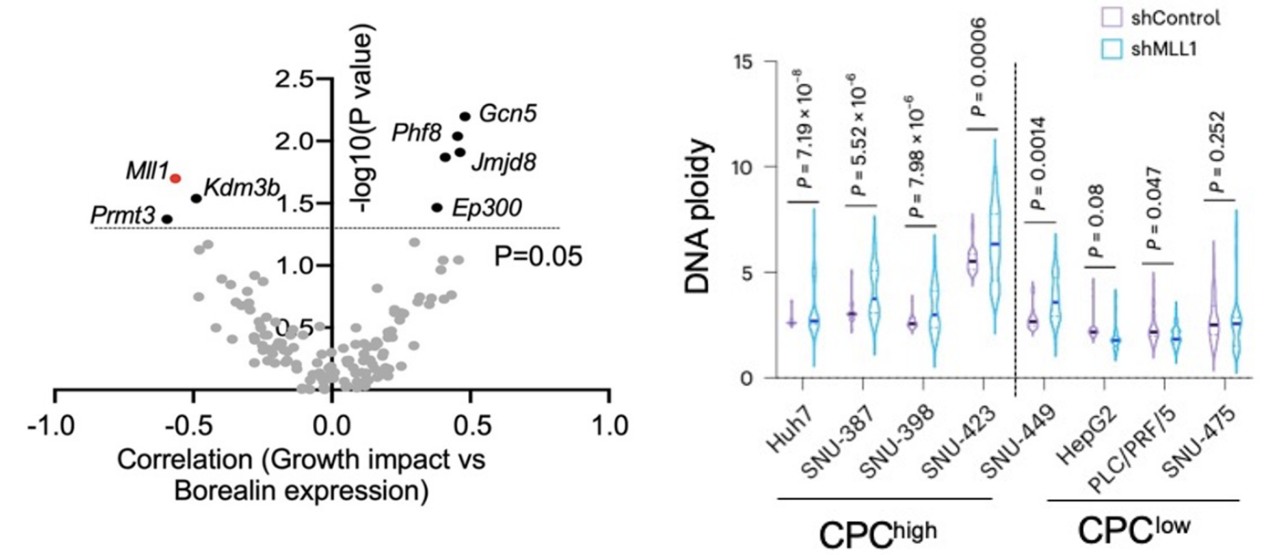
图3.左图:139个表观遗传因子对于HCC细胞的增殖影响及Borealin表达量之间的相关性和对应P值。右图:不同HCC细胞系中敲降MLL1引起的非整倍体增加
综上所述,本研究探索并发现了组蛋白H3K4甲基化转移酶MLL1的首个非组蛋白底物,意外地揭示了由Borealin甲基化介导的表观遗传因子对于有丝分裂的调控,以及这一机制在维持癌细胞基因组稳定性方面的重要作用。
南加州大学医学院窦亚丽教授为该论文的通讯作者。南加州大学医学院沙亮博士为该论文的第一作者。南加州大学Woojin An课题组和密歇根大学Uhn-Soo Cho课题组对该论文做出了重要贡献。
相关论文信息:
https://doi.org/10.1038/s41556-023-01270-1
参考文献
1 Shilatifard, A. The COMPASS family of histone H3K4 methylases: mechanisms of regulation in development and disease pathogenesis. Annu Rev Biochem 81, 65-95 (2012). https://doi.org/10.1146/annurev-biochem-051710-134100 2 Rao, R. C. & Dou, Y. Hijacked in cancer: the KMT2 (MLL) family of methyltransferases. Nat Rev Cancer 15, 334-346 (2015). https://doi.org/10.1038/nrc3929 3 Zhang, H. et al. MLL1 Inhibition Reprograms Epiblast Stem Cells to Naive Pluripotency. Cell Stem Cell 18, 481-494 (2016). https://doi.org/10.1016/j.stem.2016.02.004 4 Chen, Y. et al. MLL2, Not MLL1, Plays a Major Role in Sustaining MLL-Rearranged Acute Myeloid Leukemia. Cancer Cell 31, 755-770.e756 (2017). https://doi.org/10.1016/j.ccell.2017.05.002 5 Cao, F. et al. Targeting MLL1 H3K4 methyltransferase activity in mixed-lineage leukemia. Mol Cell 53, 247-261 (2014). https://doi.org/10.1016/j.molcel.2013.12.001 6 Carmena, M., Wheelock, M., Funabiki, H. & Earnshaw, W. C. The chromosomal passenger complex (CPC): from easy rider to the godfather of mitosis. Nat Rev Mol Cell Biol 13, 789-803 (2012). https://doi.org/10.1038/nrm3474 7 Trivedi, P. et al. The inner centromere is a biomolecular condensate scaffolded by the chromosomal passenger complex. Nat Cell Biol 21, 1127-1137 (2019). https://doi.org/10.1038/s41556-019-0376-4 8 Santaguida, S. & Amon, A. Short- and long-term effects of chromosome mis-segregation and aneuploidy. Nat Rev Mol Cell Biol 16, 473-485 (2015). https://doi.org/10.1038/nrm4025
https://m.sciencenet.cn/blog-3423233-1411958.html
上一篇:《自然—化学生物学》:钟超/周佳海/谭验合作报道新型活材料设计的“IT+BT”新范式
下一篇:《自然—生物医学工程》:斯坦福大学吴庆明团队揭示心动过速导致心脏功能下降的分子机制