博文
《癌症研究》:郗乔然/张力伟合作阐述吉西他滨在H3.3K27M突变型弥漫内生型脑桥胶质瘤中的作用机制
||
2024年2月15日,清华大学生命学院郗乔然课题组与首都医科大学附属北京天坛医院张力伟课题组合作,在Cancer Research杂志在线发表了题为“Fimepinostat impairs NFκB and PI3K/AKT signaling and enhances gemcitabine efficacy in H3K27M-mutated diffuse intrinsic pontine glioma”的研究论文。
该研究系统性地阐述了吉西他滨在H3.3K27M突变型DIPG中的作用机制,并提出了吉西他滨与Fimepinostat联合用药的治疗策略。

弥漫内生型脑桥胶质瘤(Diffuse Intrinsic Pontine Gliomas,DIPG)是一种儿童脑肿瘤,具有高度侵袭性、难以手术治疗、死亡率高的特点,目前尚无有效的治疗方法。研究表明,约80%的DIPG患者存在组蛋白H3K27M突变,导致全基因组H3K27me3的降低和转录异常,该突变被认为是DIPG发病的主要推动因素。尽管目前新型治疗药物主要集中在调节组蛋白甲基化和乙酰化平衡状态,以修复由H3K27M突变引起的级联效应,但由于临床转化效果不佳,DIPG仍然需要新的治疗方案。
除了H3K27M突变外,90%的H3.3K27M型DIPG存在p53信号通路异常,包括TP53自身突变(占比65%~69%)和PPM1D突变(占比20%~28%)。PPM1D突变可降低p53的稳定性,使其失活,从而促进DIPG的肿瘤进展。这表明重新激活p53的抑癌功能可能是DIPG的潜在治疗靶点。
这项最新研究通过对多株DIPG原代细胞系,利用药物筛选确认吉西他滨作为潜在治疗药物。研究验证了吉西他滨能有效抑制DIPG在体外和小鼠体内的肿瘤形成,并揭示了吉西他滨引起DNA损伤、激活p53以及增加p53对凋亡相关基因的调控可及性,从而诱导细胞凋亡。此外,研究还发现吉西他滨在H3K27M存在的条件下诱导DIPG的细胞凋亡。然而,吉西他滨在引起DNA损伤的同时,也激活内源性逆转录病毒元件(Endogenous retrovirus,ERV),并激活cGAS-STING信号及下游RELB介导的非经典NF-κB信号通路,从而促使肿瘤存活。再次进行药物筛选后,研究发现Fimepinostat与吉西他滨表现出卓越的药物协同性,且Fimepinostat能够抑制吉西他滨激活的非经典NF-κB信号通路,同时阻断PI3K/AKT信号通路,产生持续的DNA损伤效应,表现出在体外和体内实验中的卓越协同抗肿瘤作用。
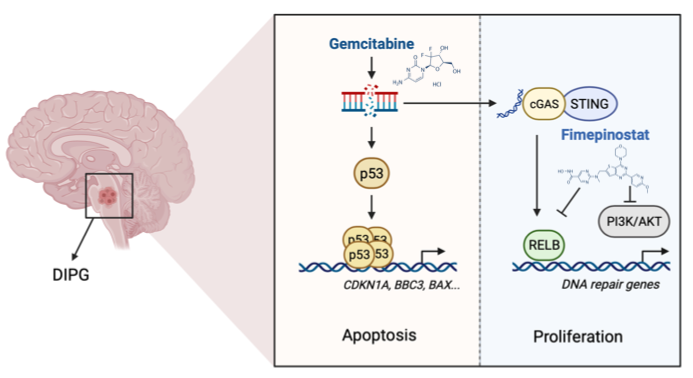
图:使用吉西他滨重新激活p53的肿瘤抑制功能联合Fimepinostat抑制非经典NF-κB信号和PI3K/AKT信号,可能是治疗H3.3K27M突变的DIPG患者的潜在治疗方案。
清华大学生命学院郗乔然副教授、首都医科大学附属北京天坛医院张力伟教授为论文共同通讯作者。清华大学2018级已毕业博士生王丹为本文的第一作者。清华大学生命学院郗乔然课题组闫坤、余红杏、李浩成、周威及郭书凝参与了本文部分实验工作。上海交通大学唐玉杰教授为本研究提供了部分DIPG细胞系。清华大学生命科学学院刘念副教授及其课题组的洪雅强博士为本课题提供了转座子分析,清华大学生命科学学院吴畏教授为本课题提供了表观遗传类小分子化合物库。首都医科大学附属北京天坛医院王一、徐骋和泮长存提供了研究需要的临床样本和信息。
本研究得到了国家自然科学基金、科技部国家重点研发计划、北京市自然科学基金和清华-北大生命科学联合中心的大力支持。
相关论文信息:
https://doi.org/10.1158/0008-5472.CAN-23-0394
https://m.sciencenet.cn/blog-3423233-1423522.html
上一篇:《自然—方法学》:闵玮团队研发基于振动光谱进行药物筛选的表型分析方法
下一篇:《自然》:栾升团队发现胞质钙稳态协调植物生长和免疫平衡