博文
化学反应标准态与平衡态的关联
|
标准态与平衡态是化学反应(相变)两个极其重要的概念,有必要进一步明确两者的关联.
范特霍夫平衡箱
热力学中化学反应(相变)通常发生于恒温恒压及环境不提供有效功的条件下,该条件只能通过范特霍夫
平衡箱实现, 参见图1.
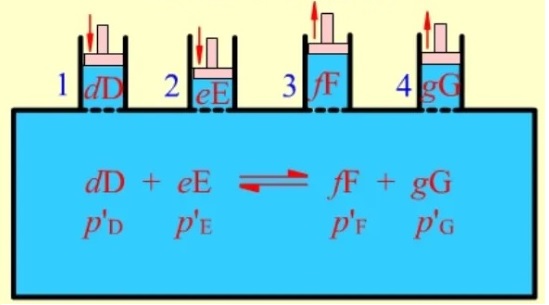
图1. 范特霍夫平衡箱
图1中范特霍夫平衡箱通常体积无限大,反应物与生成物的物质的量也无限多,温度及压强均恒定,并且反应已经建立了平衡;此时由加料口1及2分别加入d摩尔的反应物D和e摩尔的反应物E,反应结束后由出料口3和4分别导出f摩尔的生成物F和g摩尔的生成物G,实现反应进度ξ=1mol的反应.
由于加入和导出的反应物或生成物的物质的量相对于平衡体系而言,基本可忽略,反应进程中平衡箱的温度与压强可保持恒定,并且平衡体系也维持不变. 此时加料口及出料口各物质的分压可控,互相不影响.
2. 热力学等温方程
热力学等温方程是联系化学反应(相变)平衡态与标准态的关键纽带.
热力学等温方程为:ΔG=ΔGθ+RT·lnJ (1)
式(1)中“J”称反应商.
当化学反应(相变)建立平衡时,ΔG=0,J=Kθ.
此时, ΔGθ=-RT·lnKθ (2)
当系统处于标准态时,由式(1)可知: ΔG=ΔGθ,J =1.
因此化学反应平衡态的含义是反应商J=Kθ, 标准态的含义是反应商J =1.
3. 标准态
标准态是指系统所处的一个特定状态,它要求系统中所有物种均处于标准态, 即范特霍夫平衡箱的加料口及出料口各物质均处于标准态.
气相处于标准态,要求气相物种是分压为100kPa的纯净物(气相物质标准态并不涉及系统总压).
液相或固相处于标准态,要求液相或固相物种为100kPa压力作用下的纯净物.
溶液处于标准态,要求溶液中溶剂为100kPa压力作用下的纯净物;同时要求溶液中每一种溶质也为100kPa压力作用下的活度为1的纯净物(与拉乌尔定律或亨利定律无关).
标准态不限制温度,通常选取最多的温度是25℃.
4. 平衡态
平衡态是指热力学过程建立平衡时,系统所处的特定状态;并不是通常意义的状态(热力学平衡态);平衡态通常是指恒温恒压(恒温恒容、绝热恒压或绝热恒容)及环境不提供有效功的前提下,吉布斯自由能变ΔG(亥姆霍兹自由能变ΔA、焓变ΔH或热力学能变ΔU)等于0时,系统所处的状态.
系统处于平衡态时,系统各物种的物质的量不再改变,同时化学反应(相变)拥有各自的热力学平衡常数Kθ.
https://m.sciencenet.cn/blog-3474471-1335940.html
上一篇:准静态过程证明
下一篇:准静态过程假说与纯理想气体的化学势