博文
准静态过程假说原理(Ⅲ)
|
熵变计算是热力学过程研究的主要内容,本文拟结合准静态过程假说原理,探讨热力学过程熵变计算的一般方法.
元熵过程熵变的计算
元熵过程熵变计算原理:dS=δQ/T (1)
1.1 理想气体pVT变化过程熵变的计算
1.1.1 恒压过程
理想气体pVT变化的恒压过程,δQp=dH=n·Cp,m·dT (2)
将式(2)代入式(1)可得:dS=(n·Cp,m/T)·dT (3)
设Cp,m为与温度无关的常数,则式(3)积分可得:
ΔS=n·Cp,m·ln(T2/T1) (4)
1.1.2 恒容过程
理想气体pVT变化的恒容过程,δQV=dU=n·CV,m·dT (5)
将式(5)代入式(1)可得:dS=(n·CV,m/T)·dT (6)
设CV,m为与温度无关的常数,则式(6)积分可得:
ΔS=n·CV,m·ln(T2/T1) (7)
1.1.3 恒温过程
理想气体pVT变化的恒温过程,dU=δQ-pdV=TdS-pdV=0 (8)
由式(8)可得: dS=δQ/T=(p/T)·dV =(nR/V)·dV (9)
式(9)积分可得:
ΔS=nR·ln(V2/V1)=nR·ln(p1/p2) (10)
1.1.4 绝热过程
理想气体pVT变化的绝热过程,由式(1)可知:
dS=δQ/T =0 (11)
式(11)显示,对于元熵过程中的绝热过程,ΔS≡0.
[例1]. 某双原子理想气体1mol从始态350K,200kPa分别经①绝热可逆膨胀至50kPa;②反抗50kPa恒外压
不可逆膨胀至50kPa,试分别计算两过程的熵变.
解:由热力学基本方程可得 dU=T·dS-p·dV+δW’ (12)
对于理想气体pVT变化,δW’ ≡0;dU=nCV,m·dT
将上述结果分别代入式(12)可得:nCV,m·dT=-(nRT/V)·dV (13)
式(13)变量分离,并积分可得:
TVγ-1=k1 (14)
将理想气体状态方程pV=nRT代入式(14)可得:
pVγ=k2 (15)
Tγp1-γ=k3 (16)
式(14)、(15)及(16)是理想气体pVT变化过程中绝热过程的状态方程,与过程是否可逆无关.
依题:γ=Cp,m/CV,m=7/2·R/(5/2·R)=1.4
由式(16)可得:3501.4200-0.4=T1.450-0.4 (17)
解式(17)可得:T=236K
即两种情况下,系统所达到的终态均为(236K,50kPa), ΔS=Q/T≡0.
有必要再次指出,由于系统压强p与外压pe理化属性完全相同,体势变与体积功总是成对出现;体势变除补偿体积功外,剩余能量[-(p-pe)·dV]全部用于改变环境的熵变, pe对系统的终态不发生作用.
1.2 恒温恒压条件下的化学反应(或相变)熵变的计算
[例2]. 25℃标态下1mol乙醇完全燃烧反应是C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),试计算该燃烧反应的熵变.25℃标态下相关物质的热力学性质参见如下表1[1].
表1. 25℃标态下相关物质的热力学性质
| 物质 | ΔfHθm(kJ/mol) | ΔfGθm(kJ/mol) | Sθm(J·K-1·mol-1) |
| CO2(g) | -393.509 | -394.359 | 213.74 |
| H2O(l) | -285.830 | -237.129 | 69.91 |
| C2H5OH(l) | -277.69 | -174.78 | 160.7 |
| O2(g) | 0 | 0 | 205.138 |
解:依热力学基本原理可得
ΔrHθm(298.15K)=2ΔfHθm(CO2,g,298.15K)+3ΔfHθm(H2O,l,298.15K)- ΔfHθm(C2H5OH,l,298.15K)
-3ΔfHθm(O2,g,298.15K)
=2×(-393.509kJ·mol-1)+3×(-285.830kJ·mol-1)-(-277.69kJ·mol-1)-0
=-1366.818kJ·mol-1
ΔrGθm(298.15K)=2ΔfGθm(CO2,g,298.15K)+3ΔfGθm(H2O,l,298.15K)- ΔfGθm(C2H5OH,l,298.15K)
-3ΔfGθm(O2,g,298.15K)
=2×(-394.359kJ·mol-1)+3×(-237.129kJ·mol-1)-(-174.78kJ·mol-1)-0
=-1325.325kJ·mol-1
ΔrSθm(298.15K)=2Sθm(CO2,g,298.15K)+3Sθm(H2O,l,298.15K)- Sθm(C2H5OH,l,298.15K)
-3Sθm(O2,g,298.15K)
=2×213.74J·K-1·mol-1+3×69.91J·K-1·mol-1-160.7J·K-1·mol-1-3×205.138J·K-1·mol-1
=-138.904kJ·mol-1 (18)
恒温恒压条件下,依热力学基本方程可得: ΔrHθm(298.15K)=Qp+W'=Qp+ΔrGθm(298.15K)
由上式可得:Qp= ΔrHθm(298.15K)-ΔrGθm(298.15K)
=-1366.818kJ·mol-1-(-1325.325kJ·mol-1)=-41.493kJ·mol-1
恒温条件下,ΔrSθm(298.15K)=Qp/T=-41.493kJ·mol-1/298.15K=-139.168J·K-1·mol-1 (19)
对比式(18)及(19)结果可知,在计算误差允许范围内两者相等。表明ΔrSθm(298.15K)=Qp/T成立.
1.3 理想液态混合物混合过程熵变的计算
理想液态混合物中任一组分的化学势可表示为[2]:
μB(l)= μ*B(l)+RTlnxB (20)
依题理想液态混合物混合过程:
ΔmixG=∑{nB[ μ*B(l)+RTlnxB]}-∑[nB· μ*B(l)]
=RT∑(nB·lnxB) (21)
又因为:dG=-S·dT+V·dp+δW' (22)
所以: (23)
(23)
理想液态混合物混合过程,ΔmixG=RT∑(nB·lnxB),与压强无关,相当于过程恒压;另该过程不存在有效功,即:δW'≡0. 因此式(23)成立.
式(23)可变形为: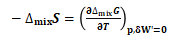 (24)
(24)
将式(21)代入式(24)可得:
ΔmixS=-R∑(nB·lnxB) (25)
另理想液态混合物混合过程为典型的恒容过程(混合前后,系统体积保持恒定),体势变WV(或体积功WT)均为0.
此时ΔmixU=QV=TΔmixS (26)
将式(25)代入式(26)可得: ΔmixU=QV=-RT∑(nB·lnxB) (27)
另依热力学基本方程可得:dA=-S·dT-p·dV+δW' (28)
理想液态混合物混合过程,dT=0(恒温);dV=0(恒容);δW' =0(不存在有效功)
将上述条件代入式(28),并积分可得: ΔmixA=0 (29)
式(29)显示理想液态混合物混合过程为热力学可逆过程[3].
2. 复熵过程熵变的计算
复熵过程是由若干个元熵过程组成,其熵变每个元熵过程热温商之和.
复熵过程熵变计算原理可表示为: (30)
(30)
2.1 理想气体pVT变化的熵变计算
[例3].理想气体由始态(p1,V1,T1)变化至终态(p2,V2,T2),试计算该复熵过程的熵变.
熵为状态函数,熵变数值只与系统始末态有关,与过程无关;可通过设计不同的元熵过程计算该复熵过程的熵变,计算结果参见如下式(31)、(32)及(33).
ΔS=nCV,mln(T2/T1)+nRln(V2/V1) (31)
ΔS=nCp,mln(T2/T1)-nRln(p2/p1) (32)
ΔS=nCV,mln(p2/p1) +nCp,mln(V2/V1) (33)
式(31)、(32)及(33)也为计算理想气体pVT变化熵变通式.
2.2 1千克25℃水与足够量0℃的冰常压下混合过程的熵变
解:该复熵过程可以拆分成①1千克25℃的水常压条件下降温至0℃;②一定量0℃的冰常压条件下熔化为0℃的水. 已知Cp,m(H2O,l)=75.291J·mol-1·K-1;ΔfHθm(H2O,l,298.15K)=-285.830kJ/mol;ΔfHθm(H2O,s,298.15K)=-292.72kJ/mol
依题:ΔS=ΔS1+ΔS2 (34)
对于①1千克25℃的水常压条件下降温至0℃;
ΔS1=nCp,mln(T2/T1)=1000g/(18g/mol)×75.291J·mol-1·K-1×ln(273.15K/298.15K)=-366.314J·K-1
Q1=nCp,mΔT=1000g/(18g/mol)×75.291J·mol-1·K-1×(273.15K-298.15K)=-104.570kJ
对于②一定量0℃的冰常压条件下熔化为0℃的水.
ΔS2=-Q1/273.15K=104.570kJ/273.15K=382.833J·K-1
代入式(34)可得:ΔS=ΔS1+ΔS2=-366.314J·K-1+382.833J·K-1=16.519J·K-1
3. 结论
⑴理想液态混合物混合过程为恒温恒容及环境不提供有效功条件下的热力学可逆过程;
⑵元熵过程:dS=δQ/T ;
⑶复熵过程: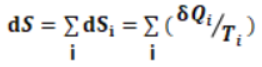
参考文献
[1]Lide D R. CRC Handbook of Chemistry and Physics. 89th ed, Chemical Co, 2008,17:2688
[2]天津大学物理化学教研室编. 物理化学(上册,第四版).北京:高等教育出版社,2001,12:182
[3]余高奇. 理想液态混合物混合性质的探讨.科学网博客,http://blog.sciencenet.cn/u/yugaoqi666.22,8
https://m.sciencenet.cn/blog-3474471-1389007.html
上一篇:准静态过程假说原理(Ⅱ)
下一篇:准静态过程假说原理(Ⅳ)