博文
准静态过程假说(热力学)中几个微积分问题
|
本文拟介绍准静态过程假说[1](或热力学)中几个微积分问题的处理方法,供参考.
准静态过程
为方便获取热力学过程的功、热值,同时为了方便将微积分原理应用于热力学,准静态过程假说规定所
有的热力学过程均为准静态过程; 即规定热力学过程的任意瞬间,系统均无限小的偏离平衡,并随时可恢复平
衡;热力学过程的推动力无限小(或趋近于0),无限缓慢;数学上连续、无间断,且可积可微.
对于元熵过程:δQ=T·dS (1)
δWV=-p·dV (2)
2. 吉布斯能(G)与微积分
准静态过程假说认为:U=TS+(-pV)+G (3)
对于元熵过程:dU=d(TS)+d(-pV)+dG
=T·dS+S·dT-p·dV-V·dp+dG (4)
又准静态过程假说规定:dU=δQ+δWV+δW' (5)
将式(1)及(2)代入式(5)可得:dU=T·dS-p·dV+δW' (6)
结合式(4)及(6)可得:dG=-S·dT+V·dp+δW' (7)
式(7)显示:dG的主要职责是提供有效功;“-S·dT及V·dp”两项是为了消除热能(TS)及功能(-pV)
对吉布斯能(G)的影响,额外增加的.
3. 化学势(μ)与微积分
准静态过程假说为了体现化学势的偏摩尔量属性,重新定义了化学势[2],参见如下式(8):
对于均相多组分系统中B组分,μB=GB/nB (8)
式(8)显示:B组分的化学势(μB)即为单位物质的量的B组分所拥有的吉布斯能;化学势是具有强度性质
的状态函数,其绝对值不可知.
另需强调偏摩尔量(包括化学势)的应用前提是系统状态确定.
由式(8)可得: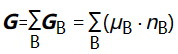 (9)
(9)
式(9)也称偏摩尔量集合公式.
式(9)微分可得: (10)
(10)
准静态过程假说约定:在(平衡)组成恒定的条件下,改变B组分的物质的量,其化学势(或μB)不变.
即: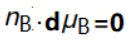 (11)
(11)
由式(11)可得: 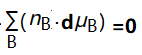 (12)
(12)
式(12)也称吉布斯-杜亥姆方程.
将式(12)代入式(10)可得:
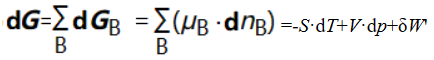 (13)
(13)
4. 表面张力(γ)与微积分
拉脱法所测蒸馏水的表面张力系数本质为一应力,与热力学无关;在此基础上,准静态过程假说提出了表
面张力的热力学定义[3],参见如下式(14).
γ=G/As (14)
式(14)显示:表面张力是单位表面积的物质所拥有的吉布斯能;表面张力是状态函数,其绝对值不可知.
由式(14)可得:G=γ·As (15)
式(15)微分可得:dG=γ·dAs+As·dγ (16)
准静态过程假说规定,在(平衡)组成恒定的条件下,改变分散度,物质的表面张力不变.
即:As·dγ=0 (17)
将式(17)代入式(16)可得:dG=γ·dAs =-S·dT+V·dp+δW' (18)
5. 结论
⑴在(平衡)组成恒定的条件下,改变B组分的物质的量,其化学势(或μB)不变;
⑵在(平衡)组成恒定的条件下,改变分散度(或AS),物质的表面张力不变.
参考文献
[1]余高奇.热力学第一定律研究.科学网博客, http://blog.sciencenet.cn/u/yugaoqi666,2021,8.
[2]余高奇. 再论化学势的吉布斯定义.科学网博客, http://blog.sciencenet.cn/u/yugaoqi666,2021,12.
[3]余高奇."表面张力"的客观性.科学网博客, http://blog.sciencenet.cn/u/yugaoqi666,2022,1.
https://m.sciencenet.cn/blog-3474471-1395384.html
上一篇:平衡态热力学与准静态过程假说的主要概念类比
下一篇:理想气体绝热膨胀系数(ε)