博文
代谢学人--代谢典藏 | Nature综述:脂肪代谢全攻略 (上篇)
|
Nature Reviews Endocrinology 综述
代谢典藏 |Nature综述:脂肪代谢全攻略 (上篇)
撰文 | 许赛男 陈俊桐 王赛男 胡天惠 邱瑾
编辑 | 孟美瑶

引言
古人曰:春天不减肥,夏天徒伤悲!那么怎么减?如何减?孙子兵法来起步——知己知彼,百战不殆。减肥之前先来了解你身上的小肉肉吧(白色脂肪),福利来喽!2021年2月24日在Nature Reviews Endocrinology上在线发表的一篇标题为 “Lipid and glucose metabolism in white adipocytes: pathways, dysfunction and therapeutics” 的综述,以温故而知新的方式,将脂肪细胞最新研究进展娓娓道来。
关于脂肪细胞你所需知道的大部分知识都在里面啦!快来和小编一起围观吧。
▼ 关键点(Key points)
白色脂肪细胞的大小和周转率是人体全身胰岛素敏感性和心血管代谢表型的决定因素。
白色脂肪细胞专门用于脂肪储存和动员,其中涉及的脂质代谢途径与控制葡萄糖胞内命运的途径紧密相连。
在一些脂肪库中,存在白色和米色脂肪细胞间的双向转换,米色脂肪可通过UCP1(解偶联蛋白1)依赖和UCP1非依赖的氧化途径进行能量耗散。
在哺乳动物中,白色脂肪细胞是一种专门储存(以甘油三酯形式)和调动(以脂肪酸形式)能量的细胞,其代谢脂肪组织维持全身能量平衡有重要作用。白色脂肪代谢功能障碍是胰岛素抵抗和相关代谢紊乱发生发展中的重要事件。本文总结了近期白色脂肪细胞中脂质和糖代谢途径研究的新进展。我们调研了大量脂肪细胞肥大在人类中关键作用以及脂肪细胞和体内脂质周转速度的相关文献,在分子水平上,总结了新发现的调控因子,以及在不同生理状态下,各代谢途径之间的互作是如何精密调控脂肪酸和葡萄糖的合成与分解代谢的;肥胖相关代谢性疾病、脂肪萎缩、癌症和癌症相关恶质症等疾病发生过程中所涉及的代谢改变;并提出在研究过程中的诸多挑战:包括如何确定不同年龄、不同位置的白色脂肪细胞的异质性以及如何建立起节律调控和脂质代谢之间的联系。靶向白色脂肪代谢能够实现病人的精准分类,为将来提供更广泛的潜在治疗方式。
▼ 名词解释
脂肪组织肥大——脂肪组织通过脂肪细胞尺寸的增加而扩张。
白色脂肪组织(WAT)最开始被认为是一种主要起到保温作用的惰性组织,但自二十世纪中期起,WAT在能量平衡中的作用越来越被重视,因为它能够利用葡萄糖,并且还能储存和释放富含能量的脂肪酸(图1)。脂质主要以三酰甘油(TAG)的形式,以单房脂滴形态储存在成熟白色脂肪细胞中,在其他细胞(包括棕色脂肪)中则以多房脂滴形态储存。在1964年,胶原酶的发现为TAG代谢的研究铺平了道路,研究人员通过胶原酶消化从体内分离出相当纯净的脂肪细胞到体外培养,让人们更了解TAG的摄取、合成和水解(脂解)过程;1976年发现了肥大的脂肪细胞中存在葡萄糖代谢缺陷;1980年发现了胰岛素刺激脂肪细胞中葡萄糖运输机器向质膜转移的机制;20世纪90年代初,人们了解到WAT是一个内分泌和炎症器官,特别是随着瘦素和脂联素的发现,为这一领域的研究增加了新的维度。同时,有关WAT是一个主要的代谢调节器的研究也在不断拓展。
在WAT包含的多种细胞类型(BOX1)中,脂肪细胞是专门调节能量代谢的一类细胞。代谢改变促使脂肪细胞由正常向功能失调状态转变,并导致全身性的代谢失调。这篇综述重点介绍了目前白色脂肪细胞中葡萄糖和脂质代谢途径,以及在WAT过剩(如肥胖和相关的2型糖尿病(T2DM)或WAT贫乏(如脂肪营养不良和恶质症)情况下所导致的机体功能障碍。此外,作者还讨论了针对白色脂肪代谢的治疗前景以及该研究领域的一些还未解决的问题。
▼ BOX1:白色脂肪组织中细胞类型的多样性
葡萄糖代谢途径与脂质代谢是相关联的,特别是通过脂肪酸和甘油的从头合成。根据解剖位置和生理条件(如寒冷环境或特定季节)的不同,白色脂肪库中含有不同数量的米色脂肪细胞,这些米色脂肪细胞可能来源于前体细胞的分化或白色脂肪细胞与米色脂肪细胞可逆的相互转化。米色脂肪细胞中富集线粒体,并具有几种允许能量以热量形式消散的途径。
WAT的血管基质组分(SVF)中包含免疫细胞和非免疫细胞。非免疫细胞包括祖细胞和内皮细胞。祖细胞具有分化为白色或米色脂肪细胞的潜力,并与成纤维细胞一起,在细胞外基质的产生和纤维化中发挥重要作用。内皮细胞构成内皮层,为血液和脂肪之间提供屏障和物质交换场所起着关键的作用。在WAT中有丰富的免疫细胞种类,其中巨噬细胞数量最多。
最初将脂肪组织巨噬细胞分为促炎细胞和抗炎细胞的二元分类现在已经不是很准确了。如已发现一些巨噬细胞专门清除脂质,其他髓系细胞(如树突状细胞和中性粒细胞)和各种淋巴细胞群参与免疫反应和组织重塑。
脂肪细胞和SVF组分的一些细胞类型(特别是巨噬细胞)分泌被称为脂肪因子的多肽(如瘦素、脂联素、RBP4、FABP4和肿瘤坏死因子)以及被称为脂因子的脂质分子(如羟脂肪酸的脂肪酸酯和12,13-diHOME)。这些因子可以局部作用于邻近细胞(旁分泌作用)或远程作用于其他器官的细胞(内分泌作用)。此外,免疫细胞和内皮细胞可与局部神经纤维交流。这种相互作用可以通过引发神经-体液信号来调节全身代谢。
脂肪细胞大小和周转率
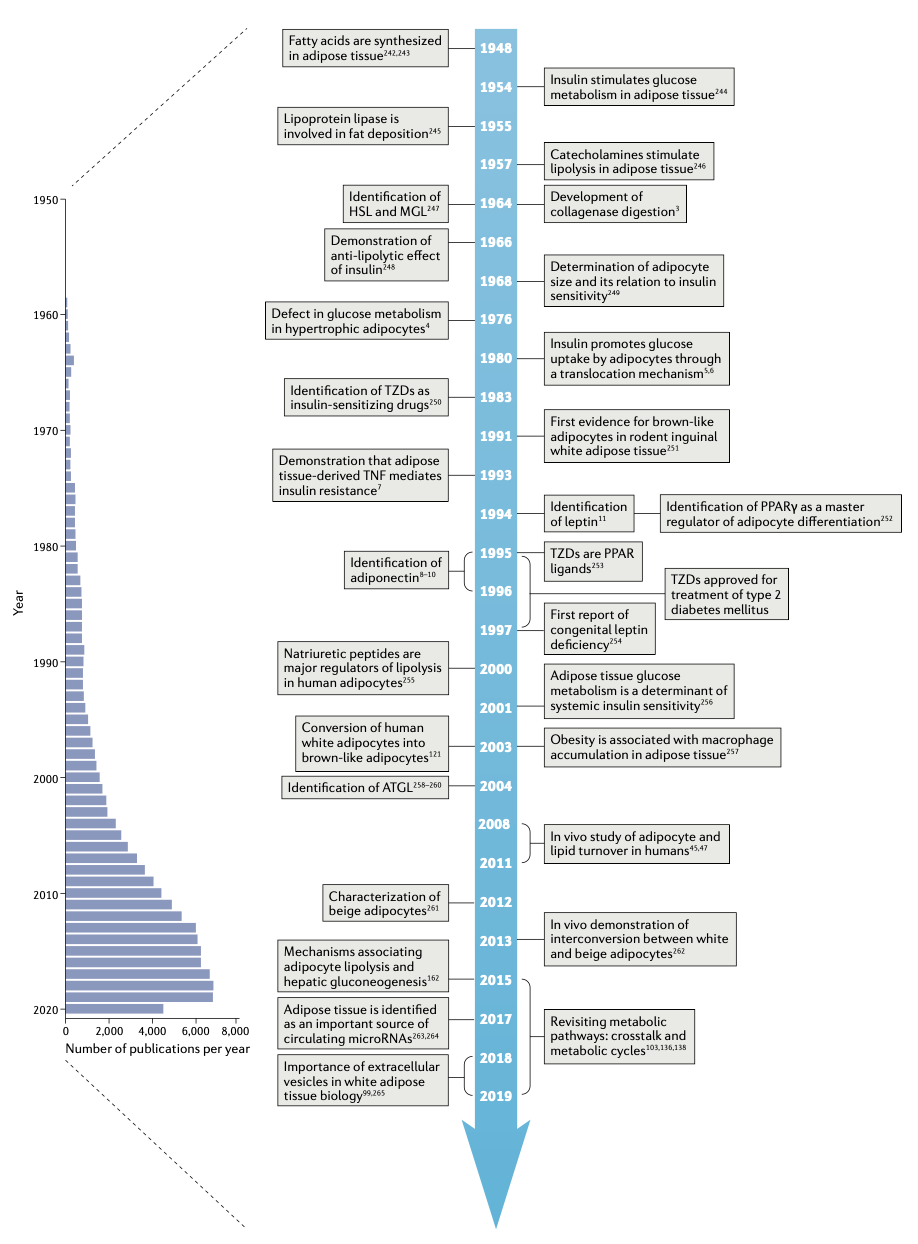
细胞大小和周转率是决定白色脂肪细胞代谢和脂肪量的主要因素,其改变与病理状态密切相关(图2a,b)。自从20世纪60年代末和70年代开发出测定脂肪细胞大小的方法以来,研究人员发现无论是同一个体的不同脂肪之间,还是不同个体之间的脂肪细胞大小差异很大,平均脂肪细胞大小会随体重的改变而改变。从临床角度而言,最显著的是脂肪细胞大小与心血管代谢状态间的关系。众多研究表明大的脂肪细胞增大与心血管代谢紊乱间的相关性,包括罹患T2DM的风险,以及与胰岛素抵抗、血脂紊乱和高血压相关(BOX2)。脂肪组织可以通过两种方式变大,即脂肪组织肥大(肥大性WAT)或脂肪组织增生(增生性WAT)(图2b)。肥大型WAT的特点是脂肪细胞大,其可以通过两种方式来累积脂质,即形成少量大脂肪细胞,或在已存在的脂肪细胞中储存更多的脂质。增生性WAT的特点是比正常或肥大性WAT脂肪细胞数量更多、脂肪细胞直径更小。这是因为在脂质增加过程中,随着前体细胞分化,产生了更多的小脂肪细胞。在人类中,这两种脂肪组织形态与体重无关,肥胖症患者中通常同时存在WAT肥大和WAT增生。WAT肥大与较差的心血管代谢指数相关。
新生脂肪细胞的形成和分化是一个复杂的过程,受多种信号通路的调控,例如:核受体过氧化物酶体增殖体激活受体-γ(PPARγ)、它的共激活物PGC1α以及Wnt和Notch信号通路。小鼠实验为研究脂肪分化的调控提供有力支持。该过程被低稳态氧化应激通过改变脂肪细胞前体的线粒体功能而抑制。肥胖小鼠中的脂肪分化至少部分由机械敏感的阳离子通道Piezo1和FGF1信号通路所介导。通过特异性基因敲除小鼠发现,脂肪细胞胰岛素受体对脂肪细胞的周转率有重要影响。最后,乳腺脂肪细胞周转率的调控具有其独特性。这些细胞在怀孕阶段去分化,并在哺乳阶段保持去分化状态。断奶后,去分化细胞增殖并重新分化为脂肪细胞。目前在小鼠和人类中发现了脂肪前体细胞的多种来源,在人类中的来源之一是骨髓干细胞。平均而言,骨髓前体细胞贡献了总脂肪细胞库的10%,而在肥胖症中这一数字会增长一倍(图2a)。
脂肪的解剖学位置也会影响脂肪组织特征。皮下WAT占人体总脂肪的80%以上,而内脏脂肪在女性和男性中分别占人体总脂肪的10%和20%。内脏脂肪库虽然较小,但通常被认为比较大的皮下脂肪库更有害,因为内脏WAT肥大常与胰岛素抵抗和心血管代谢紊乱有关。然而,不同区域的脂肪组织也会造成不同的病理结果。有研究表明,内脏脂肪细胞肥大主要与血脂异常有关,而皮下脂肪细胞肥大主要与胰岛素抵抗有关。此外,皮下WAT里的脂肪细胞缩小后可提高肥胖症患者的胰岛素敏感性。在内脏WAT中,脂肪细胞肥大与M1型巨噬细胞或B细胞介导的炎症间的关系可能与胰岛素抵抗有关,而在皮下WAT中不存在这种关系。值得注意的是,脂肪细胞大小和临床表型之间并不一定具有因果联系,但脂肪细胞大小与T2DM间的关系是个例外:前瞻性研究发现皮下脂肪细胞增大会增加罹患T2DM的风险。
整体来看,WAT重量是由脂肪细胞和脂质的周转速度共同决定的。通过研究自由活动生物个体DNA中大气14C的掺入,在体研究细胞周转率方面的工作取得了突破性进展。该方法已被用于确定人类皮下脂肪细胞的年龄和周转率,发现平均每年这些细胞会有10%被更新。在肥胖症中,由于脂肪生成速度变快,全身脂肪细胞的周转率增加了约两倍。重要的是,WAT肥大与较低的新生脂肪细胞产生率有关,这一现象不收体脂大小影响。
▼ BOX2:胰岛素抵抗
胰岛素抵抗可以是器官特异性的(如影响肝脏而不影响骨骼肌,反之亦然)或通路特异性的(对肝脏糖异生的影响受损而不影响脂质从头合成)。这种选择性被认为是因为不同的分子缺陷会不同程度的影响胰岛素信号通路。
目前的观点认为,脂肪细胞功能障碍是胰岛素抵抗的早期主要事件,因为WAT会通过改变代谢通量影响肝脏和骨骼肌。然而,不同代谢器官功能障碍的动力学在人类中尚不清楚。肠道(通过微生物群和消化相关功能)以及大脑(通过神经内分泌控制新陈代谢)也可能在胰岛素抵抗中发挥重要作用。
胰岛素抵抗导致胰岛β细胞负担增加,胰岛β细胞会更多的分泌胰岛素作为对胰岛素失去敏感性的一种补偿机制。当β细胞功能下降时,空腹和餐后血糖水平升高,是2型糖尿病发病的信号。在其他多种病理条件下也存在胰岛素抵抗现象,如多囊卵巢综合征、脂肪营养不良、非酒精性脂肪性肝病、心血管疾病和某些癌症。
白色脂肪细胞的脂质周转
14C方法被进一步用于确定人类脂肪细胞内脂质的年龄和周转参数(图2c)。人类脂肪细胞中的脂质在其约10年的寿命中平均更新6次,使用多同位素成像质谱法也印证了这一事实。通过脂龄数据建模可以确定脂肪细胞脂质存储(即脂质输入;Kin)和去除(即脂质输出;Kout)的速度。横断面研究表明,体重增加与皮下脂肪细胞的脂龄增加(周转率降低)有关,这一现象在超重人群中已经存在,并由于Kin增加和Kout降低共同导致。
在内脏区域,只有严重肥胖的个体才会出现脂质周转率下降的现象。这种区域性差异可能解释了为什么在超重或肥胖的个体中,内脏的脂质动员通常比皮下WAT更快,也可以部分解释为什么内脏脂肪比皮下脂肪更有害,因为内脏脂肪活跃的高脂肪酸输出通过门静脉输送到肝脏,从而对肝脏代谢产生直接影响。对皮下WAT的纵向研究表明,无论体重如何变化,随着年龄的增长,脂质周转率都会下降(即脂龄增加)。如果Kout的减少没有被Kin的减少所抵消,那么身体脂肪将随着时间的推移而积累(图2c)。
在减重手术后体重明显下降的肥胖症患者中,脂肪细胞脂质周转率增加能使其术后的体重减轻得以维持;相反,那些脂质周转率没有增加的患者,长期而言体重依旧会回升。此外,有胰岛素抵抗的个体和有家族性或常见的血脂异常情况的患者,脂肪细胞脂质周转率降低。这些数据凸显了脂肪细胞和脂质周转的重要性,但在生理和病理状态下,这两个过程的短期调控在很大程度上仍然未知。
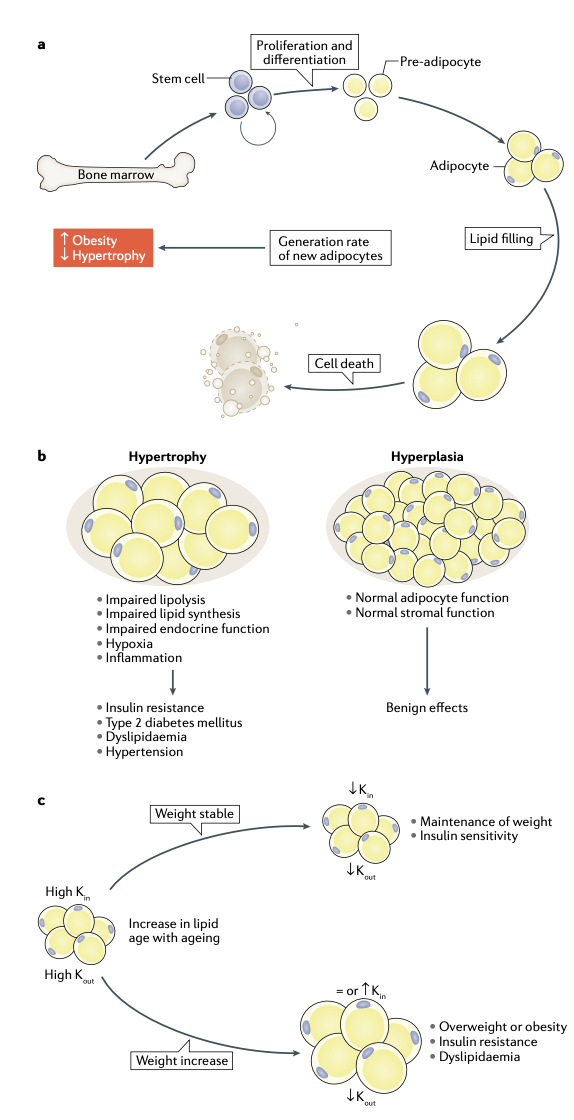
图2:人类白色脂肪组织周转率。脂肪细胞形成与病理情况之间的联系示意图。a. 脂肪细胞生成和死亡是两个不间断发生的事件。祖细胞在脂肪库内的不同壁龛(niche)中增殖,这些细胞一部分来源于骨髓。在肥胖症中,新的大脂肪细胞和/或小脂肪细胞生成率增加。当这一生成率降低时,形成的脂肪细胞变少,但脂肪细胞会更大,这一过程被称为肥大(hypertrophy)。b. 脂肪重量可以通过两种方式增加。一种是肥大(hypertrophy),形成一定数量的大脂肪细胞的或脂质在已有脂肪细胞中累积。另一种是增生(hyperplasia),前体细胞增殖并分化成大量的小脂肪细胞。脂肪细胞肥大与不良的心血管代谢表型有关,而相同脂肪重量下的脂肪细胞增生则对身体有好处。c. 脂肪细胞脂质周转速率随年龄增长而降低,证据是随年龄增加,脂龄逐渐增加。这一速率的降低使得脂肪细胞的脂质去除率(Kout)下降。如果Kout的降低被脂质储存率(Kin)的降低所抵消,则脂肪重量保持不变,而如果Kin不降低(或增加),则脂肪重量会随着时间的推移而增加。
脂肪储存
储存在脂肪细胞中的大部分脂肪酸来源于循环血中的TAG。循环系统中的TAG通常由血浆脂蛋白转运,如极低密度脂蛋白(VLDL)和乳糜微粒(图4)。这些TAG被脂蛋白脂酶(LPL)水解后,脂肪酸迅速进入脂肪细胞,其转运既可以通过被动扩散,也可以通过蛋白质(脂肪酸转运体)介导的主动运输。脂肪酸转位酶CD36位于质膜脂质微区,与质膜上的脂肪酸结合蛋白协同作用,促进长链脂肪酸的摄取。随后,脂肪酸转运蛋白和长链酰基辅酶A合成酶介导脂肪酸转运并将其酰基化为酰基辅酶A衍生物,进而与甘油-3-磷酸骨架发生酯化反应,最终以TAG的形式储存在脂滴中。脂肪储存过程受到胰岛素的激活(图4)。在饱食状态下,葡萄糖通过糖酵解产生甘油-3-磷酸,甘油-3-磷酸可进一步与脂肪酸发生酯化作用,该酯化过程可看作甘油-3-磷酸的逐步激活过程,即在细胞质基质中通过一系列酶的串联反应,即甘油-3-磷酸酰基转移酶、1-酰基-甘油-3-磷酸酰基转移酶(AGPAT2)、磷脂酸磷酸酶(也称为lipins)和二酰基甘油酰基转移酶(DGATs)的顺序作用来进行。众多证据表明,大蛋白间的相互聚集能够各个酶促反应通路的区域化和如底物及中间产物的局部高浓度,利于反应的高效进行。然而,对将脂肪酸和酰基辅酶A恰当的导入到白色脂肪细胞特定途径的蛋白质复合物仍了解不多。在脂肪形成途径中,DGATs是重要的调节因子,能够催化DAG转化为TAG。有研究发现,在正常饮食的条件下,脂肪中特异性敲除Dgat1或Dgat2的小鼠脂肪发育依然正常,说明任一种DGATs亚型均能支持TAG生成和储存。但在HFD条件下,脂肪特异性Dgat1敲除小鼠的WAT存储量略微降低,并存在脂质在肝脏和骨骼肌中的异位沉积和胰岛素抵抗,而脂肪特异性Dgat2敲除小鼠中不存在这样的现象。DGAT1可能在脂质分解增加的情况下促进脂肪酸再酯化,从而抑制脂肪酸诱导的内质网应激和脂肪细胞炎症,从而缓解胰岛素抵抗。
除了上述的外源性脂肪合成途径外,脂肪细胞中储存的脂肪酸通过内源性合成而来自葡萄糖,这一途径被称为脂质从头生成(DNL)(图4)。葡萄糖通过胰岛素敏感的GLUT4和非胰岛素敏感的GLUT1转运到脂肪细胞中,并通过糖酵解和三羧酸循环(TCA)代谢产生DNL所需的柠檬酸。进而在ATP柠檬酸裂解酶(ACLY)和乙酰辅酶A羧化酶(ACC1)作用下分别产生乙酰辅酶A和丙二酰辅酶A,它们是长链脂肪酸的前体分子,可在脂肪酸合酶(FASN)作用下合成棕榈酸。此外,在白色脂肪细胞中,乙酰辅酶A也可以通过酰基辅酶A合成酶(ACSS2)转化乙酸来生成。在各种生理病理状态下,ACLY和ACSS2这两种内源性脂肪合成途径对乙酰辅酶A库的相对贡献仍不清楚。随后,由脂肪酸延长酶和去饱和酶修饰新合成的棕榈酸的长度和不饱和程度。在体内,由于肝脏新合成的脂肪酸会被转运到脂肪组织并以TAG的形式储存,故脂肪组织DNL程度的评估因为肝脏DNL的贡献而变得复杂。在长期葡萄糖输注的情况下,人类脂肪组织中观察到脂肪酸的从头合成。但在日常生活中,人体脂肪组织来源于脂肪DNL的脂肪酸很有限。
脂肪动员
在能量匮乏的状态下(如禁食和锻炼),伴随着TAG的水解,WAT脂滴中的脂质被大量动员。神经内分泌对脂质分解的调控以及相关的信号通路已在其他综述中阐述。在人类脂肪细胞中,儿茶酚胺、利钠肽和胰岛素是脂解过程的主要激素调节因子(图3)。此外,许多自分泌和旁分泌因子通过激活G蛋白偶联受体发挥抗脂解作用;局部产生的炎症介质,特别是肿瘤坏死因子,可以通过特定的信号转导途径调节基础脂解代谢。
在脂肪细胞中,TAG的分解过程中有三种中性脂肪酶参与。第一种是甘油三酯脂肪酶(ATGL,由PNPLA2编码),是TAG水解为DAG(甘油二酯)的主要酶。全身和脂肪细胞特异性Pnpla2基因敲除小鼠均表现出基础状态和响应刺激下的脂解代谢显著减少,在人类脂肪细胞中敲除Pnpla2也观察到类似现象。人类中导致ATGL失活的突变与脂解信号刺激下甘油和脂肪酸生成率降低,以及会导致肌肉病变的中性脂质储存疾病相关。与此类疾病有关的一个出人意料的表现是,携带此类突变的人群的体脂含量并没有明显改变。第二种酶是激素敏感脂肪酶(HSL,由LIPE编码),其作用是水解DAG,但同时也具有TAG水解活性。在小鼠和人类中,全身HSL敲除导致脂肪组织中DAG累积并且对脂解代谢信号刺激的响应降低。第三种酶是单甘酯脂肪酶,催化单酰甘油水解成甘油和一分子脂肪酸。关于单甘酯脂肪酶敲除小鼠的研究表明,HSL也参与白色脂肪组织中单酰甘油的水解。
脂肪酶的活性取决于它们在细胞内的定位以及与辅因子的相互作用(图3)。ATGL定位于脂滴,其活性由多种脂滴相关蛋白调节。例如,CGI58(由ABHD5编码)是ATGL响应脂解信号并表现出充分酶活性所必需的。在人类和小鼠中,ABHD5基因突变会导致脂肪组织中TAG累积。与此相反,G0S2和FSP27(也称为CIDEC)可以通过与ATGL直接相互作用来抑制ATGL的活性。周脂素1(Perilipin 1,PLIN1)是脂肪细胞脂滴中的主要蛋白质,通过将CGI58猝灭在非激活状态来抑制ATGL功能。当受到脂解信号刺激时,PLIN1磷酸化,并使CGI58从PLIN1中释放,使其能够与ATGL相互作用。PLIN1还可通过直接与HSL结合来增加HSL活性。脂肪酸结合蛋白(FABP4)也能够与磷酸化的HSL结合并移位到脂滴以调节HSL的脂解活性。此外,PTRF(由CAVIN1编码)与caveolin 1(由CAV1编码)相互作用来稳定胞膜窖(质膜上的胞膜穴样内陷,能够控制脂质运输),PTRF进而招募HSL到胞膜窖来促进脂肪分解。人类脂肪细胞表达CIDE家族的另一个成员--CIDEA,其表达水平高于小鼠白色脂肪细胞。CIDEA定位于脂滴来调控基础脂解,也可作为转录辅助因子定位于细胞核。在白色脂肪细胞中,蛋白质在脂滴和细胞核之间的穿梭是偶联转录调控和代谢途径的一种全新的潜在模式。蛋白质组学研究已经发现了与脂滴成熟和脂肪酸储存有关的脂滴相关蛋白质,同时也发现了一些未知蛋白质,其功能需进一步研究确认。
除了中性脂肪酶参与的经典脂解途径外,还存在一些其他脂解途径。体外实验表明,脂噬(自噬小体吞噬脂滴后,TAG被溶酶体酸性脂肪酶水解)可以促进β肾上腺素能受体刺激的脂解作用。研究发现,脂肪细胞特异性Atg7(关键的大自噬基因)敲除小鼠表现出WAT下降,并出现棕色脂肪样细胞,这一表型可能由脂肪细胞分化受损而不是成熟脂肪细胞的脂解作用受到抑制所造成。此外,有研究显示存在脂肪酶非依赖的、通过释放脂滴来源的外泌体样囊泡来动员脂质的途径。在小鼠体内,WAT中每天约1-2%的脂质通过外泌体形式释放。总之,近年来不依赖中性脂肪酶的新的脂质降解途径陆续被发现。然而,这些途径在脂滴TAG水解过程中的重要性以及在病理生理条件下的调控作用仍不清楚。

图3:白色脂肪中的脂质动员。在基础条件下,胰岛素通过激活PDE3B (磷酸二酯酶3B) 降解cAMP来抑制脂解(part a)。cAMP合成的作用则通过激活具有抗脂解作用的偶联Gαi的GPCRs来实现。NPRC(利钠肽受体C)能够促进ANP(心房利钠肽)和BNP(脑利钠肽)的清除,使得这些NPs(利钠肽)不发挥脂解作用。由于ATGL激活剂CGI58与脂滴包被蛋白PLIN1 (perilipin1)的相互作用,ATGL催化的TAG水解被限制在最低程度。FSP27和G0S2是ATGL活性的负调因子。与FSP27一样,CIDEA也是CIDE家族的成员,调控基础脂解。NPs和儿茶酚胺与抑制性受体复合物(part a)或激活性受体复合物(part b)结合后的平衡效果最终决定它们对脂解的净作用。在刺激条件下,ANP和BNP(通过NPRA)和儿茶酚胺(通过β-肾上腺素能受体与Gαs偶联)分别诱导cGMP和cAMP的水平增加(part b)。蛋白激酶PKG和PKA使HSL磷酸化,促使其从胞浆转位到脂滴与PLIN1相互作用。HSL与脂肪酸结合蛋白FABP4结合。CGI58从磷酸化的PLIN1中脱离后能够与ATGL相互作用。ATGL、HSL和单甘油酸脂肪酶(图中未显示))依次催化TAG水解为脂肪酸和甘油,这些脂肪酸和甘油通过专门的转运体从脂肪细胞中释放出来,或在 TCA循环中被氧化。PTRF(也称为cavin1)参与HSL被招募到脂滴的过程,它也与caveolin1(CAV1)一起是胞膜窖的组成型成分,并在胞膜窖参与脂肪酸运输。
糖代谢
多项研究表明,脂肪组织中脂质合成酶和同源转录因子的表达,尤其是碳水化合物反应元件结合蛋白(ChREBP),与胰岛素敏感性呈显著的正相关,提示DNL对脂肪细胞和整体代谢的贡献不仅仅局限于为脂质储存提供脂肪酸。有证据表明,DNL能够调节脂肪细胞膜流动性和胰岛素信号。DNL也可能与其他代谢途径相互作用,调节脂类物质生成,从而调控全身的胰岛素敏感性。此外,脂肪特异性Fasn敲除小鼠实验表明,DNL的产物不仅参与交感神经信号传递;还参与白色脂肪细胞转化为米色脂肪细胞过程;并能促进棕色脂肪组织(BAT)的生热能力。
令人惊讶的是,糖代谢的重要前期反应步骤并没有在脂肪细胞中得到彻底的研究;关于脂肪细胞糖酵解作用的研究也很少。研究发现,在禁食和饥饿期间,叉头转录因子K1和K2(FOXK1和FOXK2)诱导细胞进行有氧糖酵解,这一细胞代谢重编程导致乳酸生成增加(图4)。早在30年前,白色脂肪细胞就被认为是乳酸的重要生产者,后来在人类中得到证实,并在近期使用示踪标记再次得到印证。在体内实验中,果蝇脂肪小体(兼具哺乳动物WAT和肝脏的特征)的乳酸生成障碍能够增强全身葡萄糖利用率。因此,WAT产生的乳酸似乎影响全身乳酸周转率。乳酸是一种代谢中间物,其可在包括肝脏在内的大多数组织中进入TCA循环进行糖异生作用。乳酸的产生使糖酵解和TCA循环解偶联,特别是在禁食状态下。这种解偶联可能会降低全身葡萄糖利用,并成为脂肪细胞中葡萄糖碳命运复杂调控的一部分,包括乳酸生成、甘油-3-磷酸合成、DNL和葡萄糖氧化。在对脂肪组织功能异质性的研究中,发现存在糖酵解代谢增强的白色脂肪细胞亚群,以及DNL增加的细胞亚群。这些细胞亚群共存于同一脂肪库中,但在不同脂肪库中的相对比例却不尽相同。虽然WAT的异质性已在其他综述中阐明,但这种异质性在病理生理学中的重要性仍有待进一步确定。
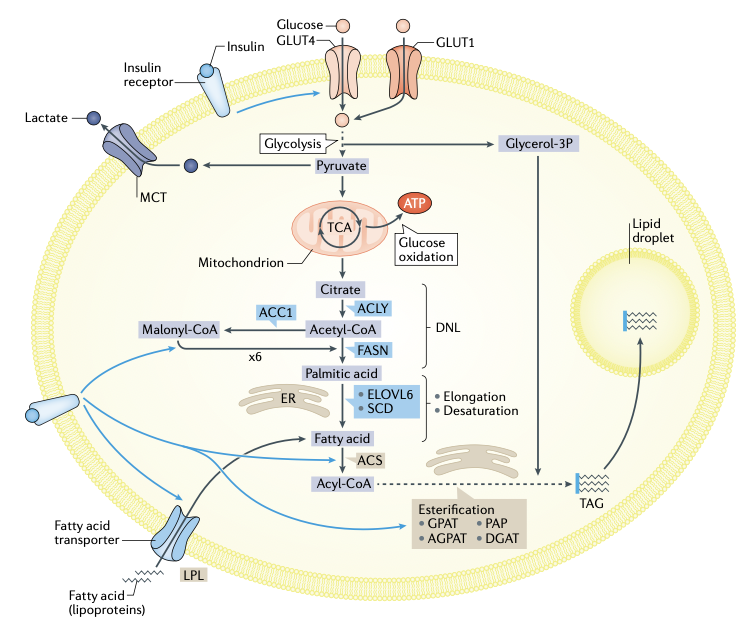
图4:白色脂肪细胞中的脂质储存和葡萄糖代谢。在脂肪细胞中,GLUT4和GLUT1分别是胰岛素敏感型和非胰岛素敏感型葡萄糖转运体。在糖酵解过程中,部分葡萄糖分子转变成甘油-3-磷酸(Glycerol-3P),为TAG(三酰甘油)提供骨架。此外,脂肪细胞对机体内乳酸的周转率也有重要贡献。糖酵解以后,葡萄糖可进一步在三羧酸循环(TCA)中被氧化产生能量或者进入脂肪酸从头合成途径(DNL)转化为脂肪酸。DNL受胰岛素控制,在ACLY(ATP柠檬酸裂解酶)、ACC1(乙酰辅酶A羧化酶)、FASN(脂肪酸合酶)的顺序作用下合成棕榈酸(Palmitic acid),随后ELOVL6(极长链脂肪酸延长酶6)和SCD(硬脂酰辅酶A去饱和酶)分别修饰新合成的棕榈酸的长度和不饱和度。DNL产生的脂肪酸可被用于细胞膜磷脂的组成成分,可以充当胞外信号分子,也可以以TAG的形式储存在脂滴中(但相较于外源脂肪酸略少)。胰岛素通过激活LPL(脂蛋白脂酶)来促进脂肪酸载脂蛋白的水解,使得脂肪酸通过特定的脂肪酸转运体进入细胞。同时,胰岛素还能促进脂肪酸的酯化,酯化反应通过ACS(脂酰CoA合成酶),GPAT(甘油-3-磷酸酰基转移酶)、AGPAT(1-酰基-甘油-3-磷酸酰基转移酶)、PAP(磷脂酸磷酸酶,也称为lipin)和DGAT(二酰基甘油酰基转移酶)的顺序作用来进行。ER:内质网;MCT:单羧酸转运蛋白。
关于白色脂肪细胞的脂质和糖代谢的研究进展介绍就到这里啦!
就知道你们还没看够,
我们下期再见!
关注微信公众号代谢学人
了解更多代谢前沿资讯

转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:http://blog.sciencenet.cn/blog-3483272-1303878.html
https://m.sciencenet.cn/blog-3483272-1309229.html
上一篇:代谢学人--Nature Metabolism:肌肉发达头脑简单?NO!NO!NO!
下一篇:代谢学人--Science子刊近期代谢精选与解析