博文
代谢学人--Cell Metabolism:Sucnr1--守护脂肪细胞,维持代谢稳态
||
代谢学人
Cell Metabolism:Sucnr1--守护脂肪细胞,维持代谢稳态
撰文 | 郭钰涵 武霞 于柳 徐梓禾
编辑 | 孟美瑶
校对 | 武霞

背景介绍
“信号代谢物(signaling metabolites)”的概念在代谢稳态的控制中越来越受到关注。例如,酮体作为一种信号代谢物,在代谢调节和衰老疾病中发挥着重要作用。一般来说,酮体β-羟基丁酸酯(βOHB)被视为空腹或运动时从肝脏到外周组织的能量载体。除了作为能量载体,βOHB还能通过细胞外受体发出信号,并作为组蛋白去乙酰化酶(HDACs)的内源性抑制剂。Krebs循环底物琥珀酸是一种多效代谢物,通过琥珀酸受体1(SUCNR1)发挥类似于激素和细胞因子的作用,也属于这类新的代谢物。SUCNR1在组织中广泛表达,在白色脂肪组织(WAT)中含量丰富。人们普遍认为SUCNR1在健康组织中功能不活跃,多年来,SUCNR1主要在炎症相关病症中被研究,特别是在那些与慢性高琥珀酸血症相关的患者中进行研究。有研究表明,Sucnr1参与糖尿病视网膜病变、心脏肥厚、肝纤维化和坏死的调控机制,这扩大了其在免疫调节中的作用。慢性高琥珀酸血症患者表现为血浆中含有高浓度的琥珀酸盐(71.5-129.8µM),患者血浆omega-6氧磷脂水平较高,会引发炎症反应,增加心血管疾病发生的风险。
然而,最近的研究表明,细胞外琥珀酸在包括运动、寒冷暴露或食物摄入等生理刺激下会短暂增加。因此,琥珀酸作为组织应激和代谢的报告者出现,开启了它作为激素样代谢物参与其他代谢功能的可能性。事实上,SUCNR1的“琥珀酸感应”可能是控制能量稳态的代谢感应机制的一部分。
脂肪组织是调节全身能量稳态的中心部位。WAT既是一个关键的能量库,又是一个内分泌器官,其通过产生一系列的分泌因子,在中枢和外围发挥作用,以控制代谢活动。这些分泌因子中最主要的是瘦素,它通过中枢神经系统(CNS)信号调节食物摄入,进而控制脂肪组织质量。循环瘦素水平与脂肪储存成正比,并在进食后增加。1994年瘦素的发现使我们对脂肪组织概念发生转变(小编注:瘦素的发现改变了人们对脂肪组织的看法,从被动的惰性的储存能量器转变为具有主动调节行为和代谢的动态内分泌器官),但脂肪细胞如何调节瘦素的产生仍然是个谜。许多研究试图阐明瘦素在外周组织和中枢神经系统组织中的作用,并解释肥胖症中的瘦素抵抗。目前为止,只有少数物质被发现是瘦素表达和分泌的调节因子,包括胰岛素、糖皮质激素和儿茶酚胺。
虽然SUCNR1在脂肪细胞中高表达,但目前为止,它在该组织中唯一的功能是抑制脂解。先前的研究发现,柠檬酸循环中间体琥珀酸盐可以激活Gpr91(Suncr1),并且Gpr91可能在肾脏中介导血浆肾素水平和血压升高,以响应外源性琥珀酸盐。Gpr91 mRNA在白色脂肪组织(WAT)中表达量最高。Gpr91部分是与Gi偶联的,并且已知Gi偶联的GPCR可以抑制脂肪组织中的脂肪分解,因而在肥胖中起重要作用。与其他G蛋白偶联受体(GPCRs)一样,SUCNR1以细胞特异性的方式通过多种途径传递信号。然而,我们对该受体的信号转导特性了解有限。白色脂肪细胞中的SUCNR1参与Gαi -cAMP信号转导,琥珀酸/SUCNR1轴的抗脂解作用可以很好地解释标准饮食条件下,全身SUCNR1敲除(KO)小鼠中观察到的中度瘦表型。当Sucnr1-KO小鼠处于致肥饮食情况下,主要表现为小鼠的能量消耗增加,体重变轻,WAT含量降低,葡萄糖耐受能力得到改善。能量稳态是由多种组织互相影响的,所以使用细胞特异性KO方法破译组织特异性基因功能是非常重要的。例如,作者先前使用骨髓细胞特异性敲除SUCNR1的小鼠,于2019年发表在Nature Immunology文章,发现SUCNR1可以调控巨噬细胞中的抗炎反应,进而调节肥胖,从而更好地理解琥珀酸/SUCNR1轴在肥胖患者巨噬细胞免疫应答中的关键作用。
本文中,作者通过构建脂肪细胞特异性缺乏SUCNR1的小鼠,研究了琥珀酸/Sunr1轴对脂肪组织的生理学作用。通过分析这些小鼠在标准饮食条件下和饮食诱导肥胖后的代谢表型,结合体外实验和人体研究,证明了琥珀酸/SUCNR1轴是脂肪细胞中瘦素产生的新的调节因子。本研究提出了SUCNR1是能量稳态中的关键代谢传感器的新概念。

敲黑板啦!
1、脂肪组织通过分泌瘦素来调节能量稳态
2、琥珀酸通过其受体SUCNR1控制瘦素的表达
3、脂肪细胞特异性的Sucnr1缺失会根据营养状况影响代谢健康
4、SUCNR1的激活通过AMPK/JNK-C/EBPα依赖的方式通过生物钟控制瘦素的表达
5、琥珀酸/SUCNR1轴作为一个代谢物感应通路,介导营养相关的瘦素动力学,以控制全身稳态
研究结果
1. 、脂肪细胞条件敲除Sucnr1减少脂肪量,改善全身代谢
作者选择性敲除了小鼠脂肪细胞中的Sucnr1 基因,将Sucnr1等位基因外显子侧翼携带两个loxP位点的flox小鼠,与脂肪细胞特异性Adipoq启动子驱动表达Cre重组酶的转基因小鼠杂交,产生了Sucnr1fl/fl Adipoq-Cre+/-小鼠(以下简称Ad-Sucnr1 KO小鼠)。Cre阴性的Sucnr1fl/fl小鼠(Sucnr1fl/fl Adipoq-Cre- /-)作为对照(称为Sucnr1fl/fl小鼠)(图S1A和S1B)。Ad-Sucnr1 KO小鼠以正常孟德尔比例出生且存活,基因型间无明显形态学差异。结果如预期所示,与Sucnr1fl/fl小鼠相比,在所有Ad-Sucnr1 KO小鼠的脂肪库中,Sucnr1的表达可以忽略不计,而在肝脏和脾脏等其他组织中并未观察到明显变化(图S1C)。Sucnr1fl/fl小鼠在棕色脂肪组织(BAT)中的表达低于WAT(图S1D)。
在正常饮食(NCD)下,8周龄的Ad-Sucnr1 KO小鼠的体重高于同周龄的Sucnr1fl/fl小鼠,但这些差异在30周龄时消失了(图1A和1B),这表明Ad-Sucnr1 KO小鼠表现出对年龄相关的体重增加的抵抗力。12周龄时的间接量热分析显示,各基因型小鼠的能量消耗(EE)相似(图S2A);然而,Ad-Sucnr1 KO小鼠在黑暗期(活动期)的食物摄入量显著增加,且与体重无关(图1C右侧散点图是以体重为协变量的食物摄入量的回归图,即在体重相同时,比较小鼠的食物摄入量(P值指的是食物摄入量),所以与体重无关。)(图1C),呼吸交换率(RER)也显著增加(图1 D)。此外,各基因型小鼠在运动能力方面未观察到差异(数据未显示),且在20周龄时也得到了类似的结果(图S2B-S2D)。12周龄时定量磁共振成像(qMRI)体成分分析显示,Ad-Sucnr1 KO小鼠皮下WAT (scWAT)和内脏WAT (vWAT)脂肪总量明显低于Sucnr1fl/fl小鼠(图1E),而肌肉质量相似(图S2E)。Ad-Sucnr1 KO小鼠的脂肪量在29周龄时也很明显低于其他小鼠(图S2F)。与之相符的是,脂肪组化分析显示Ad-Sucnr1 KO小鼠腹股沟WAT (iWAT)和附睾WAT (eWAT)的脂肪细胞面积显著变小(图1F)。在其他代谢组织中,小鼠基因型之间没有明显的组织学差异(图S2G)。与脂肪组织表型一致,Ad-Sucnr1 KO小鼠的葡萄糖耐量(图1G)和胰岛素敏感性(图1H)明显优于Sucnr1fl/fl小鼠。
虽然Ad-Sucnr1 KO小鼠的低脂肪量可以利用SUCNR1的抗脂解功能来解释(图S2H),但使用Atglistatin(ATGLi,一种脂肪甘油三酯脂肪酶的特异性抑制剂) 处理Ad-Sucnr1 KO小鼠,在体内长期抑制脂肪分解后,其体重并未按预期显著增加(Ad-Sucnr1 KO-control = 9.07%±4.98% vs. Ad-Sucnr1 KO-ATGLi = 5.22%±3.08%)。Ad-Sucnr1 KO小鼠的脂肪细胞大小(仅在iWAT中检测到少量增加,图S2I)和葡萄糖耐量(图S2J)均未发生实质性变化。这与此前的研究结果一致:在稳态条件下,由GPCR介导的脂解一般在全身Sucnr1 KO小鼠中不受干扰,这表明可能存在替代机制来解释Ad-Sucnr1 KO小鼠的代谢有利表型。
Ad-Sucnr1 KO小鼠的脂肪量降低与WAT中解偶联蛋白1 (UCP1,BAT激活标志) 的表达显著增加相关(图1I),但UCP1在BAT中并未出现显著增加(图S2K)。此前有报道称,脂肪细胞前体向白色脂肪细胞的分化能力不受整体Sucnr1缺失的影响。而作者发现Ad-Sucnr1 KO小鼠脂肪来源的干细胞比对照小鼠具有更强的棕色脂肪细胞分化能力,棕色化相关基因的更高表达 (图1J和1K),并且脂肪细胞前体中Sucnr1表达没有变化,说明与Sucnr1表达无关 (图1L)。在Suncr1敲除小鼠的体外WAT组织外植体培养中,WAT褐变的诱导与琥珀酸盐的积累相关 (图1M),此前也有报道称琥珀酸盐是一种产热和褐变剂。上述结果表明,脂肪细胞中Sucnr1条件敲除可以减少肥胖(但不影响体重),并通过一种可能依赖于WAT褐变的机制改善葡萄糖稳态。
图1. 脂肪细胞Sucnr1条件敲除后脂肪量减少,全身代谢改善
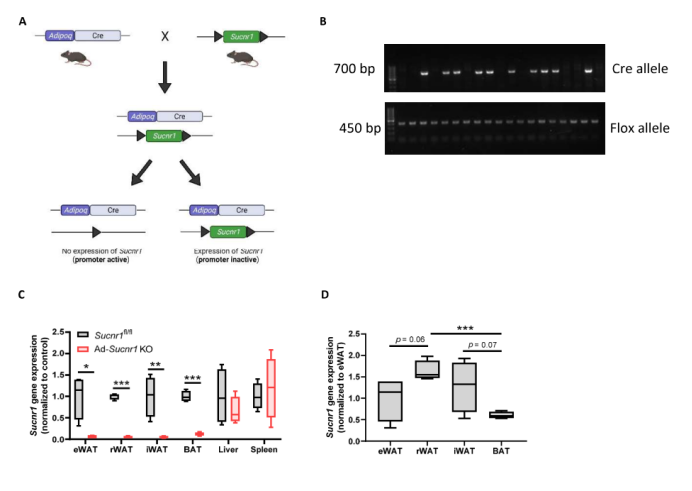
附图1. 脂肪细胞Sucnr1条件敲除小鼠的产生
拓展阅读
全身Sucnr1 KO小鼠的代谢变化
在WT和全身Sucnr1 KO小鼠中,eWAT外植体组织的甘油释放(脂解指标)在基础和β-肾上腺素能激动剂(异丙肾上腺素)的刺激下,结果是类似的。随后添加琥珀酸盐(100 μmol/L)可以抑制异丙肾上腺素刺激的WT小鼠WAT外植体中的甘油释放,但在Sucnr1 KO小鼠中没有变化。此外,腹腔注射琥珀酸盐(1.2 g/kg)可引起WT小鼠血清游离脂肪酸(NEFA)水平显著下降,而Sucnr1 KO小鼠的下降不显著。腹腔注射腺苷A1受体激动剂PIA可以抑制WT和Sucnr1 KO小鼠的脂解,这表明Sucnr1 KO小鼠没有受到GPCR介导的抗脂解的干扰。
对WT和Sucnr1 KO小鼠的体重进行评估。断奶时的总体重没有差异(雄性WT为13.1±1.1 g,雄性KO为13.2±0.6 g;n = 8),10周饮食后可以明显看出Sucnr1 KO小鼠体重增加有减少的趋势,但两种基因型还没有显示出差异。到50周时,两种基因型小鼠体重表现出了显著的差异(WT为41.6±1.5 g,而Sucnr1 KO小鼠为35.5±1.9 g; P <0.05)。喂食18-20周后,处死小鼠,检测器官重量。发现两种基因型小鼠的心脏、脾脏、肝脏和BAT的重量没有差异。但在WAT中发现了显著的差异。与WT小鼠相比,Sucnr1 KO小鼠的腹膜后、皮下和附睾脂肪量显著减少。此外,与总体重相比,Sucnr1 KO动物的累积脂肪含量显著降低。
苏木精和伊红染色的WAT的组织学分析表明,相对于WT小鼠,Sucnr1 KO小鼠脂肪细胞尺寸明显减小。对脂肪细胞分化相关的基因的表达进行检测,发现尽管在Sucnr1 KO小鼠的WAT中,脂肪生成转录因子、Pparγ、Cebpα以及Fabp4的表达水平有降低的趋势,但这种差异并不显著。对解偶联蛋白(uncoupling protein, UCPs)表达进行分析,发现骨骼肌和肝脏中UCP2和UCP3的水平相当。Sucnr1 KO小鼠BAT组织中UCP1表达有降低的趋势,同时WAT组织中UCP1和UCP2表达水平升高,但均没有显著性差异。
琥珀酸与脂质代谢
琥珀酸作为TCA循环的代谢中间体,在近来的脂质代谢研究中颇为重要,主要在产热、促进白色脂肪棕色化以及抑制脂质分解方面发挥了重要作用。
以往研究表明,寒冷条件下,琥珀酸浓度显著高于其他TCA循环的中间代谢物,部分琥珀酸会进入血液循环体系,在BAT中优先累积。琥珀酸通过琥珀酸脱氢酶介导其氧化产生活性氧(ROS),然后通过解偶联蛋白UCP1依赖性的抑制小鼠肥胖。在白色脂肪细胞(WAT)中,线粒体二羧酸盐载体(mDIC)特异性表达,主要负责将琥珀酸从线粒体基质转运到细胞膜,使其被琥珀酸受体SUCNR1识别;并通过抑制cAMP-磷酸化激素敏感脂肪酶(pHSL)途径抑制脂肪分解。此外,琥珀酸被转运至线粒体后经琥珀酸脱氢酶氧化使线粒体ROS水平升高,然后通过诱导Cys253亚砜化增强UCP1活性,促进WAT的褐变。
在本文中作者发现Suncr1敲除小鼠的体外WAT组织外植体培养中,其WAT发生了褐变,在一定程度上验证了琥珀酸盐并非通过Suncr1使其发生褐变。
[3]An, Yu A et al. Journal of hepatology vol. 75,2. 2021.
2. 脂肪细胞Sucnr1条件敲除小鼠在高脂饮食条件下出现肝脏脂肪变性和葡萄糖不耐受
以往有研究表明,由饮食诱导的肥胖会促进小鼠和人类的脂肪组织内成熟脂肪细胞SUCNR1表达上调。为了研究营养过剩情况下脂肪细胞 Sucnr1 的作用,作者使用高脂饮食 (HFD) 喂养小鼠 12 周。与 NCD 的结果相反,此期间两种基因型的体重增加率相似(图2A和2B)。脂肪质量分析显示,与 NCD呈现的表型相反,Ad-Sucnr1 KO 小鼠比 Sucnr1fl/fl 小鼠的脂肪质量更大(图2C)。能量参数比较分析显示 EE 相似 (图2D),但 Ad-Sucnr1 KO 小鼠在光照阶段的食物摄入量和 RER 都较低(图2E 和2F)。在脂肪组织形态没有明显改变的情况下(图2I),代谢燃料偏好转向脂肪,与明显的葡萄糖不耐受(图2G)和胰岛素抵抗(图2H)一致。此外,HFD诱导的肝脂肪变性在AD-Suncr1 KO 小鼠中更为严重(图2I)。这可能解释了为什么尽管已知 Sucnr1 对脂肪分解有负调控作用,但在不同基因型之间的血浆甘油三酯和非酯化脂肪酸没有检测到差异(图2J)。事实上,使用 ATGLi 抑制脂肪分解 2 周改善了Ad-Sucnr1 KO 小鼠中 HFD 引起的肝脏脂肪变性(图2K),同时提高了葡萄糖耐量(图2L)。总之,这些数据表明,在营养过剩情况下, 脂肪细胞Sucnr1条件敲除的小鼠不仅在肝脏中有非正常的脂肪沉积,还存在葡萄糖稳态紊乱。Ad-Sucnr1 KO 小鼠在营养性挑战的相反代谢表型似乎主要依赖于 SUCNR1 的抗脂肪分解作用。
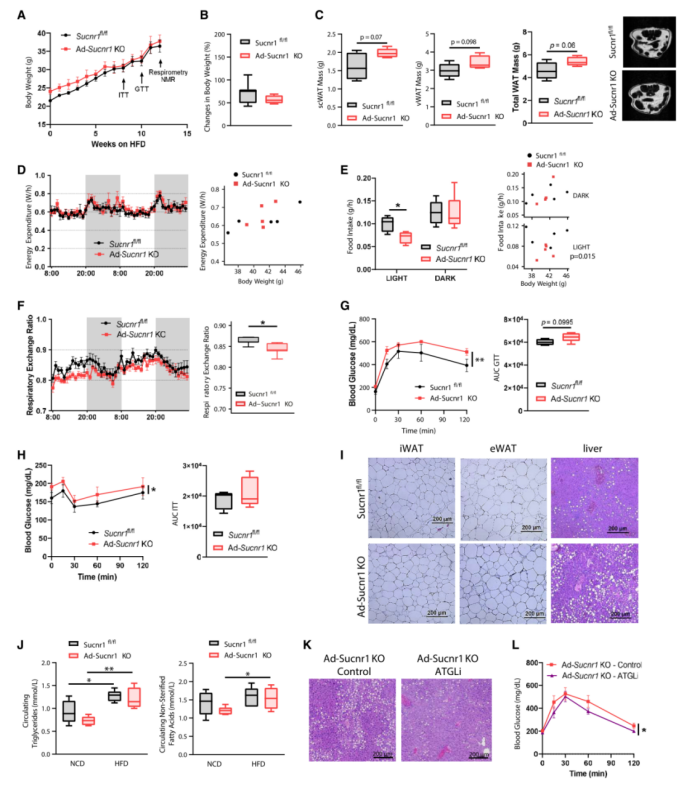
图2. 脂肪细胞特异性Sucnr1敲除小鼠在高脂饮食条件下出现肝脏脂肪变性和葡萄糖不耐受
3. 脂肪细胞Sucnr1条件敲除小鼠出现骨量表型
为了更好地了解年轻Ad-Sucnr1 KO小鼠尽管脂肪量较低(骨骼肌质量相似)但体重增加的现象,作者评估了脂肪细胞中Sucnr1敲除是否会间接影响骨骼质量。在小鼠的总体重中,其骨骼质量占约5%。胫骨的微型计算机断层扫描分析显示,脂肪细胞Sucnr1的敲除改变了皮质骨质量。Ad-Sucnr1 KO小鼠的皮质骨体积显著大于Sucnr1fl / fl小鼠,同时皮质骨中部周围的皮质厚度和骨周长也显著增加(图3A)。相同小鼠的骨小梁结构未发生变化(图3B),但是Ad-Sucnr1 KO小鼠的胫骨长度明显较长(图3C)。不同基因型单位骨表面的破骨细胞(Ocls)数量相当(图3D)。但胫骨切片的苏木精-伊红(H&E)染色显示,Ad-Sucnr1 KO小鼠皮质骨中单位骨面积的骨细胞(Ocys)数量以及皮质骨和骨小梁表面的成骨细胞(OBs)数量都显著更高(图3E)。与脂肪细胞相似,OBs起源于间充质干细胞(MSCs)。骨髓MSCs的OB分化潜力的分析未显示出基因型之间的显著差异(图S3A)。在HFD小鼠中,骨骼表型的变化不明显(图S3B和S3C),并且骨体积、皮质厚度、骨小梁数量和Ocys数量都未显著增加。总之,这些发现指出脂肪细胞Sucnr1条件敲除可能间接影响后天生长和骨发育,解释了基因型之间初始体重的差异。
图3.脂肪细胞特异性Sucnr1敲除小鼠出现骨量表型
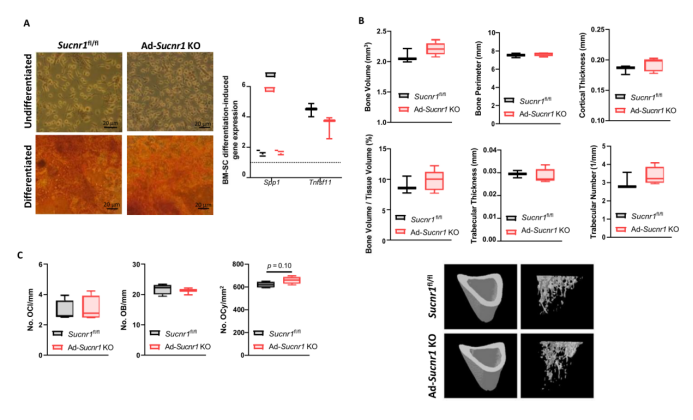
附图3.高脂饮食条件下脂肪细胞Sucnr1敲除小鼠的骨量表型
拓展阅读
骨重建过程
骨骼系统骨细胞(Ocys) 拥有不同的细胞类型,包括了成骨细胞(OBs)、破骨细胞(Ocls)、骨质细胞和骨髓基质细胞。其中,成骨细胞和破骨细胞之间存在复杂的相互作用。
破骨细胞是一种多核巨噬细胞,主要功能是吞噬和降解骨组织。成骨细胞是一种单核细胞,主要功能是合成和沉积骨基质,其中最重要的成分是胶原蛋白。胶原蛋白是一种结构蛋白,可以形成纤维状结构,提供骨组织的韧性和强度。成骨细胞也可以产生一些生长因子和细胞因子,这些因子会影响破骨细胞和其他细胞的活动。
破骨细胞和成骨细胞的相互作用与骨重建相关。当骨组织受到损伤时,破骨细胞会被激活并移动到骨表面。破骨细胞表面的细胞膜能形成一个密封区,称为吸附区。吸附区隔离了破骨细胞与周围环境,使得破骨细胞能够分泌酸和酶来溶解骨基质中的无机盐和有机物质,释放出骨基质中嵌入的生长因子和细胞因子。这些因子又可以吸引成骨细胞移动到骨表面,并开始骨重建。在骨重建过程中,成骨细胞会合成和沉积骨基质以填充破骨细胞形成的坑洞,修复骨组织的损伤。
骨重建过程处于动态平衡,需要破骨细胞和成骨细胞之间的精细调节,对于骨骼系统的正常生长和修复具有重要作用。文章中,作者利用观察破骨细胞和成骨细胞数量来了解小鼠的骨生长情况。
间充质干细胞MSCs具有多向分化的潜能,在特定的诱导条件下,它不仅能分化为中胚层细胞(骨、软骨、脂肪、肌腱等),而且能够向内胚层组织细胞(如心肌细胞、干细胞)和外胚层组织细胞(如神经细胞)分化。MSC成脂分化有两个阶段,首先是MSC分化为脂肪前体细胞,接着在特定的细胞刺激影响下(如C/EBPs和PPAR-γ)最终分化为脂肪细胞,出现脂肪细胞中显著的标志物-脂滴。MSC成骨分化经历骨原细胞(osteoprogenitor cells)、成骨前体细胞(pre-osteoblasts)、成熟的骨细胞(osteoblasts)和终末阶段的骨细胞(osteocytes),其中涉及到多种类型的细胞间和细胞内的信号传递,如信号通路、转录因子、生长因子、micro-RNA等,形成了一个完整的骨代谢调控负反馈环路。目前已知肥胖、骨质疏松症及骨质减少会影响脂肪-成骨分化平衡,从而使MSCs的分化潜力受到影响。大量的转录因子和胞外细胞或基质内信号通路调节着成脂和成骨分化。但一般规律是若某一调节因子主要促进脂质代谢,那么它会通过某一信号通路调节抑制MSC的成骨分化,最终影响脂肪-成骨分化平衡。因此,本文中可能是小鼠代谢情况影响到某调节脂质合成的转录因子,最终抑制了MSCs的成脂分化,促进了MSCs的成骨分化。
参考文献:
4. 脂肪细胞Sucnr1条件敲除的小鼠瘦素表达紊乱
NCD Sucnr全身敲除的小鼠禁食时某些脂肪因子的水平较低,这表明SUCNR1可能在脂肪细胞中发挥内分泌作用。鉴于Ad-Sucnr1 KO小鼠在食物摄入、脂肪和骨量方面的代谢表型,文章研究了瘦素作为这些生物过程的主要调节因子所发挥的功能(小编注:瘦素可以增加密质骨的含量,减少海绵骨含量,总体增加骨骼密度,此机制可能是透过交感神经传入骨骼组织的纤维,或是经由神经内分泌系统达成。)。值得注意的是,与野生型(WT)小鼠相比,全身Sucnr1 KO小鼠中的循环瘦素对再喂养的反应明显较弱(图4A)。这在Ad-Sucnr1 KO小鼠中也很明显(图4B)。此外,Sucnr1敲除影响小鼠出生后生理性瘦素激增 (10天瘦素= 16.12±2.35 ng/mL vs 21天瘦素= 2.83±0.57 ng/mL)(小编注:不管是WT小鼠还是sucnr1fl /fl或者KO小鼠,刚出生10天时瘦素都会激增,在出生21天时瘦素会下降。但是与WT鼠相比,Sucnr1 KO小鼠在出生10天时瘦素水平是降低的,说明Sucnr1 KO会影响瘦素的表达 ),和Ad-Sucnr1 KO小鼠一样,sucnr1fl /fl小鼠在随后10天表现出瘦素水平下降的趋势(图4C)。与此一致的是,成年Ad-Sucnr1 KO小鼠的WAT中Lep基因表达(图4D)和血清瘦素水平(图4E)显著低于Sucnr1fl /fl小鼠,这可能解释了NCD条件下Ad-Sucnr1 KO小鼠摄食量增加的作用(图1C)。此外,Ad-Sucnr1-KO小鼠在禁食-进食的过渡期间,表现出食欲相关神经肽的自然调节紊乱,特别是食欲信号(Npy和Agrp)相关的神经肽(图4F)。与此一致,在Ad-Sucnr1 KO小鼠的下丘脑中,进食诱导的信号转导和转录激活子3(STAT3)磷酸化减少(图4G和S4A),这与瘦素敏感性的变化无关(图4H和4I)。(小编注:JAK-STAT 信号通路是一种具有代表性的信号通路,瘦素通过该通路可以在下丘脑中调节食物摄入和能量平衡。瘦素与其受体 LepRb 结合后,通过对酪氨酸激酶(tyrosine kinase Janus kinase,JAK)与转录因子信号调节器和转录激活剂(transcription factor signal transducer and activators of transcription,STAT)有序的磷酸化从而启动下游信号。STAT磷酸化后形成二聚体并转入细胞核内,在细胞核中结合DNA,调节与食物摄入和能量平衡的相关基因的转录。STAT 是由细胞因子、生长因子和激素等多种因子激活的胞质蛋白,在哺乳动物中其家族有 7 个成员:STAT1-4、STAT5a、STAT5b 和 STAT6。目前研究表明,瘦素可以诱导STAT1、STAT3、STAT5 和 STAT6 磷酸化,但其中只有STAT3和STAT5的磷酸化能介导瘦素抑制食欲的作用)
循环中的瘦素水平与体脂量成正比。在HFD的Ad-Sucnr1 KO小鼠和对照小鼠之间,没有观察到瘦素水平的差异,尽管Ad-Sucnr1 KO的脂肪量有增加的趋势(图2C)。值得注意的是,喂食NCD或HFD的Sucnr1fl /fl小鼠的脂肪量和瘦素水平之间具有正相关性,而在Ad-Sucnr1-KO小鼠中并没有观察到此结果,这支持了作者将Sucnr1与瘦素联系起来进行观察。
作者接下来进一步证实,在标准饮食条件下发现的较低瘦素水平是Sucnr1缺乏的结果,而不是Ad-Sucnr1-KO小鼠较低脂肪量的间接影响。Ad-Sucnr1 KO WAT离体外植体的基础瘦素释放低于对照组(图4J)。而且,外源性琥珀酸盐增强了Sucnr1fl /fl脂肪细胞中Lep基因的表达,但不增强Ad-Sucnr1 KO小鼠脂肪细胞中的Lep基因表达(图4K)。
两种基因型的脂肪细胞之间典型的脂肪生成标记物(例如Pparg、Fasn和Slc2a4)的表达没有差异(图4L),表明Ad-Sucnr1-KO脂肪细胞的无反应是Sucnr1缺乏的结果,而不是分化缺陷所导致的。最后,给Sucnr1fl /fl小鼠口服琥珀酸盐,可引起血浆中瘦素水平的显著升高,但在Ad-Sucnr1-KO小鼠中没有观察到此结果(图4M),这证实了琥珀酸盐/Sucnr1轴在瘦素调节中的作用。
为了研究低瘦素水平是否与NCD下Ad-Sucnr1-KO小鼠的代谢有利表型有关,作者进行了为期4周的瘦素干预。结果发现,使用瘦素替代疗法增加了Ad-Sucnr1-KO小鼠的脂肪细胞大小(图4N)和糖耐量受损(图4O)。这表明,在NCD的Ad-Sucnr1 KO小鼠中观察到的低瘦素水平,以及WAT褐变的诱导(图1I),可能都与Ad-Sucnr1 KO小鼠肥胖程度的减轻有关。
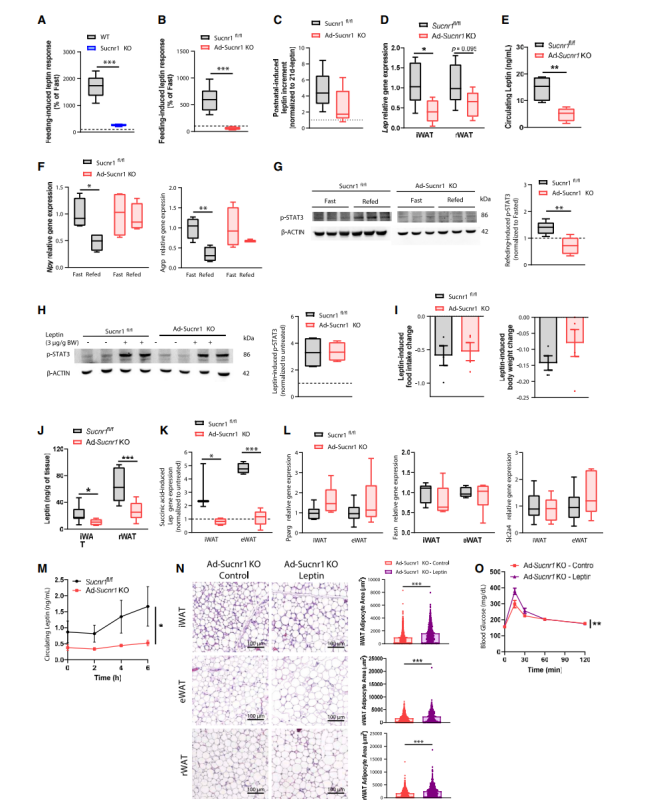
图4. Sucnr1条件性脂肪细胞缺失的小鼠瘦素表达紊乱
拓展阅读
瘦素的功能与调节
瘦素(leptin)是一类由小肠内的脂肪细胞及上皮细胞产生的蛋白质,在中枢神经系统中作用于下丘脑的弓状核来抑制食欲以此调节能量平衡,降低脂肪细胞的脂肪储存。在其他组织中,瘦素主要发挥拮抗胰岛素的作用,包含抑制其分泌、促进体细胞使用脂肪作为代谢原料等,同时也对于身体进入青春期、免疫启动,以及个体生长有关键作用。
由研究者对禁食、再喂养对血浆瘦素水平的影响进行探究,结果发现禁食受试者的瘦素水平在重新进食后12小时内恢复到基线水平。此外,受试者在禁食一夜后的再喂养饮食的脂肪含量对血浆瘦素水平没有影响,所以血浆瘦素水平主要反映总脂肪量,而不是膳食消耗或膳食能量来源。此外,昼夜节律也会影响瘦素的合成。正常饲喂条件下,啮齿动物瘦素水平会在夜间达到高峰,这可能与胰岛素的调节有关。然而随着年龄的增长,内脏脂肪的增加和胰岛素抵抗的出现,瘦素合成的昼夜节律会减弱。
5. 琥珀酸/SUCNR1信号通路以AMPK/JNK/C/EBPα依赖的方式控制瘦素的表达
为了探究琥珀酸/SUCNR1信号通路如何控制瘦素的表达,作者首先评估了SUCNR1激活对小鼠3T3-L1脂肪细胞中瘦素表达的影响。与Sucnr1fl/fl脂肪细胞中的研究结果相似(图4K),琥珀酸处理显著增加了3T3-L1脂肪细胞中Lep的表达(图5A),这种效应也可以用SUCNR1激动剂顺式-环氧琥珀酸(cESA)来模拟(图5B)。在人类脂肪细胞中也证实了这一点,发现细胞外琥珀酸促进瘦素释放(图5C),但是脂联素基因的表达并无明显的上调(图S5A)。SUCNR1在脂肪细胞中以剂量和时间依赖性的方式,参与诱导了c-JunN-末端激酶(JNK)和p38丝裂原活化蛋白激酶(MAPK)磷酸化(图5D)。
值得注意的是,作者还发现SUCNR1的激活触发了AMP活化蛋白激酶(AMPK)在Thr172位点的磷酸化/激活,这伴随着AKT及其下游靶糖原合酶激酶3(GSK-3)Ser473磷酸化的阻断。根据这个SUCNR1信号通路,作者使用5-氨基咪唑-4-羧基酰胺核糖核苷酸(AICAR)来激活AMPK,成功诱导了3T3-L1脂肪细胞中瘦素的表达(图5E)(图5A)。值得注意的是,在Ad-Sucnr1 KO小鼠的体外WAT外植体中,cESA诱导的AMPK激活被减弱(图5F和S4B)。用琥珀酸处理3T3-L1细胞增加了胰岛素敏感性(图5G),这与报道的AMPK对葡萄糖稳态的有益作用一致。作者接下来用特定的化学抑制剂阻断信号级联的方法明确SUCNR1调控瘦素的细胞内信号通路,发现抑制JNK(SP600125)和AMPK(化合物C [CC])完全阻断了琥珀酸诱导的Lep表达,而抑制p38 MAPK(SB202190)则没有此效果(图5H),脂联素表达则不受影响(图S5B)。此外,CC抑制AMPK阻断了cESA诱导的JNK磷酸化(图5I)。相比之下,SP600125抑制JNK对cESA介导的AMPK激活没有影响(图5I),这表明AMPK在信号级联中位于JNK的上游。用cESA处理3T3-L1细胞能诱导CCAAT增强子结合蛋白alpha(C/EBPa)磷酸化(参与瘦素基因表达),而该蛋白会被AMPK和JNK抑制剂阻断(图5I和5J)。总之,这些结果表明,琥珀酸/SUCNR1信号通路通过AMPK/JNK/C/EBPα轴控制瘦素基因的表达。
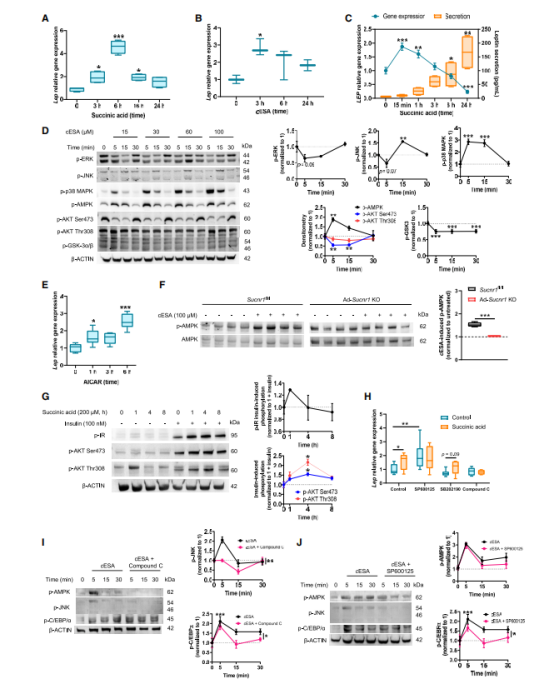
图5. 琥珀酸/SUCNR1信号以依赖于AMPK/JNK/C/ EPBα的方式控制瘦素表达
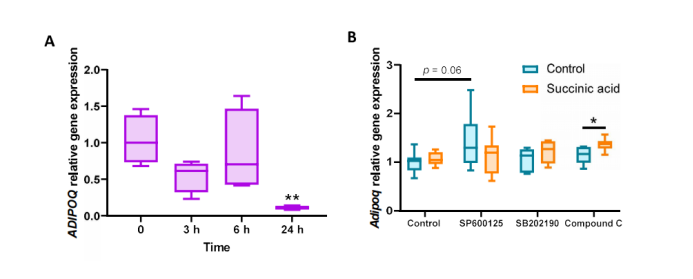
附图5. 琥珀酸-SUCNR1信号通路并不控制脂联素的表达
6. SUCNR1的激活调节脂肪组织中的外周时钟
作者接下来分析了Ad-Sucnr1 KO和对照组小鼠中eWAT的转录组。基因集合富集分析表明,Sucnr1缺失导致的最显著的变化是昼夜节律(图6A)。差异基因表达分析显示,在Ad-Sucnr1 KO和对照小鼠eWAT中差异表达的103个基因中(65个上调,38个下调;差异倍数>1.25,校正p 值< 0.05;表S1),11个是昼夜节律的关键调控因子。这些基因中有10个在Ad-Sucnr1 KO小鼠中显著上调,而编码大脑和肌肉芳基烃受体核转位器样蛋白1(Bmal1)的核心昼夜节律基因显著下调(图6B和6C)。
考虑到瘦素的分泌受脂肪细胞昼夜时钟的控制,我们使用3T3-L1脂肪细胞评估了SUCNR1激活对核心时钟基因表达的影响(图6D)。琥珀酸暴露显著增加了正生物钟基因Bmal1,下调了负时钟基因(周期[Per] 1、Per2和Per3)和维甲酸受体相关的孤受体(Rora)。在瞬时转染BMAL-LUC报告基因的过表达SUCNR1的人胚胎肾(HEK)293细胞中,荧光素酶(LUC)报告基因分析证实,激活的SUCNR1增强了BMAL1启动子的转录(图6E)。与瘦素类似,AMPK的激活也能诱导Bmal1的表达(图6F)。与AMPK(和JNK)对Lep表达的影响相比较(图5H),它们的药理抑制阻断了琥珀酸对时钟基因表达的调控(图6G)。作者在蛋白水平上证实了SUCNR1激活诱导的BMAL1上调依赖于AMPK和JNK的激活(图6H)。SUCNR1的激活还促进生成核BMAL1(成熟形式和Ser42磷酸化形式),进而影响BMAL1的转录活性(图6I)。值得注意的是,在杂合Bmal1缺失小鼠中,离体WAT外植体的琥珀酸对Lep表达的上调被阻断(图6J),这种影响与Sucnr1表达的变化(图6K)或琥珀酸诱导的AMPK激活的差异无关(图6L和S4C)。相比之下,Bmal1缺陷的WAT外植体对琥珀酸诱导的C/EBPα磷酸化反应减弱,这与之前的研究结果一致,表明BMAL1/ CLOCK会刺激C/EBPα介导的瘦素转录。总的来说,以上数据表明,琥珀酸/SUCNR1轴是脂肪组织中影响瘦素表达的生物钟的关键调控器。
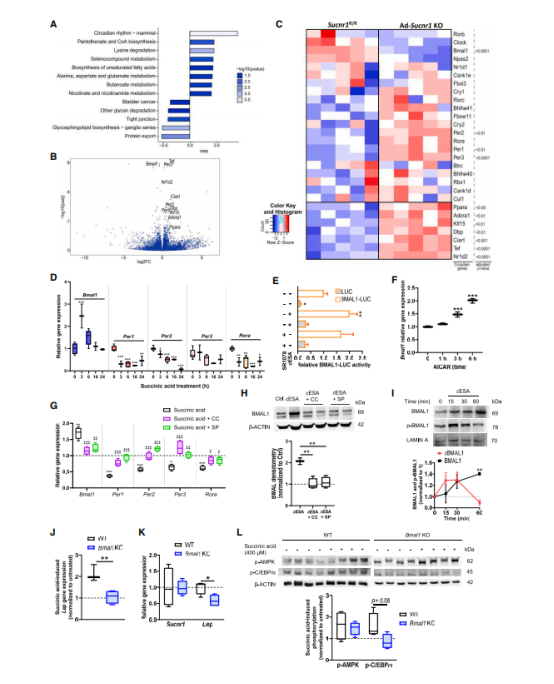
图6. SUCNR1激活调节脂肪组织的外周时钟
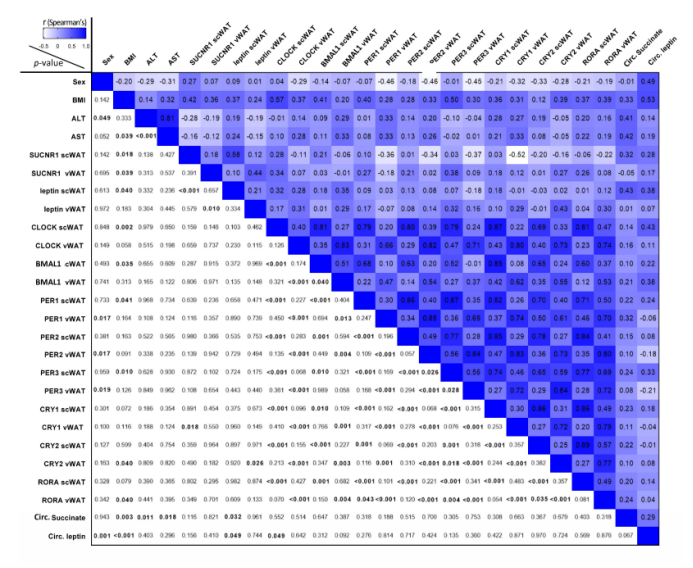
附图6. 人类队列临床、生化和基因表达变量之间的Spearman相关矩阵
7. 在肥胖患者中,琥珀酸/SUCNR1信号通路的瘦素调控受到干扰
肥胖的一个自相矛盾的特征是高瘦素血症,这足以促进对其厌食性作用的抵抗。作者之前证明,在肥胖人群的脂肪细胞中,循环的琥珀酸和SUCNR1会升高。与此相一致的是,与瘦的受试者相比,肥胖受试者的脂肪细胞前体分化出的成熟脂肪细胞在SUCNR1激活时会释放更多的瘦素(图7A)。为了探讨肥胖人群中瘦素和琥珀酸/SUCNR1轴之间的联系,作者测量了56名根据体重指数(BMI)分类的受试者队列中瘦素和琥珀酸的循环水平(临床和实验室数据汇总见表S2)。正如预期的那样,肥胖受试者的循环琥珀酸盐和瘦素水平显著较高(表S2),并在双变量分析中与BMI呈正相关(图S6)。在测量同一受试者的scWAT和vWAT库中LEP和SUCNR1的表达时发现,与肥胖相关的高瘦素血症一致,肥胖受试者的scWAT中LEP的表达显著升高,其中SUCNR1的表达升高且接近显著(p=0.053)(图7B)。在内vWAT中还观察到LEP和SUCNR1表达增加的趋势(图7C),这与之前的研究一致。循环瘦素与scWAT中LEP的表达呈正相关(图7D),而LEP又与循环琥珀酸相关(图7D)。双因素分析也显示,在scWAT和vWAT中,LEP的表达与SUCNR1的表达相关(图7D)。肥胖与几个核心时钟基因表达的整体增加有关,这在vWAT中尤其明显(图7E)。scWAT中只有CLOCK表达与循环瘦素呈正相关(图7F)。
接下来,作者构建了多元回归分析模型,包括每个因变量的显著双变量相关性(图S6),并对年龄和性别进行调整。最佳模型显示,循环瘦素的主要预测因素是scWAT中LEP的表达(b = 2.261, beta = 0.286, p < 0.05)、性别(b = 17.841, beta = 0.584, p < 0.001)和BMI(b = 0.831, beta = 0.359, p < 0.05)(表S3)。值得注意的是,在scWAT (b = 0.434, beta = 0.450, p < 0.01)和vWAT (b = 0.277, beta = 0.470, p < 0.01)中,SUCNR1的表达是与LEP表达相关的独立因素(表S5)。这些数据表明,肥胖相关的高瘦素血症与脂肪组织中琥珀酸循环水平升高和SUCNR1表达升高有关,这支持了肥胖环境下该回路的过度激活。
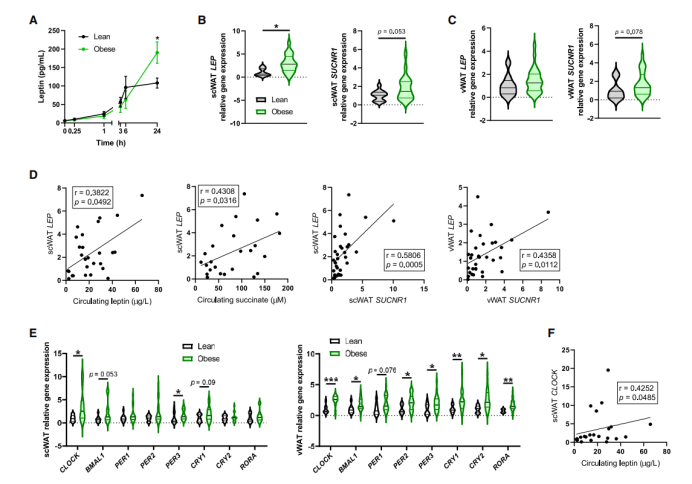
图7. 肥胖中琥珀酸/SUCNR1信号对瘦素的调节受到干扰
总结
脂肪组织通过分泌瘦素调节能量稳态,但对控制瘦素产生的因素知之甚少。琥珀酸盐长期以来被认为是免疫反应和抵抗脂肪分解的中介,我们发现琥珀酸盐能通过其受体SUCNR1控制瘦素的表达。脂肪细胞特异性缺失Sucnr1根据营养状况影响代谢健康。脂肪细胞缺乏Sucnr1会损害瘦素对进食的反应,而在禁食到进食的过渡过程中,口服琥珀酸盐不仅能调节脂肪组织中的脂肪分解,还可通过SUCNR1来影响瘦素的生理作用。尽管SUCNR1的抗脂质分解作用在肥胖中普遍存在,但在标准饮食条件下,它作为瘦素信号调节器,能通过生物钟以依赖AMPK/JNK-C/ EBPα的方式控制瘦素表达,有助于脂肪细胞特异性SUCNR1敲除小鼠表现出中度瘦的代谢有利表型。人类肥胖相关的高瘦素血症与脂肪细胞中的SUCNR1过表达有关,这是脂肪组织瘦素表达的主要预测因素。该研究建立了琥珀酸/SUCNR1轴作为代谢产物传感途径介导与营养相关的瘦素动力学,以控制全身稳态。
原文链接:https://doi.org/10.1016/j.cmet.2023.03.004
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1402029.html
上一篇:代谢学人--Cell Metabolism:看线粒体如何“嵴”速享“瘦”
下一篇:代谢学人--Nature Metabolism:胰岛素敏感性:谁动了我的BCAA?