博文
Nature Metabolism:向左走向右走——脂肪分化风向标Wnt
||
代谢学人
Nature Metabolism:向左走向右走——脂肪分化风向标Wnt
撰文| 马莹 张俊 闪光余 仲银召 郭明伟 编辑| 孟美瑶 校对| 张俊

背景介绍
成体组织含有特异性的细胞亚群,这些细胞确定了器官和组织的特异性功能。当这些特化细胞受损或死亡时,其更新对于组织和器官在整个生命周期中的持续功能十分重要,而该过程取决于组织中的多能间充质祖细胞。上皮组织中(如皮肤、肠道和血液)的祖细胞特性已经被很好地表征了,但是参与骨、软骨、肌肉和脂肪组织的发育的间充质祖细胞是如何维持的仍然是未知的。在严重肥胖时,成熟的脂肪组织具有大规模扩张的能力,并且超过体重的50%由脂肪组织组成。因此,在这种巨大分化压力的情况下,如何维持多能间充质祖细胞的数量和分化能力是个悬而未决的问题。
Wnt信号通路是一条在进化上十分保守的信号通路,主要参与细胞增殖、分化、凋亡、迁移和组织稳态等多种生理过程。Wnt信号通路分为经典Wnt/β-catenin通路和非经典信号通路,而后者包括平面细胞极化(Planar cell polarity,PCP)信号通路和Wnt/Ca2+信号通路等。Wnt蛋白为该信号通路的配体蛋白,可激活下游信号。哺乳动物中的Wnt蛋白可分为两类——Wnt1类和Wnt5a类,其中,Wnt1主要与经典通路有关,Wnt5a主要与非经典通路有关。在经典的Wnt/β-catenin信号通路中,当缺乏配体蛋白时,轴蛋白(Axin)、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、结直肠腺瘤性息肉蛋白(Adenomatous polyposis coli,APC)和酪蛋白激酶1α(CK1α)组成降解复合物,首先磷酸化β-catenin,使其被E3泛素连接酶的组成蛋白β-转导蛋白重复序列蛋白(β-transducin repeat-containing protein,βTRCP)识别,进而导致β-catenin泛素化降解,于是下游的T细胞因子/淋巴细胞增强因子(T cell factor/lymphoid enhancer factor,TCF/LEF)无法起始下游靶基因的转录。然而,当Wnt配体与细胞表面的卷曲蛋白(Frizzled,Frz)和低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP)5/6(小编注:低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)家族存在于细胞膜表面,是一组进化上保守的单跨膜糖蛋白。它可结合并内化循环中的低密度脂蛋白,是维持哺乳动物体内脂代谢稳态的关键受体。该家族包括LDLR、VLDR、LRP1、LRP1B、Megalin /LRP2等10种LDL受体。其中,LDLR介导载脂蛋白的内吞作用必须依赖对ApoE和ApoB-100的高亲和力,而LRP蛋白则可识别广泛的配体,因此,它不仅可作为转运受体,完成胆固醇的转运,还可以作为信号通路受体,激活下游信号转导,如Wnt信号通路)结合形成三聚体时,募集的支架蛋白Dvl磷酸化LRP5/6,导致Axin被募集到细胞膜上,进而破坏降解复合物,促使β-catenin在胞质的积累和稳定。未磷酸化的β-catenin易位到细胞核,与TCF/LEF形成复合物,进而起始下游靶基因的转录,如c-myc、Cyclin D1等。此外,在非经典的Wnt信号通路中,Wnt/Ca2+信号通路是Wnt结合受体后将信号传递给第二信使IP3,进而使胞质中游离Ca2+浓度升高,最终调节细胞迁移和增殖。而在Wnt/PCP信号通路中,Wnt配体-Frz-LRP5/6三聚体活化Dvl进而激活小三磷酸鸟苷酸酶Rho A和Rac及下游的相关激酶,此通路在胚胎发育阶段可调控细胞骨架的重排,参与原肠胚形成。
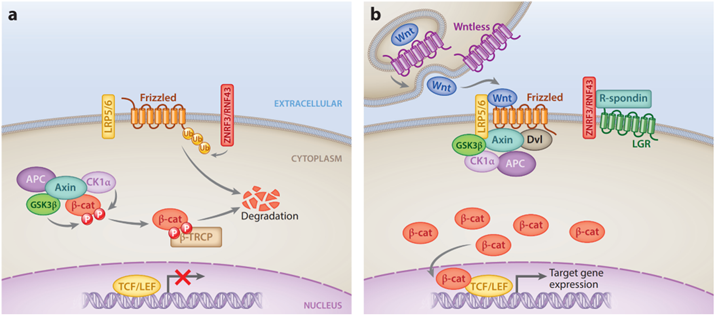
脂肪细胞分化机制的深入研究主要是在小鼠模型中探究的。小鼠脂肪细胞形成的两个阶段已被确定。第一阶段为定型过程,在该过程中,多潜能间充质祖细胞形成了前体脂肪细胞,失去了分化为其他细胞类型的能力;第二阶段为终末分化,在该过程中,保守的前体脂肪细胞表达脂质转运和合成相关基因,形成特定脂滴,并分泌脂肪细胞特异性细胞因子(如脂联素)。与终末分化机制相关的因子有CCAAT/增强子结合蛋白(CCAAT/enhancer binding protein,C/EBP)、过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor,PPAR)家族成员以及脂肪细胞决定和分化因子-1/甾醇反应原件结合蛋白1c(Adipocyte determination and differentiation factor-1/sterol response element binding protein 1c,ADD1/SREBP1c)。Wnt信号通路与前体脂肪细胞分化为成熟的脂肪细胞和软骨形成相关,Wnt10b的过表达通过典型的Wnt信号通路抑制PPAR-γ和C/EBP-α的基因表达,从而抑制前体脂肪细胞的终末分化,促进成骨分化。在本文中,研究人员用单细胞转录组技术确定了多能祖细胞两个发育轨迹,一种轨迹为分化为成熟脂肪细胞,另一种是形成一个重新获得增殖能力和分化能力的细胞亚群,这个细胞亚群以Wnt基因表达为特征,解释了人间充质组织如何维持和修复的机制。

敲黑板啦!
1. 三维培养细胞具有巨大优势;
2. Wnt信号通路决定细胞的分化轨迹;
3. 在分化条件下间充质祖细胞转变为功能性多能间充质祖细胞;
4. SWAT细胞发育与Wnt信号转导相关。
研究结果
1 成脂刺激后的急性转录组重塑
研究人员利用之前描述的方法(小编注:该方法是在患者接受了选择性胰腺切除手术6小时内,将患者身上的皮下组织碎片移除大血管和明显的结缔组织后,用EBM-2培养基(该培养基主要用于微血管内皮细胞的生长和扩增)清洗、裁剪后,包埋在基质胶中进行培养。由于可能需要排除外源生长因子对分离的祖细胞影响,作者选择的是低生长因子(GFR)的 Matrigel基质胶,该基质胶适用于对基质成分要求严格的实验,如细胞信号通路和细胞因子的研究等)在人的成熟脂肪组织中获得多潜能的祖细胞亚群,培养14天后,观察到毛细芽大量生长(图1a)。研究人员用消化酶和Ⅰ型胶原酶消化新芽,随后将它们接种到塑料培养皿中,细胞具有间充质祖细胞所特有的成纤维细胞表型(图1a)。
研究人员将用这种三维培养方式获得的细胞和用胶原酶消化组织获得的血管基质组分(SVF)中分离出的祖细胞进行了比较(图S1a,b),更大程度的侧向角散射表明,与3D培养扩增的细胞相比,SVF细胞具有更高的异质性(图S1c)。这两种方法获得的细胞都表达典型的间充质祖细胞细胞表面标志物THY1(CD90),ENG(CD105)和NT5E(CD73)(图S1d),而且这两个细胞亚群在成脂诱导后都表达脂联素(ADIPOQ)、脂肪细胞特异性的细胞因子脂滴包被蛋白(PLIN1)(小编注:Perilipin 1是一种脂滴相关蛋白,是PAT 蛋白家族成员之一,其特异性地表达于脂滴表面,并受多种转录因子的调控。PLIN1在调控脂肪细胞基础脂解和激素刺激脂解的过程中发挥着重要作用,此外,PLIN1 还参与机体能量代谢、炎症反应等生物学过程,与多种脂类疾病的发生和发展有重要联系),表明它们具有成脂的潜能(图S1e)。相比SVF中获取的细胞,三维培养系统的一个明显优势是每克脂肪组织的细胞产量,在第2次传代时超过100倍,再进一步传代时(>5)超过1000倍。接下来,作者将三维培养获得的间充质祖细胞通过脂肪、软骨和成骨分化培养基处理后,分别表现出成脂(脂质染色阳性)、成软骨(蛋白聚糖染色阳性)和成骨(钙离子染色阳性)分化特性,因此作者认为该祖细胞保留了分化多能性。多潜能分化能力也体现在它们的基因表达水平上,该细胞亚群在每种诱导混合物中选择性表达对应的相关基因,如表达成脂相关基因(ADIPQ和PLIN1)、软骨形成相关基因(聚蛋白多糖ACAN)和X型胶原α1链(COL10A1)或成骨形成相关基因(碱性磷酸脂酶ALPL)以及骨连接蛋白相关模块化钙结合蛋白2(SMOC2)(小编注:SMOC2是一种基质细胞外分泌蛋白,其具有调节成骨和血管形成的作用,与恶性肿瘤的发生发展存在一定关联)(图1c)。值得注意的是,并不是所有的细胞在成脂诱导下都分化,因为缺少脂滴的细胞可以与富含脂质的细胞一起被检测到(图1b)。
为了探究多能细胞向脂肪形成命运转变的时间线,研究人员用脂肪分化培养基对两个供体的细胞处理0、3、7、14天,并能成功分化(图1e),随后进行RNA-seq分析(图1d)。主成分分析(PCA)(小编注:寻找主成分的过程,且通常被认为是一种特殊的非监督学习算法,可以对复杂或多变的变量进行降维处理分析。简单而言,图中的点距离越近代表相关性越大,反之距离越远代表相关性约小。因此作者认为分化的Day0到Day3的基因表达变化最显著)揭示了最大的变化发生在分化0和3天之间,同时两个供体的差异很小,都显示相同趋势(图1f)。在分化0和3天之间差异表达的基因数量(3268个基因)高于分化3和7天之间(1908个基因)以及7天和14天之间(413个基因)差异表达的基因数量(图1g),表明主要的转录组事件发生在脂滴积累之前。ADIPOQ在分化3天之后表达下降(图1h),表明在诱导分化后,成脂命运的定型发生在0和3天之间。此外,这些细胞表达经典脂肪因子瘦素(LEP),表明分化的脂肪细胞形成过程超过3天(图1h)。然而值得注意的是,在分化过程中,间充质祖细胞表面标志物THY1和ENG表达增加,NT5Ez则没有明显的上升趋势(图1i)。
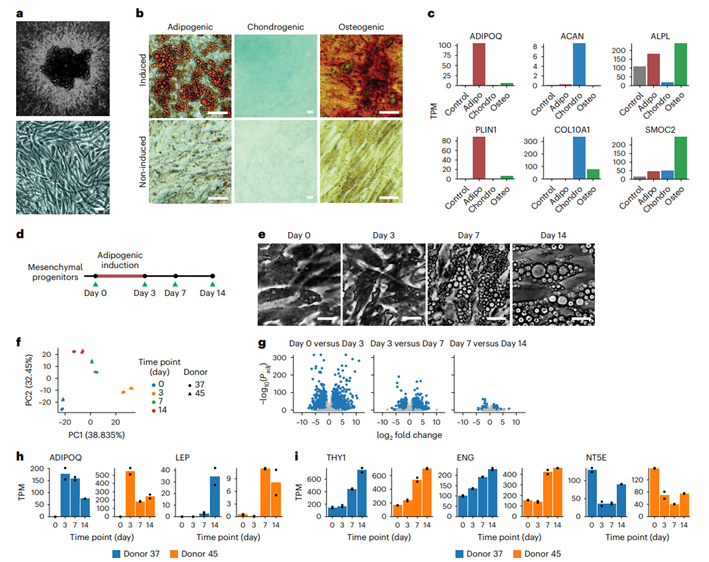
图1 人脂肪组织多能间充质祖细胞在成脂分化过程中的动态转录组变化
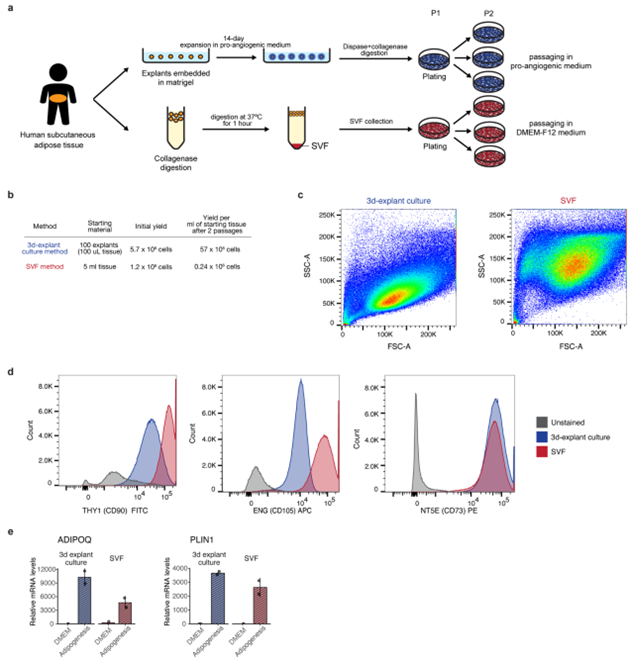
图S1 三维培养衍生祖细胞与从基质血管部分获得的细胞的比较
2 成脂诱导引发两种不同的命运轨迹
为了研究在分化过程中脂肪细胞和干细胞标志物同时增加的重要性,研究人员对两种细胞进行了单细胞RNA-seq:一种是生长到汇合但未受到任何分化刺激的多能祖细胞(非诱导祖细胞),第二种是经过成脂诱导培养基处理3天的细胞,该细胞虽然表现出轻微的脂质积累,但仍然适用于基于微流体的单细胞分析(图2a和图S2a-d)。对这两种细胞进行主成分分析,结果表明这两个细胞亚群没有重叠(图2b),这也就说明了细胞在成脂诱导下发生了广泛的转录组变化。
为了获得转录组变化的本质,研究人员将单个细胞聚集成亚群。受到成脂诱导的细胞可以被分为多个细胞亚群,这与PCA的结果是一致的(图2c),然而,用RNA速率分析(小编注:RNA速率分析是细胞轨迹分析的方法之一,通过比较含有内含子的前体mRNA (unspliced)和不含有内含子的成熟mRNA(spliced)的相对含量来分析mRNA的剪接和降解速率,spliced mRNA丰度和unspliced mRNA丰度的动态与平衡可以用来预示细胞转录状态的动态变化)细胞发育轨迹表明,在诱导过程中,祖细胞沿着两种不同的轨迹分化为两种细胞亚群(图2d)。其中一种轨迹的终点(对应亚群5细胞)细胞表达脂肪细胞特异性基因,包括AIDPOQ、PLIN1、脂蛋白脂酶(LPL)和脂肪酸结合蛋白4(FABP4),而另一种轨迹的细胞(对应亚群3细胞)就不表达这些基因,相反,这一发育轨迹以表达基质gla蛋白(MGP)和胶原三螺旋重复蛋白1(CTHRC1)(小编注:编码细胞外基质蛋白)为特征,并且这些细胞仍表达间充质干细胞/祖细胞标志物THY1、NT5E和ENG以及不分化细胞的结构蛋白,如核心蛋白聚糖(DCN)(图2e,图S2e)。
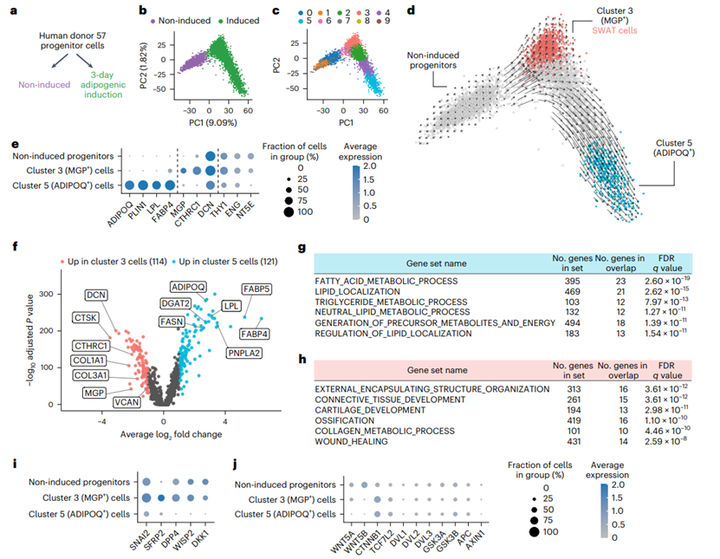
图2 诱导脂肪祖细胞单细胞RNA序列分析
3 亚群3细胞表达典型的Wnt靶基因
为了进一步探究非成脂性亚群3细胞的特性,研究人员对亚群3和亚群5进行了差异基因表达分析(图2f)。结果显示,亚群5富集了与脂肪细胞特异性途径相关的基因(图2g)。相反,亚群3富集了与结缔组织发育相关的基因,主要包括细胞外基质蛋白(图2h)。值得注意的是,这些细胞不表达骨细胞(骨钙素/BGLAP,骨桥蛋白/SPP1)或软骨细胞(可聚蛋白多糖/ACAN,软骨胶原/COL2A1)标志物,这表明它们并非成熟的骨细胞或软骨细胞。进一步分析亚群3细胞发现,多个典型Wnt靶基因(SFRP2、DPP4、DKK1、SNAI2和WISP2)显著上调(图2i和图S2f)。此外,经典Wnt信号的上游组分WNT5A和WNT5B(信号通路配体),核心通路元件β-catenin(CTNNB1)和TCF7L2表达显著上调(图2j)。接着,作者分析了来自两位供体的细胞RNA-seq转录组,并证实Wnt信号元件的表达在诱导分化时显著上升(图S2g-h)。此外,对ADIPOQ(亚群5)和MGP(亚群3)细胞之间潜在相互作用的配体受体分析显示,亚群5中的ephrin B1(EFNB1)和亚群3中的ephrin b型受体6 (EPHB6)可能发生相互作用(图S2i-j)。两种亚群之间的其他重要相互作用包括胶原/整合素和其他与同源受体相互作用的结构胞外蛋白。考虑到编码Wnt信号结构元件的基因和反映Wnt信号活性的基因同时被诱导,作者将亚群3细胞命名为SWAT细胞。
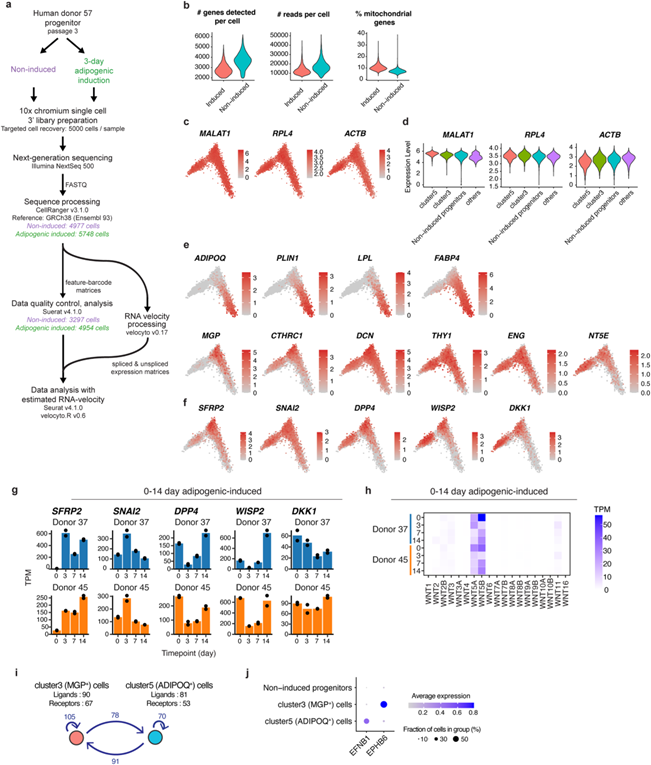
图S2 非诱导和3天成脂诱导的单细胞RNA-seq图谱的处理、质量控制和数据验证
4 SWAT细胞保留祖细胞特征并具有高Wnt活性
由于脂肪细胞分化过程中脂滴的积累会导致细胞密度降低,于是研究人员通过Percoll梯度离心(小编注:Percoll 是一种低粘密度梯度离心介质,用于制备细胞、亚细胞颗粒和较大的病毒。利用该介质的低粘度,可以在几分钟内使用低离心力(200-1000g)以预先形成的梯度获得细胞)将成脂细胞与非成脂细胞分离来进一步研究SWAT细胞的功能(图3a)。未诱导分化的间充质祖细胞在1.02-1.04 g/ml密度梯度(称为高密度HD细胞)中获得,而分化7 d的细胞可以在两个密度梯度中获得(图3b),一个为1.01-1.02 g/ml密度阶段(脂肪培养低密度A-LD细胞),另一个是1.03-1.04 g/ml密度阶段(脂肪培养高密度A-HD细胞)。在种板后,A-LD细胞含有丰富的脂滴,而HD和大多数A-HD细胞则没有(图3c)。反转录定量PCR(qRT-PCR)证实了A-LD细胞中ADIPOQ高表达,而A-HD细胞则高表达MGP(图3d)。此外,RNA-seq证实所有亚群5的标志物在A-LD细胞中富集,而SWAT细胞标志物在A-HD细胞中富集(图3e),证实分离方法是有效的,并允许进一步表征。
为了确定SWAT细胞是否保留多能性,作者将成脂分化7天后获得的A-HD细胞种板,并处理成脂、成骨或软骨分化培养基。3 天后,提取RNA,并通过qRT-PCR检测先前脂肪、软骨和成骨的早期谱系标志物的表达(图S3)。SWAT细胞表达了每一种谱系标记(图3g),提示它们具有多向分化能力。然后,作者用成脂或成骨分化培养基诱导细胞分化,在10天后染色,细胞分别显示了脂滴和钙聚集(图3h-i),进一步证实了上述结论。为了确定A-HD细胞的增殖能力,研究人员将A-HD细胞以低密度接种,并在用于扩增多能干细胞的培养基中培养(小编注:作者使用了专门用于人内皮细胞培养的液体培养基,即EBM培养基。它含有多种生长因子,如VEGF、bFGF、EGF等,可以促进内皮细胞的生长和增殖,同时也可以维持细胞的功能和形态。此外,EBM培养基还含有多种细胞黏附因子,如胶原蛋白、纤维连接蛋白等,可以促进内皮细胞与基质的黏附。在本文中,处于生长增殖状态的细胞均是使用该培养基培养)。24 h内,细胞开始增殖,并恢复到成纤维细胞的梭形形态特征 (图3j-k)。此外,MGP表达下降,表明细胞增殖后恢复到与非诱导的MGP阴性祖细胞相似的低Wnt活性状态(小编注:文献表明,过表达MGP通过经典Wnt信号通路促进成骨作用,并且敲除MGP会抑制Wnt信号通路。在前文中作者发现祖细胞成脂诱导三天后分离的亚群3细胞的标志物是MGP,并且高表达Wnt信号通路相关基因,提示二者存在正相关。而刚分离出来的祖细胞则低表达MGP,并且Wnt信号相关基因表达水平也不如亚群3。因此作者认为当祖细胞增殖后,MGP表达下降,Wnt信号相关基因表达也下降,说明增殖后的细胞干性下降)(图3l)。
SWAT细胞中经典Wnt靶基因表达升高,提示Wnt信号被激活。为了验证Wnt信号在SWAT细胞中是活跃的,作者使用了Super TopFlash(STF)报告质粒,其中包含7个调控萤火虫荧光素酶表达的LEF/TCF结合位点。在成脂诱导前将STF报告基因转染到祖细胞中,7 d后Percoll密度离心分离细胞(图3m)。与A-LD细胞相比,A-HD细胞显示出明显更高的报告基因活性,证实SWAT细胞具有更高的经典Wnt活性(图3n)。
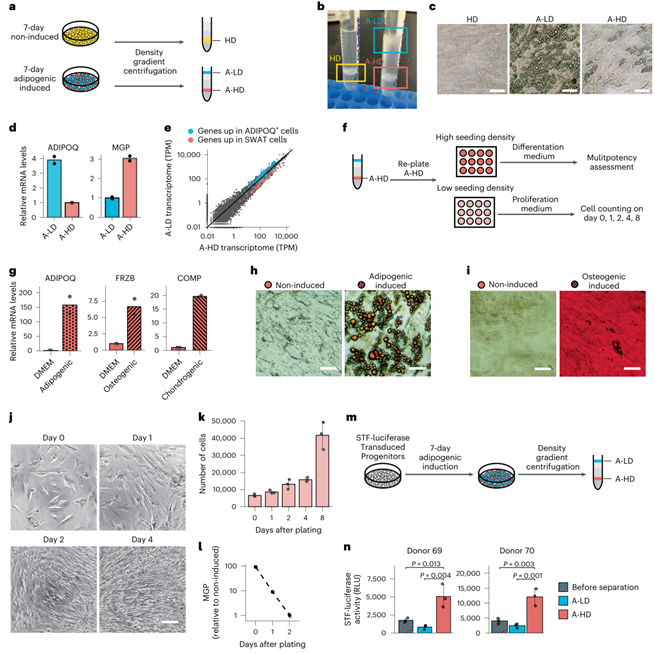
图3 SWAT细胞是具有高度经典Wnt活性的多能间充质祖细胞
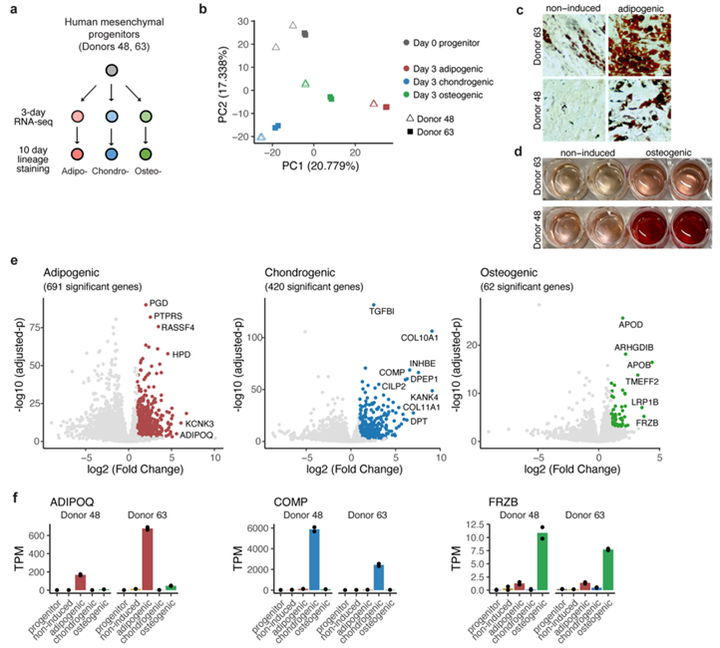
图S3 多谱系时间序列RNA测序鉴定早期成骨和软骨谱系标记
5 Wnt调控脂肪生成和SWAT命运之间的平衡
由于SWAT细胞具有高Wnt活性和Wnt靶基因表达,于是作者认为Wnt信号可能在维持多能祖细胞中发挥作用。为了验证这种可能性,作者探究了在脂肪生成诱导过程中干扰经典Wnt信号的影响。CHIR99021通过抑制GSK3和阻止磷酸化诱导的β-catenin降解,从而增强Wnt信号传导。在初步实验中(图4a),研究人员发现浓度高于0.5 μM的CHIR99021导致ATP水平降低,膜通透性增加,表明细胞活力受损。因此,他们使用了较低的剂量(0.4 μM),并将处理时间限制在成脂诱导的Day -1到Day 3(图4b)。结果显示该抑制剂处理仅2天(诱导后-1至+1天)就能导致ADIPOQ表达下降,MGP表达相对增加,以响应成脂诱导(图4c)。并且,该Wnt信号的促进是持久的,因为在诱导后第9天测量的脂滴数量和大小减少(图4d)。总之,上述结果表明促进经典Wnt信号能维持细胞干性,抑制细胞成脂分化。
接下来,为了探究抑制经典Wnt信号是否会产生相反的效果,作者利用XAV939稳定AXIN并促进β-catenin降解来抑制经典Wnt信号通路。Wnt抑制剂处理祖细胞1天即可增加ADIPOQ的表达(图4f),同时处理2天就能使脂滴数量和大小增加(图4g-h)。值得注意的是,MGP响应CHIR990021或XAV939的表达水平变化趋势与ADIPOQ相反(图4c,f)。总之,上述结果表明抑制经典Wnt信号能降低细胞干性,促进细胞成脂分化。
由于GSK3和端锚聚合酶(tankyase)分别具有β-catenin和AXIN以外的其他底物,于是作者利用两种慢病毒工具调节Wnt信号来验证前文结论,一种是显性阴性TCF构建体(dnTCF)(小编注:该工具可过表达含有N端缺失的TCF显性失活形式的蛋白,进而结合Wnt靶基因,但失去了结合β-catenin的功能,进而无法发挥转录共激活因子的功能,达到抑制Wnt信号的作用。同理,下文的dpBCat能过表达β-catenin,进而激活Wnt信号);另一种是组成型β-catenin(dpBCat)。结果显示,在人间充质祖细胞中转染dnTCF后诱导分化,最终形成的脂肪细胞大小似乎比对照组更大。为了定量评估dnTCF转染是否促进脂肪形成,作者量化了dnTCF和对照组中含有脂滴的mCherry阳性细胞的数量。对来自四个独立供体的人祖细胞转染后分化(图S4)。结果显示,dnTCF转染后68-88%的mCherry阳性细胞中有含有脂滴,而对照组只有17-23%的mCherry阳性细胞含有脂滴(图4j),这表明抑制Wnt信号通路能促进了脂肪形成。
接下来,作者利用dpBCat过表达β-catenin,进而激活Wnt信号通路。尽管HEK293细胞中高表达β-catenin,但是作者并未发现转染成功的mCherry阳性细胞,这表明持续激活Wnt信号或高于生理水平的激活对细胞是有害的。于是作者利用Wnt3a重组蛋白来促进祖细胞的经典Wnt信号激活,处理时间与上文药物处理时间一致(图4k)。结果显示,Wnt3a导致分化后的脂肪细胞脂滴数量和大小呈剂量依赖性减少(图41-m),同时对细胞活力没有影响(图4n)。通过RT-PCR也观察到ADIPOQ的表达降低,MGP表达上升(图4o),这与药理学抑制GSK3,进而激活Wnt信号的结果一致(图4c-e)。综上所述,人类间充质祖细胞对经典Wnt信号高度敏感,而这一途径的轻微激活足以将细胞命运转向维持干性。
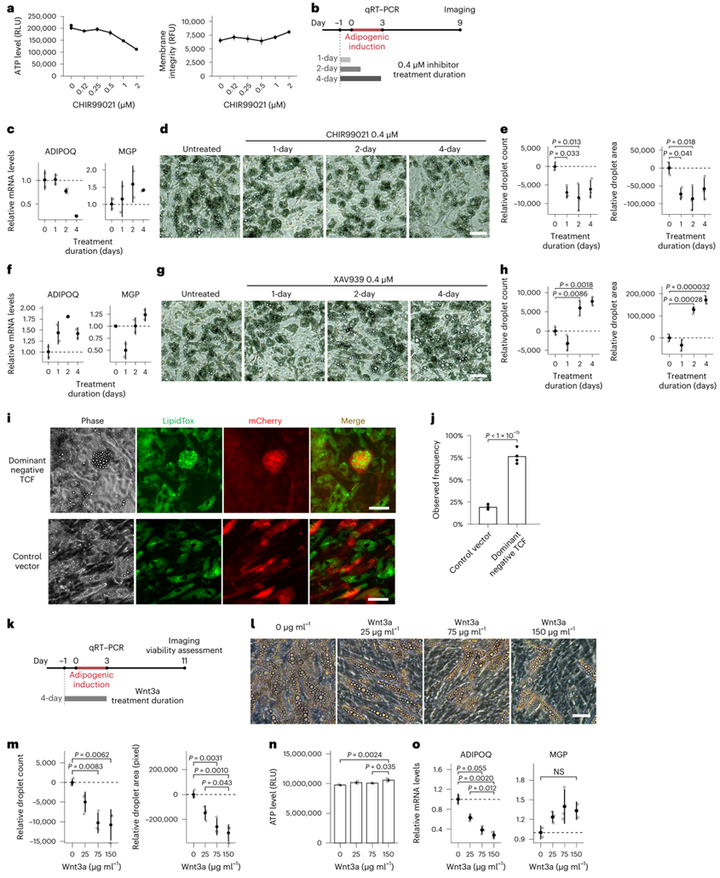
图4 经典Wnt信号控制脂肪分化和祖细胞维持之间的细胞命运平衡
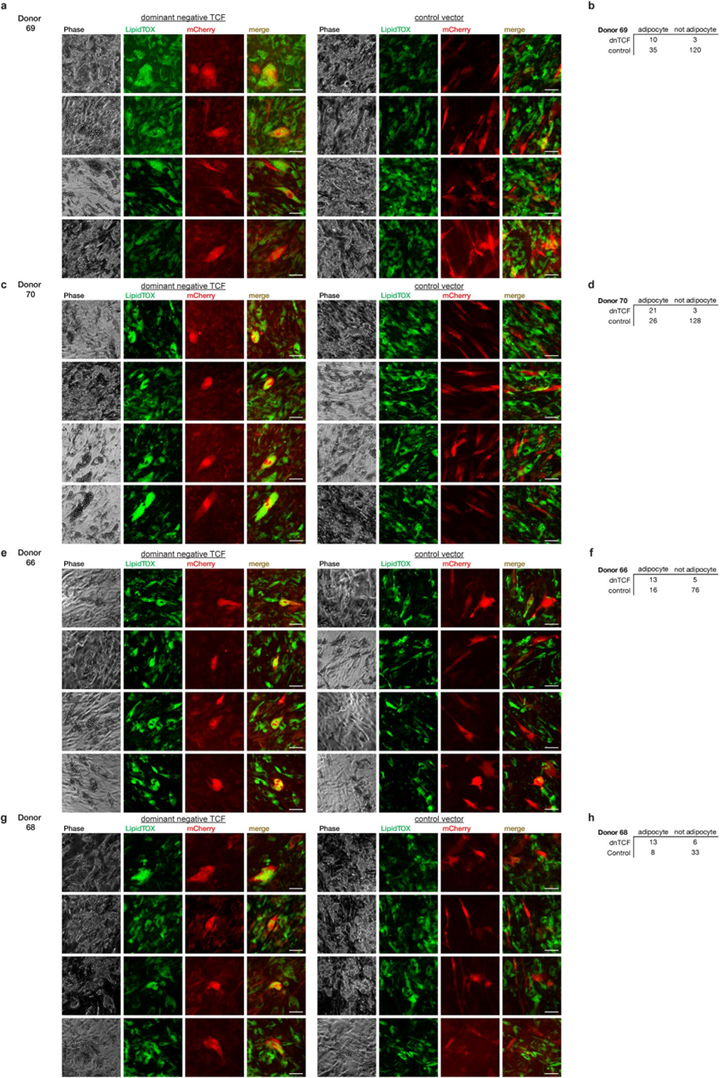
图S4 显性失活TCF表达祖细胞具有成脂命运偏好
6 Wnt活性在细胞命运决定之前上调
上述结果表明早期短暂的Wnt信号变化足以导致脂肪分化的长期变化。为了确定Wnt激活是否发生在成脂早期,作者进而探究转染了报告基因的祖细胞在三种条件下的Wnt活性变化,即增殖条件下、无脂肪诱导的非增殖条件下(即普通DMEM)和成脂条件下。结果显示,仅在成脂诱导条件下,Wnt活性上升,并且在24小时内出现,48小时内达到峰值(图5a)。同时,研究人员通过RNAscope(小编注:该方法是一项新颖的用于检测位于完整细胞中目标RNA的原位杂交检测技术。原理基于反义RNA与靶基因RNA的碱基配对,利用标记的反义RNA为探针,与切片或细胞杂交,从而原位显示RNA的表达部位和相对丰度)检测到的MGP和FABP4 mRNA的相反表达模式,观察到两种细胞命运(图5b)。在第2天和第3天,表达MGP或FABP4的细胞数量显著增加(图5b,c),但两种转录本的信号总强度没有增加(图5b,d),这表明细胞对每种命运的快速定型都伴随着Wnt信号激活。接着作者又对每个细胞的转录本信号强度进行量化,结果表明两种基因表达在很大程度上是相互排斥的,并且随着时间的推移,更多的细胞表达MGP或FABP4(图5e)。总之,多能间充质祖细胞在成脂刺激下的Wnt信号被促进,从而产生能够增殖和补充祖细胞库的SWAT细胞亚群(图5f)。
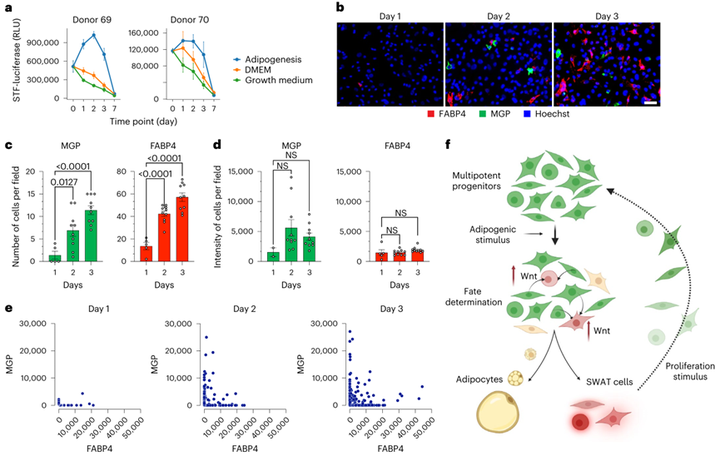
图5 脂肪生成刺激诱导的早期经典Wnt信号与祖细胞命运一致
7 体内脂肪组织中的SWAT细胞
接下来,研究人员试图确定SWAT细胞是否存在于体内人类脂肪组织发育过程中。作者将人间充质祖细胞植入免疫缺陷小鼠体内(图6a),并形成一个功能性的人/小鼠杂交脂肪库(图6b)。对植入8周后形成的脂肪组织中人类特异性转录本进行分析,结果出现人类脂肪细胞基因、间充质祖细胞标记物和经典Wnt靶基因的表达(图6c),表明在体内环境中形成了一个多能祖细胞库。于是作者进一步选择SWAT和ADIPOQ+细胞之间差异表达最高的40个基因,进而表征每种细胞类型(图6d),并在体外脂肪细胞分化(图6e)和体内脂肪组织形成(图6f)过程中分析这些基因变化。研究人员发现无论是体内还是体外,SWAT和ADIPOQ+细胞特征在成脂过程后都迅速诱导并持续存在。
为了确定SWAT和ADIPOQ细胞群是否存在于成人脂肪组织中,研究人员利用了此前发表单细胞和单核转录组图谱。作者发现SWAT细胞存在于间充质祖细胞(ASPCs)中,而ADIPOQ+细胞则存在于成熟脂肪细胞中(图6e),表明SWAT细胞存在于成人脂肪组织中。此外,在ASPCs中可以看到SWAT细胞特有的Wnt靶基因的表达,但在成熟脂肪细胞中可以忽略不计(图S5a)。值得注意的是,与内脏脂肪组织相比,皮下脂肪组织(SAT)的ASPCs中SWAT细胞标记基因的总体水平更高(图S5b),这表明细胞定型动力学依赖于脂质储存。此外,MGP和ADIPOQ都随着体重指数的增加而降低(图S5c-d),这表明持续的成脂刺激可能导致祖细胞丰度降低(小编注:脂联素是一种脂肪分泌因子,在机体内分布广泛,主要脂肪细胞产生,因此它也常常被认为是成熟脂肪细胞的标志物。然而在功能上,它发挥着改善代谢的功能。当脂联素与其受体结合后,AMPK和p38MAPK的磷酸化增强,通过增强PPARα转录活性,进而促进脂肪酸氧化和葡萄糖利用增加。同时AMPK也能抑制乙酰辅酶A羧化酶活性,进而减少丙二酰辅酶A的产生,进一步增强脂肪酸氧化,最终提高组织胰岛素敏感性。此外,脂联素还可以促进抗炎因子的转录,如IL-10等,抑制促炎因子的转录,如TNF等,共同改善机体胰岛素抵抗。因此,血清脂联素水平与BMI、胰岛素抵抗呈现负相关)。文献表明,脂肪组织特异性β-catenin敲除小鼠的原代小鼠间充质祖细RNA-seq结果也支持Wnt在体内诱导SWAT细胞的产生。在该研究中,这些细胞显示MGP表达下降,而Wnt3a处理后MGP数量上升(图S5e),这意味着小鼠脂肪组织中经典Wnt信号传导与SWAT细胞发育有关。值得注意的是,Wnt配体也在脂肪组织内的其他细胞类型中表达,因此局部细胞微环境可以通过Wnt信号传导在脂肪组织的正常或病理发育中发挥作用(图S5f)。
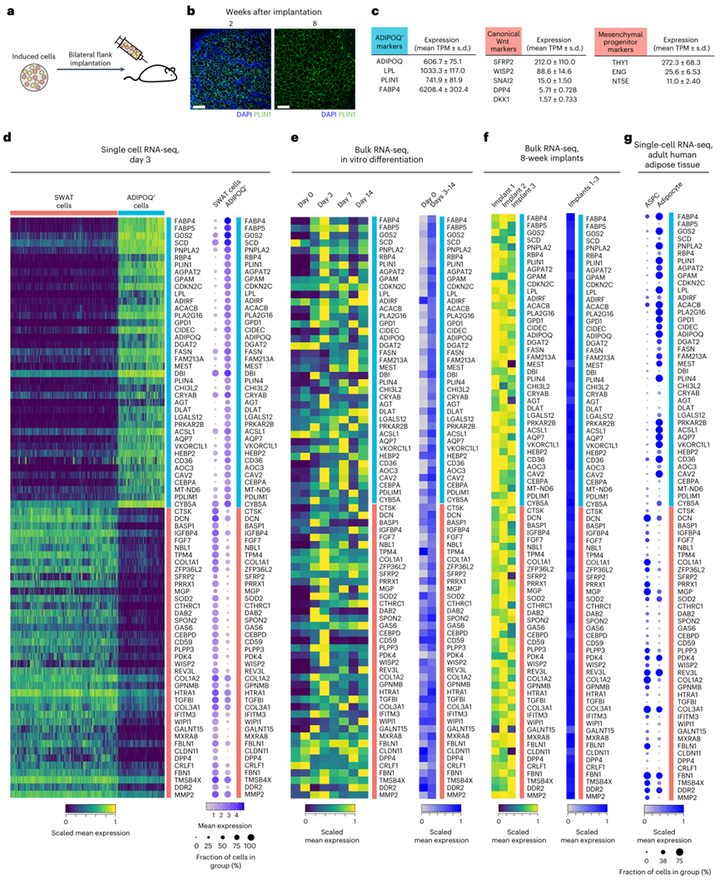
图6 体内发育和成人脂肪组织中SWAT细胞存在的证据
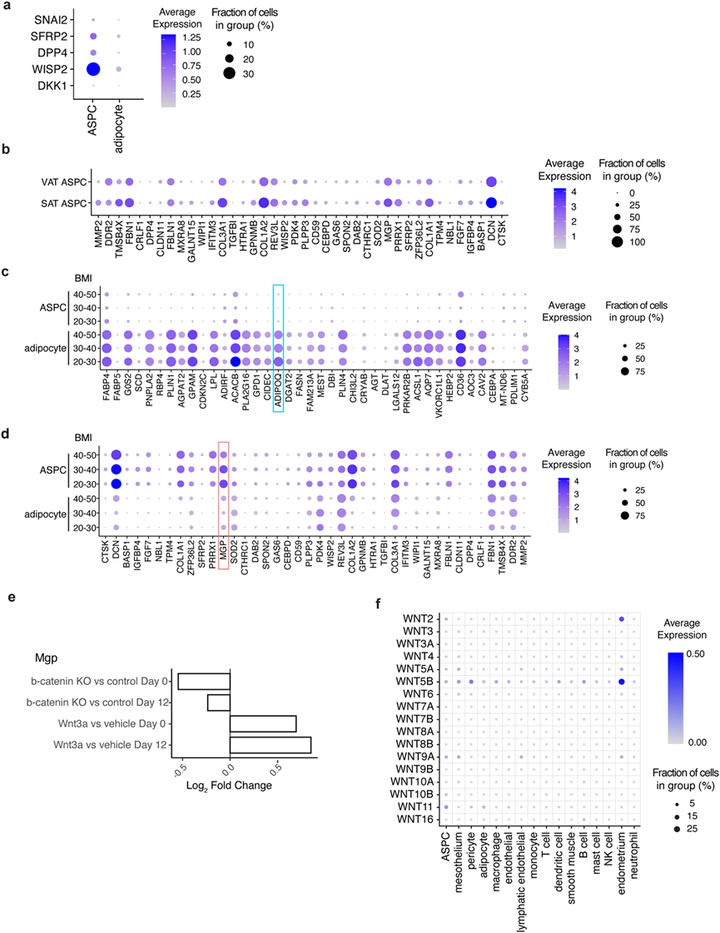
图S5 SWAT细胞表征人类和小鼠脂肪组织祖细胞
总结
在整个生命周期中,间充质干细胞/祖细胞对于组织发育和修复是十分重要的,但是在多种分化压力下,它们是如何维持自身的数量和分化能力仍是未解之谜。本文中研究人员利用人类祖细胞单细胞转录组技术,发现了脂肪细胞分化过程中形成了两种细胞轨迹:一种朝向成熟细胞发育;另一种朝向非分化、保持祖细胞特性的细胞发育,这些非分化细胞由瞬时Wnt信号通路激活诱导,并且表达大量细胞外基质基因,因此被命名为组成型Wnt调节脂肪组织细胞(SWAT),他们发现SWAT的遗传特征存在于成人脂肪组织,并且移植到小鼠中的人类脂肪祖细胞分化而成的脂肪组织也存在SWAT。本文提出了一种机制,即脂肪细胞分化与间充质祖细胞库的干性维持同时发生,确保了生命周期中组织发育、修复和代谢调控。
原文链接:https://www.nature.com/articles/s42255-023-00813-y
https://m.sciencenet.cn/blog-3483272-1402277.html
上一篇:代谢学人--Cell Metabolism:看线粒体如何“嵴”速享“瘦”
下一篇:代谢学人--Nature Metabolism:胰岛素敏感性:谁动了我的BCAA?