博文
代谢学人--Nature:节食未必瘦?GDF15来报道!
||
代谢学人
Nature:节食未必瘦?GDF15来报道!
撰文 | 郭钰涵 武霞 周文豪 邱瑾
编辑 | 孟美瑶
校对 | 于柳

背景介绍
GDF15主要在肝脏和肾脏中高表达,但可响应各种细胞中线粒体毒素和内质网应激的诱导。线粒体毒素是由线粒体功能障碍引起的各器官水平的毒性,如皮肤致敏、呼吸致敏、遗传毒性和肝毒性。有文献报道,线粒体功能障碍导致转录因子和信号分子的激活,包括ATFS1、ATF4、p53和TORC1,这些转录因子和信号分子除了改变代谢外,还会诱导GDF15的分泌。一项针对13名患有不同类型线粒体肌病患者的研究表明,血清GDF15水平显着升高。总的来说,GDF15可由多种不同的细胞和组织的细胞应激诱导,即在正常的组织中表达较少,但受伤组织中表达会上调。比如在正常情况下,GDF15并不在成人心肌中表达,但在心肌损伤后心脏内的心肌细胞、巨噬细胞、脂肪细胞、内皮细胞和血管平滑肌细胞都会显著表达GDF15。GDF15最初被认为是巨噬细胞和癌细胞分泌的可溶性因子,后来发现其还可以诱导恶病质(小编注:恶病质也称为癌症恶病质或癌症厌食症恶病质,是一种消耗性综合征。它是由于慢性疾病,如癌症,营养不良而产生的肌肉、脂肪含量丢失的情况。),另外,也发现GDF15可以抑制小鼠肥胖并缓解胰岛素抵抗。研究表明,重组GDF15处理能够缓解啮齿动物摄食高脂饮食所引起的体重增加和肝脂变性,并增强血糖调节能力。GDF15的减肥效果需要后脑的参与,更确切地说,需要后脑中GDF15的受体GFRAL(小编注:GFRAL主要存在于后脑孤束核和脑干后区内的神经元中,GDF15主要通过与GFRAL受体结合发挥作用)。短期实验(7-10天)发现,GDF15主要通过抑制摄食降低体重。此外,在摄食高脂饮食的条件下,GDF15敲除、肝特异性GDF15敲除和GFRAL敲除会促进小鼠摄食及肥胖,表明GDF15-GFRAL途径在调节能量平衡中的生理作用。这些研究表明,GDF15-GFRAL信号可通过抑制食欲来减轻体重并增强血糖调节能力,而对能量消耗的影响较小。
能量摄入和消耗间的热量失衡导致肥胖发生。尽管已证实GDF15抑制啮齿类动物和非人类灵长类动物的能量摄入,但如果想证明这是GDF15唯一有助于减肥的机制(小编注:即如果要研究GDF15是否也能通过减少能量消耗的机制来减肥),需要考虑三个重要的方面。第一,也是最重要的一点,能量摄入、能量消耗和体重是相互依存的关系,它们之间是动态联系的,减少能量摄入和减轻体重都可以导致能量消耗的减少。其次,在GFRAL敲除小鼠中GDF15作用时间相对较短(7-10天),可能不足以检测与能量消耗减少(小编注:即适应性产热,adaptive thermogenesis,指当存在热量差(热量盈余或热量缺口)的时候,人体热量消耗出现自发性改变的过程(热量消耗增加或减少)以维持机体稳定状态,而体重增长或降低实际上都是打破稳态而构建新稳态的过程,因此机体为了应对长时间能量摄入减少和体重降低,会代偿性地减少能量消耗,这种代偿性机制被称为“适应性产热”。需注意的是,一般研究脂肪产热中的适应性产热偏重产热能力thermogenesis,而这里重点指的是适应性adaptive)相关的调节,该反应通常发生在啮齿类动物较长时间的热量限制之后。最后,已知21 °C室温(低于啮齿动物的热中性温度)能刺激小鼠交感神经调控代谢和能量平衡。这一温度可能会抑制诱导无效循环的药物作用,或通过β-肾上腺素能信号刺激的能量消耗(小编注:已有文献报道,与22°C相比,30°C条件下小鼠的食物摄入量、代谢率和棕色脂肪活动减少,同时肥胖增加。所以不同条件下,药物治疗或者机制研究结果可能不同,因此需要进一步了解环境温度的影响)。上述研究表明,在研究小鼠的减肥和药物干预时,综合考虑热量摄入、干预持续时间和环境温度之间的相互关系很重要。因此,本文从多个角度系统性地研究了GDF15发挥生物学作用的相关机制。

敲黑板啦!
1、GDF15不仅只通过抑制食欲减肥
2、GDF15缓解NASH与食物摄入量的减少无关
3、GDF15阻止代偿性的能量消耗减少
4、GDF15通过GFRAL-β-肾上腺素信号维持能量消耗
5、GDF15通过钙无效循环增加骨骼肌能量消耗
6、GDF15与临床人群SLN的增加和NAFLD的减少有关
研究结果
1. 抑制食欲并非是GDF15生物学作用的唯一机制
为了更好地了解GDF15促进减肥的机制,作者在热中性温度(29 °C)下,给小鼠喂食高脂高果糖的西方饮食,该饮食能促进肥胖、胰岛素抵抗和非酒精性脂肪肝炎(NASH),其病理、组织学和转录特征与人类疾病发展相似(图1a)。由于小鼠的肝脏脂肪变性对热量摄入的变化非常敏感,作者假设给予半衰期较短的人GDF15(小鼠体内半衰期为2 h),与之前在小鼠黑暗周期开始时给药相比,在光照周期开始时(小鼠热量摄入较少的时间段)给药对食物消耗的影响可能要更小一些。与该假设一致,和对照组相比,在光照周期开始时注射GDF15(5 nmol/kg)会导致小鼠每日食物摄入量减少30%,而在黑暗周期开始时给药会减少43%(差异约为40%;扩展数据图1a)。作者随后在光照周期开始时每天给小鼠注射对照溶液和三种不同剂量的GDF15重组蛋白(0.3、1和5 nmol/kg),持续6周。每天测量个体食物摄入量,并与配对喂养的小鼠进行匹配。给小鼠注射GDF15能快速升高血清中GDF15的浓度,且浓度随注射剂量的增加而增加,在黑暗周期开始时,GDF15水平会下降到基线(图1b)。正如预期的那样,长期每天GDF15给药会导致食物摄入量的剂量依赖性降低(图1c),与之前结果一致。
与对照处理或配对喂养的小鼠相比, 0.3nmol/kg GDF15处理并未显著改善体重、脂肪量、血清胰岛素、糖耐量、胰岛素抵抗、肝脏组织学、肝脏甘油三酯或其他血浆指标(扩展数据图1b-i)。在GDF15处理(注射浓度分别为1nmol/kg和5nmol/kg)的前十天,GDF15处理和配对喂养组小鼠的体重减轻趋势相似(图1d和扩展图2a)。但是,10天之后 ,配对喂养组小鼠的体重没有进一步减少,而GDF15处理组的小鼠体重继续下降(图1d和扩展图2a)。实验结束时,用1和5nmol/kg GDF15处理的小鼠体重分别减少了13.6%和23.0%,而配对喂养组小鼠的体重只减少了5%(图1d)。重要的是,这种体重减轻归因于脂肪质量的减少,而不是瘦肉质量的减少(图1e),这提示能量消耗可能在其中扮演重要作用。与体重和肥胖的降低一致,1和5nmol/kg GDF15处理降低了小鼠血清胰岛素含量(图1f),而且与对照注射组相比,5nmol/kg GDF15处理改善了葡萄糖耐量和胰岛素敏感性(扩展图2b,c)。这些数据表明,与单独热量限制相比,长期GDF15给药能更大程度上促进体重的减少,并改善胰岛素抵抗。
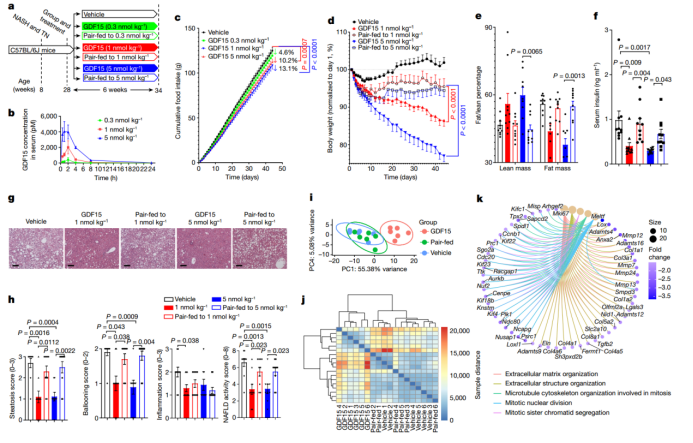
图1. GDF15改善肥胖、胰岛素抵抗和NASH与减少食物摄入无关

附图1. 0.3 nmol/kg的GDF15处理对体重、身体成分、葡萄糖稳态和NAFLD没有影响
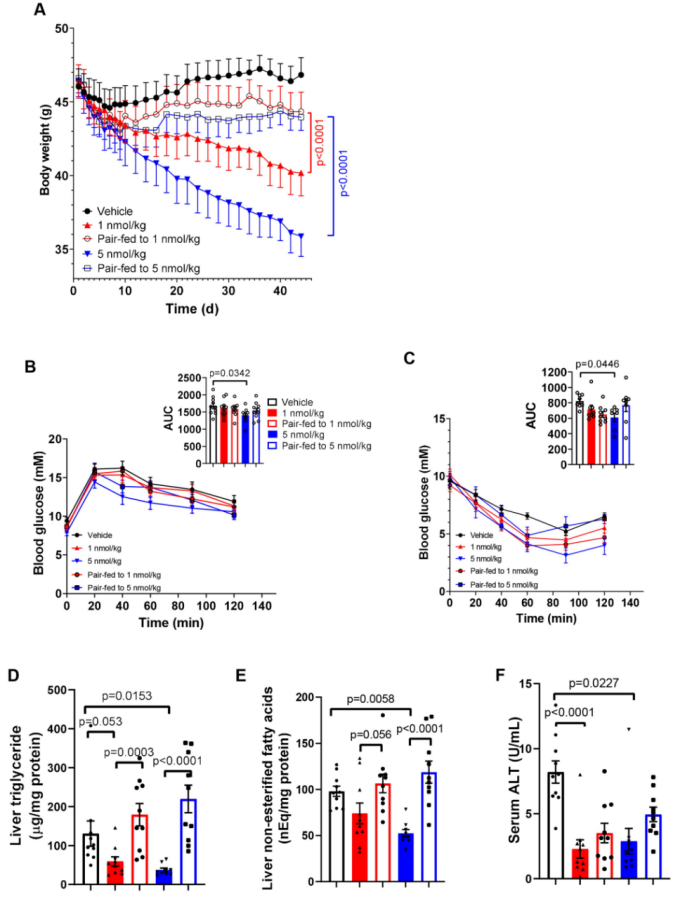
附图2. GDF15通过GFRAL增加能量消耗并降低体重
2. GDF15降低NASH不依赖于热量摄入
NAFLD是导致胰岛素抵抗的一个重要因素。GDF15(1和5 nmol/kg)处理,能降低肝脏脂肪变性和NAFLD评分(图1g,h)。与这些组织学变化一致,GDF15处理能降低肝脏甘油三酯、肝脏游离脂肪酸和血清谷丙转氨酶(ALT)水平(扩展图2d–f)。基于方差稳定变换(VST)的主成分分析(PCA),以及相同肝样本RNA测序(RNA-seq)数据的差异热图分析显示,GDF15处理(1 nmol/kg)和对照处理,以及配对喂养组之间有明显差异(图1i,j)。与对照处理和配对喂养组相比,GDF15处理会引起许多基因表达发生变化(扩展图3a,b),该变化与细胞外基质组织、细胞外结构组织(图1k和扩展图3d)、白细胞/巨噬细胞迁移和磷脂酰肌醇3-激酶-AKT信号传导有关(扩展图3d,e),而对照处理和配对喂养组之间相比则没有这些基因的表达差异(小编注:说明GDF15降低NASH不依赖于热量摄入)(扩展图3c)。分层聚类显示,与对照处理或配对喂养组相比,GDF15处理改变了肝纤维化相关的转录组特征(扩展图3f)。此外,与用于预测人类NASH进展的25个标记基因进行比对发现,GDF15处理下调了25个基因中的20个(Akr1b10、Ankrd29、Ccl20、Clic6、Col1a1、Col1a2、Dtna、Dusp8、Epb41l4a、Fermt1、GDF15、Hecw1、Itgbl1、Ltbp2、Pdgfa、Rgs4、Sctr、Thy1、Tnfrsf12a和Tyms),而仅上调了1个基因(Hsd17b14)(扩展图3g)。因此,GDF15降低NASH与热量摄入的减少无关。
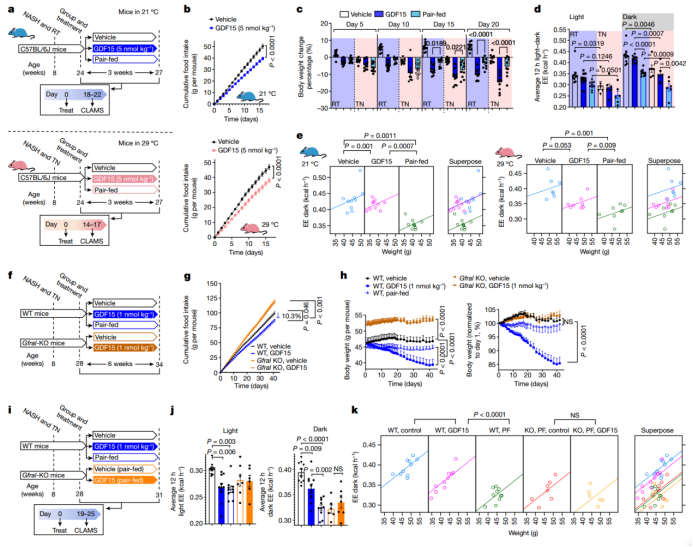
图2. GDF15通过GFRAL增加能量消耗并减少体重
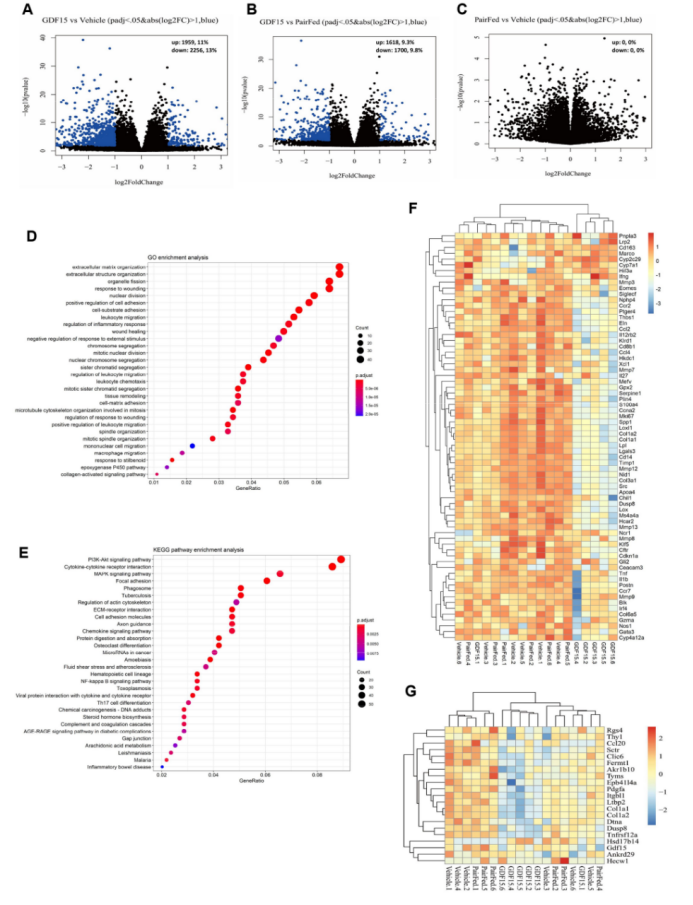
附图3. GDF15通过β-肾上腺素受体增加能量消耗和脂肪酸氧化
3. GDF15阻止代偿性的能量消耗减少
为了检验与配对喂养小鼠相比,GDF15处理的效果是否取决于饲养温度,作者随后分别在21℃和29℃条件下完成配对实验(图2a)。在16天内,GDF15处理会导致喂养在21℃和29℃的小鼠的累积食物摄入量减少 (分别减少21.3%和19.2%),减少程度类似(图2b)。GDF15诱导的体重减轻与在21℃和29℃下配对喂养5或10天的小鼠没有差异 (图2c)。10天之后,无论室温如何,GDF15处理的小鼠体重继续减轻,而配对喂养的小鼠则没有变化(图2c)。
为了研究GDF15如何促进体重减轻,作者将小鼠放入代谢笼中。两组之间的体力活动没有变化(扩展图1)。然而,与配对喂养的小鼠相比,GDF15处理导致的体重持续减轻与黑暗周期能量消耗的维持有关,而即使在通过协方差分析校正体重后,配对喂养小鼠的能量消耗是减少的(ANCOVA;图2d,e)。GDF15维持能量消耗的这种效果是明显的,并且与饲养温度无关。而与预期一致,在21℃时的能量消耗在所有条件下均显著高于在29℃时的能量消耗(图2d)。这些数据表明,在21℃或29℃条件下饲养的小鼠,相比限制热量,GDF15处理10天以上可以通过维持能量消耗来促进体重减轻。
昼夜节律和进食时间同样会影响能量消耗;因此,作者研究了GDF15在两不同配对喂养组之间的影响(配对喂养的晨间组,在光照周期开始时喂食(6:00-7:00);配对喂养的夜间组,在黑暗周期开始时喂食(18:00–19:00),这些实验在另一个地点(丹麦诺和诺德)进行)。这里采用更高剂量的GDF15(8 nmol/kg)处理小鼠,结果均导致能量消耗增加,同时加速体重下降(扩展图4),说明GDF15增加能量消耗与进食时间无关。
另一个通过热量限制减少能量消耗的重要机制涉及甲状腺激素三碘甲状腺原氨酸。已知GDF15可激活下丘脑-垂体轴,这可能对维持能量消耗很重要。然而,GDF15处理没有改变小鼠的促甲状腺激素(TSH)水平(扩展图5a,b),并且与配对喂养的小鼠相比,用三碘甲状腺原氨酸的阻断剂(丙基硫氧嘧啶)长期处理小鼠,并不能阻止GDF15诱导的体重减轻或能量消耗增加(扩展图5d–g)。同样,先前参加饮食诱导减肥计划的肥胖女性中,TSH和GDF15之间也没有相关性(扩展图5c)。因此,与热量限制相比,GDF15维持能量消耗,而不受饲养温度、喂养时间或甲状腺激素的影响。

附图4. GDF15增加能量消耗与进食时间无关
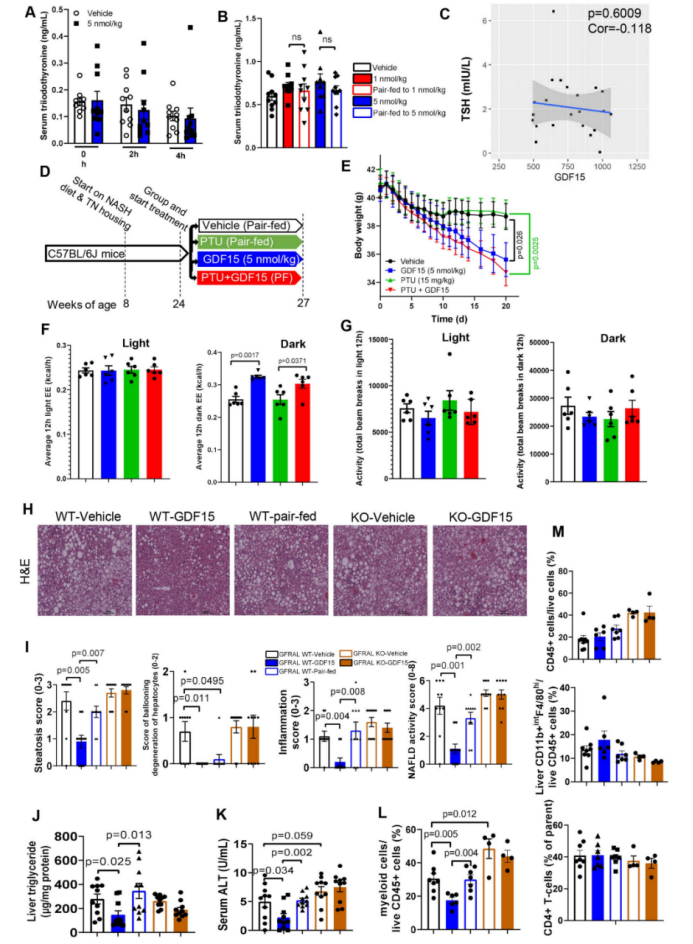
附图5. 三碘甲状腺原氨酸(T3)可能不是GDF15引起体重减轻和能量消耗(EE)增加的主要机制
4. GDF15通过GFRAL维持能量消耗
在21°C条件下给小鼠喂养高脂饮食,GFRAL敲除(KO)小鼠比野生型(WT)小鼠更肥胖,并且在7-10天内对GDF15的食欲抑制作用具有抵抗力,但该受体在热中性及长时间处理条件下,是否对GDF15降低体重和NASH的效应很重要,尚不得而知。使用上述类似的处理条件(图2f),作者发现,与其同窝出生的WT小鼠相比,GFRAL KO小鼠具有更高的食物摄入量,并且对GDF15(1 nmol/kg)处理小鼠的食欲抑制作用具有抵抗性(图2g)。GFRAL KO小鼠与其同窝出生的WT小鼠相比,具有更高的体重(图2h)。在野生型小鼠中,与对照处理和配对喂养的小鼠相比,GDF15处理降低小鼠体重,而在GFRAL KO小鼠中这种作用被减弱(图2h)。GFRAL KO小鼠也会抑制GDF15在降低小鼠脂肪变性、气球样变、炎症和NAFLD评分(扩展图5h,i)、肝脏甘油三酯(扩展图5j)和血清ALT(扩展图5k)方面的影响。此前有研究表明,GDF15可能不依赖GFRAL作用于髓系细胞,而在肝脏中表现出抗炎作用。然而,作者发现,与肝脏炎症评分一致,GDF15通过GFRAL来减少肝髓细胞群,且与食物摄入量的减少无关(小编注:与对照组相比,GDF15处理组的肝髓细胞群会减少;前文中已经说明,GDF15处理会影响食物摄入,因此为了排除摄食的影响,作者增加了配对喂养组,结果表明,配对喂养组的肝髓细胞群并没有像GDF15处理组那样减少,而GDF15组和配对喂养组的摄食量一样,进而排除摄食量对细胞群的影响)(扩展图5l,m和扩展图2)。数据表明,与体重变化一致,GDF15通过GFRAL依赖性机制减少NAFLD和肝脏炎症,该机制与食物摄入的减少无关。
为了验证GDF15是否通过GFRAL维持能量消耗,作者在WT和GFRAL KO小鼠中进行19天的GDF15处理(图2i),而19天是两组之间体重出现显著差异之前的时间点(图2h和扩展图6a)。结果表明,不同处理组之间的体力活动没有差异(扩展图6b)。与WT对照处理和配对喂养的小鼠相比,在黑暗周期期间,GDF15处理的小鼠维持了能量消耗,而在GFRAL KO小鼠中消除了这种影响(图2j)。与配对喂养或GFRAL KO小鼠相比,GDF15对能量消耗的维持在通过ANCOVA校正体重后持续存在(图2k)(这点从2k中如何看出?在校正体重之后,与配对喂养(WT, PF)和GFRAL KO(KO, PF, control 和KO, PF, GDF15)组相比,在体重一致的情况下,GDF15(WT, GDF15)处理组的那条线在上方(最右侧的红色箭头处),说明其能量消耗更高)。GDF15还降低了呼吸交换率(RER),这表明与配对喂养的小鼠相比,GDF15处理的小鼠脂肪酸β氧化水平更高,而碳水化合物氧化程度较低,这一影响在GFRAL KO小鼠中也被消除(扩展图6c–e)。因此,与更长时间的体重减轻作用一致,GDF15需要通过GFRAL来增加脂肪酸氧化并防止热量限制引起的能量消耗减少。
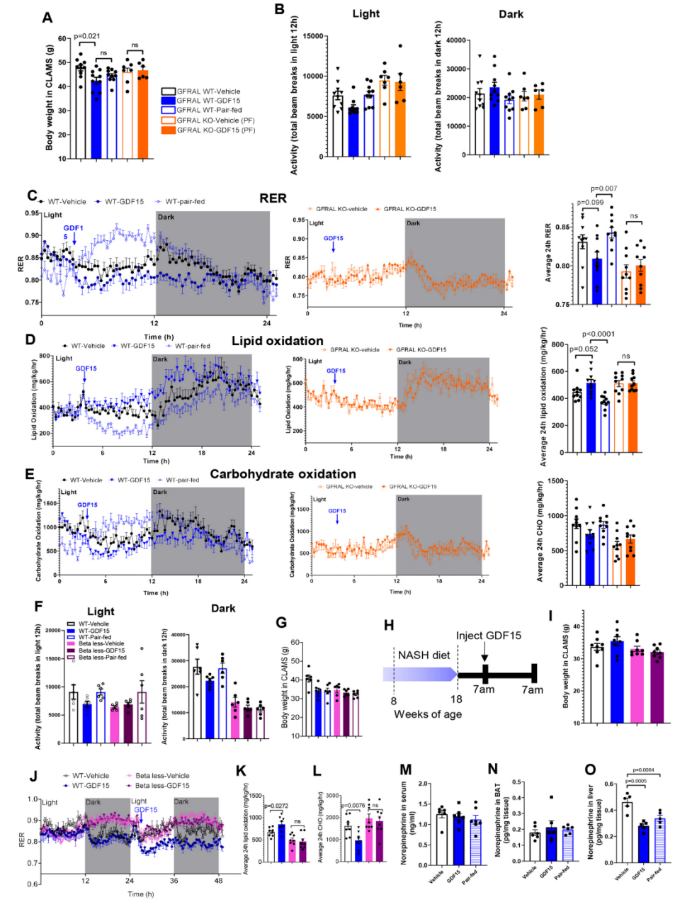
附图6. GDF15通过GFRAL和β-肾上腺素能信号增加能量消耗和脂肪酸氧化。
5. GDF15增加β-肾上腺素能信号传导
GFRAL仅在后脑中表达,提示GDF15可能通过脑-躯体组织回路增加能量消耗。除了三碘甲状腺原氨酸的变化外,交感神经系统(SNS)活性的抑制也是热量限制和体重减轻引起能量消耗减少的重要因素。为了测试与配对喂养的小鼠相比,GDF15处理是否可以通过增加SNS活性来促进体重减轻,作者给WT小鼠和β1、β2和β3肾上腺素能受体缺失的小鼠(以下称为β受体敲除小鼠)进行GDF15处理(图3a)。β受体敲除小鼠对GDF15抑制食物摄入的作用反应正常(图3b);然而,当在体重出现差异之前将其置于代谢笼中时(扩展图6g),与WT对照相比,β受体敲除小鼠对GDF15在黑暗周期中维持能量消耗的作用具有抵抗力(图3c、d和扩展图6f)。而且β受体敲除小鼠也对GDF15降低RER和增加脂肪酸氧化的作用具有抗性(图3e和扩展图6h–l)。此外,与GFRAL KO小鼠的观察结果类似,用GDF15对β受体敲除小鼠进行长期处理,并没有比单独配对喂养更能减轻体重(图第3f)。总之,这些数据表明,GDF15可通过GFRAL–β-肾上腺素能信号轴,增加能量消耗并促进减重。
为了检测哪些组织可能参与这种作用,作者对注射了GDF15(1 nmol/kg)30 天的小鼠,检测其在2小时后的血清和组织去甲肾上腺素含量。GDF15不会增加血清、肩胛骨间棕色脂肪组织(iBAT)或肝脏中的去甲肾上腺素水平(扩展图6m–o)。与该发现一致,肝脏、白色脂肪组织和BAT的β-肾上腺素能或无效信号通路没有变化(扩展图7a-d),也没有脂肪组织褐变的迹象(扩展图7e,f)。作者还发现,AMPK脂肪组织缺失小鼠对β-肾上腺素能诱导的脂肪组织产热增加不敏感,其与GDF15处理的WT小鼠体重减少类似(扩展图7g–i)。GDF15不会改变直肠或iBAT温度(扩展图8a-c)。同样,作者使用正电子发射计算机断层扫描(PET–CT)进行评估,发现与对照注射组相比,GDF15没有显著改变在iBAT、心脏、肝脏或肾脏内的氧化代谢水平(扩展图8d–i)。白色脂肪组织或骨骼肌中的氧化代谢水平低于PET–CT检测的极限。最后,作者通过向iBAT中局部注射6-羟基多巴胺氢溴酸盐(6OHDA)使BAT去神经化,结果发现尽管与生理盐水注射组相比,这削弱了β3激动剂CL-316、243增加能量消耗和iBAT温度的作用(扩展图3),但与配对喂养的小鼠相比,它并没有抑制GDF15促进体重减轻,增加能量消耗或脂肪酸氧化的能力(扩展图9)。总之,这些数据表明GDF15不太可能通过脂肪组织中的β-肾上腺素能信号刺激能量消耗。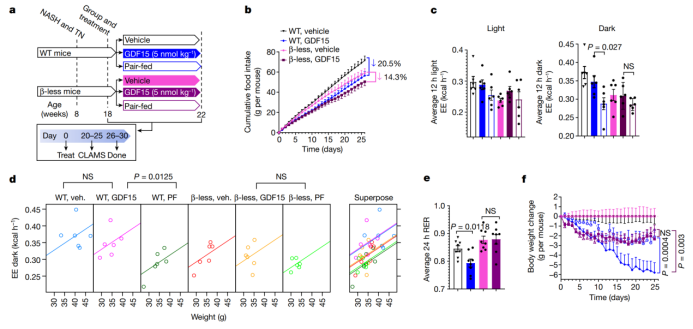
图3. GDF15通过β-肾上腺素受体增加能量消耗和脂肪酸氧化
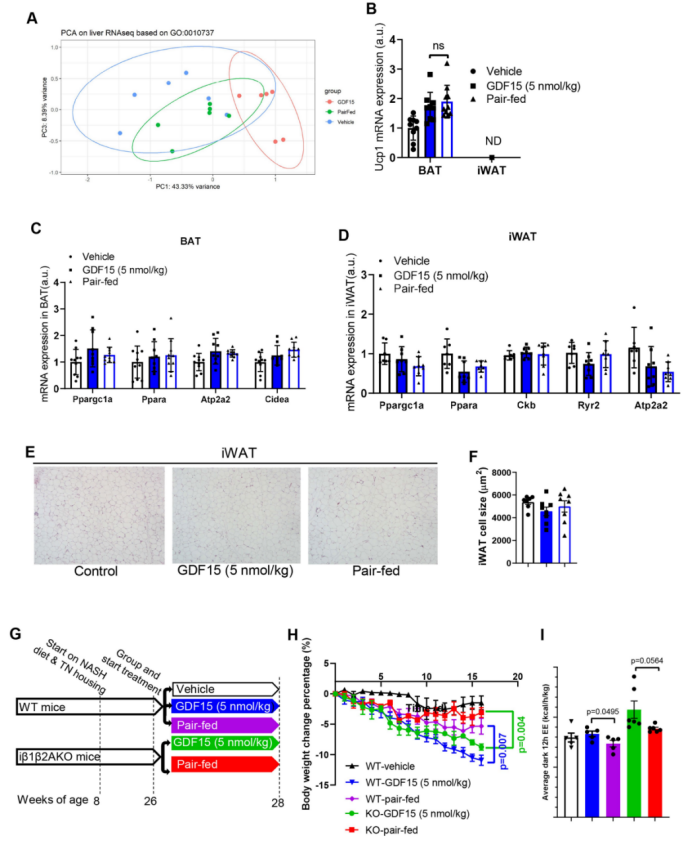
附图7. GDF15不会改变肝脏中的SNS信号传导和脂肪组织中的产热基因表达,并且不需要脂肪组织AMPK来诱导体重减轻
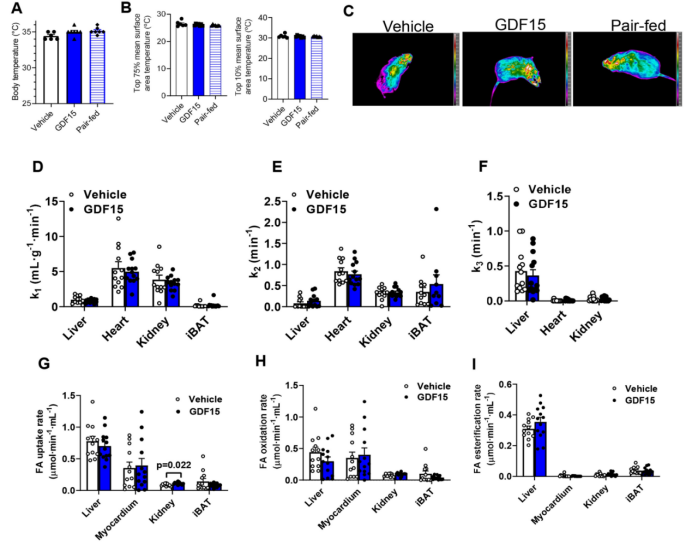
附图8. GDF15不会改变体温或肝脏/棕色脂肪组织中的氧化代谢

附图9. BAT去神经化不能阻止GDF15诱导的体重减轻、能量消耗和脂肪酸氧化
6. GDF15增加肌肉中的钙无效循环
研究表明β-肾上腺素能信号还能通过增加线粒体解偶联蛋白(小编注:有研究报道UCP3可以通过影响Ca2+吸收,而参与无效循环(Life Sci. 2021 Mar 15:269:119024.doi:10.1016/i,lfs.2021.119024.Nat Rev Endocrinol.2018 Feb;14(2):77-87))和肌脂蛋白(SLN)的表达来增加骨骼肌中的无效循环。SLN与肌浆网/内质网钙ATP酶(SERCA)结合,使ATP酶活性与Ca2+转运解偶联,促进ATP水解,从而在Ca2+增加的情况下进行无效循环。与BAT或肝脏相比,GDF15处理小鼠的胫骨前肌中去甲肾上腺素水平升高(图4a)。相同样本胫骨前肌RNA-seq数据的差异热图结果表明,对照注射组和GDF15处理组可聚为一类且不同于配对喂养组(图4b),这一发现与肝脏中的情况不同,其中配对喂养和对照注射组之间的转录组学谱无差异(图1i,j和扩展图7a)。与去甲肾上腺素的增加一致,骨骼肌中差异表达基因的GO注释显示,与配对喂养组相比,GDF15处理上调了cAMP/PKA信号通路(图4c)。靶向分析显示,与配对喂养组或GFRAL KO小鼠相比,PKA调控基因,包括Ppargc1a、Ucp3、Atp2a1(编码SERCA1)、Sln和Pln的表达水平更高,这表明GDF15的内源性水平可能对维持这一通路很重要(图4d)。与配对喂养组相比,GDF15处理还增加了氧化型的比目鱼肌和糖酵解型的趾长伸肌中Sln的表达水平(扩展图10a)。与GFRAL在肌肉中不表达以及通过SNS介导反应一致,用GDF15处理β受体敲除小鼠不会改变肌肉基因表达谱(扩展图10b)。同样,去甲肾上腺素而非GDF15增加了C2C12肌管中Atp2a1、Sln和Pln的表达水平(扩展图10c)。最后,分析最近发表的肥胖小鼠股四头肌RNA-seq数据发现,使用β2激动剂克伦特罗治疗后,Sln表达水平增加(扩展图10d)。总之,这表明GDF15通过增加β-肾上腺素能信号促进了在骨骼肌无效循环中关键基因的表达。
为了研究这些基因表达的变化是否诱导了肌肉代谢的功能变化,作者评估了脂肪酸氧化功能,结果发现与体内观察到的RER降低一致,在分离的比目鱼肌中GDF15有刺激脂肪酸氧化的趋势(图4e)。与配对喂养组相比,GDF15处理改善了原位电刺激的趾长伸肌(EDL)的肌肉收缩(图4f)。这些作用与纤维类型转变(扩展图10e,f)或肌肉结构的任何其他明显变化无关(扩展图10g),这表明GDF15可能促进了氧化代谢。随后,作者通过测量分离线粒体中的ADP/O比率,质子泄漏或通透过的肌纤维(小编注:permeabilized muscle fibres,在RCR测定过程中需要对肌纤维进行通透处理)中的呼吸控制比率(RCR)来评估氧化型骨骼肌的线粒体呼吸(扩展图10h–k)(扩展图10l),结果发现GDF15不会直接影响线粒体偶联效率。然而,与对照注射组相比,GDF15处理增加了渗透性肌纤维中Ca2+介导的呼吸(扩展图10m,n)。基于ADP滴定过程中的次极ADP反应(扩展图5),分析在350µM Ca2+存在下产生的ADP浓度,发现与对照组和配对喂养组相比,GDF15处理产生了更多的Ca2+衍生的ADP(图4g和扩展图10m,n)。为了进一步研究钙无效循环对驱动肌肉氧气消耗的重要性,作者评估了喂食NASH饮食肥胖小鼠的比目鱼肌呼吸,这些小鼠受到热量限制,并接受配对喂养或GDF15注射21 天。对肌肉呼吸进行基本评估,包括对咖啡因(增加SERCA活性和细胞内钙水平)和丹曲洛林(抑制赖氨酸受体和肌浆网钙的释放)处理后的反应。与之前在渗透性纤维中的观察结果一致,GDF15慢性处理并没有显著增加基础呼吸(图4h,i)。正如预期的那样,咖啡因的添加刺激了配对喂养小鼠的呼吸;然而,在GDF15处理的小鼠中,这种反应增强了约30%(图4h和扩展图10o)。重要的是,这种呼吸增加能通过添加丹曲洛林而消除(图4h,i和扩展图10o),表明GDF15是通过钙无效循环来增强骨骼肌能量消耗的。
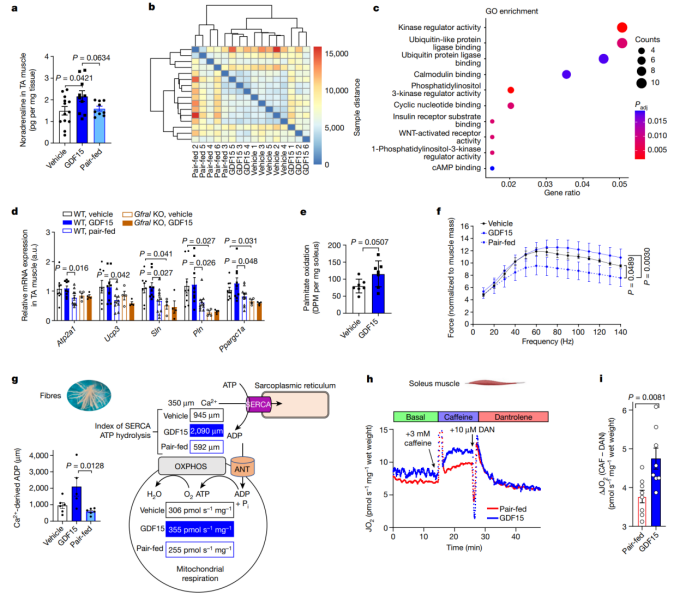
图4. GDF15增加骨骼肌中钙无效循环

附图10. GDF15增加骨骼肌中的β-肾上腺素能信号传导和线粒体呼吸,而不改变纤维类型百分比和肌肉结构
7. GDF15对人体肌肉生热效应和NAFLD的作用
上述研究表明GDF15在维持通过热量限制引起的能量消耗方面发挥着重要作用。然而,作者在GFRAL KO小鼠中的发现(图2)表明骨骼肌中能量消耗降低,并且β-肾上腺素能信号通路受到抑制(图3),也支持内源性GDF15的生理作用。因此,作者在三个不同的临床人群中检测了这些途径。首先,作者评估了健康成年人(n =154)的循环GDF15水平,并使用通风系统评估健康成年人(n = 154)的静息代谢率(RMR),结果发现GDF15和RMR之间存在弱正相关性(扩展图11a),该趋势在对脂肪量和年龄校正后仍然存在(扩展图11b)。然而,考虑到RMR是在体重稳定的个体中测量的,且是在没有运动的情况下检测的,所以这一发现可能并不令人惊讶,而作者在小鼠中观察到的是在黑暗周期和热量限制后,GDF15组的差异最大。因此,作者分析了来自人类骨骼肌样本的RNA-seq数据(n = 806),与在小鼠中的观察结果一致,与GDF15低表达的受试者相比,GDF15高表达受试者肌肉SLN和其他对脂肪酸氧化重要的PKA调节基因的表达水平更高(扩展图11c,d)。最后,尽管先前的观察性流行病学研究表明,GDF15的增加与人类肝脂肪变性有关(NAFLD会增加GDF15),但这些研究没有考虑到与NAFLD相关的混淆因素,如肥胖和线粒体应激同样会引起NAFLD的发生。通过孟德尔随机化研究,结果表明GDF15与肝脏脂肪含量呈负相关。这里是为了反驳之前的结论,进而得出下面与之前研究相反的结论)。通过孟德尔随机化研究,根据他们从父母那里遗传的等位基因随机分配,并将这种遗传变异(即GDF15单核苷酸多态性(SNPs))与血清GDF15蛋白水平联系起来,避免了通常影响观察性流行病学研究的混淆效应(小编注:先前的观察性流行病学研究发现,NAFLD与GDF15的增加具有相关性,但无法排除如肥胖和线粒体应激等引入的混淆因素,故无法保证NAFLD与GDF15增加之间的因果性。为了更加精准的证明NAFLD与GDF15之间的相关性,作者采用了孟德尔随机化(Mendelian Randomization, MR)分析方法。MR的定义为“使用遗传变异进行工具变量分析”,是基于最基本的孟德尔遗传规律,即亲代的等位基因会随机分配给子代,而基因型决定表型(如:疾病)。由于基因型是先天的(且遗传变异都是可以通过SNP芯片或者全基因组测序测量),不受后天的环境等各种混杂因素的影响,因而能够作为研究暴露(GDF15)和结局(NAFLD)因果关系的有力工具。因此,作者通过GDF15的SNPs与NAFLD进行关联分析,排除了混杂因素的干扰,且发现GDF15与肝脏脂肪含量呈负相关)。因此,为了检验上文的发现与NAFLD的潜在相关性,作者应用全基因组关联研究(GWAS)对UK Biobank参与者(n =32,859)磁共振成像(MRI)扫描的肝脏脂肪含量和体积进行了两样本孟德尔随机化(2SMR)。与之前的流行病学研究相比,作者发现GDF15与肝脏脂肪含量呈负相关(扩展图11e,f),而肝脏体积没有变化(扩展图11g)。这些数据表明,GDF15与临床人群中SLN增加和NAFLD减少有关。

附图11. GDF15与人类静息代谢率(RMR)和NAFLD之间的关系
总结
限制摄食促进减肥是治疗非酒精性脂肪肝和改善2型糖尿病患者胰岛素敏感性的有效策略。这尽管有效,但在大多数个体中,体重减轻通常不能长时间维持,部分原因是抑制能量消耗的代偿性反应,这一过程被称为适应性产热(生理适应抑制了能量消耗,见背景介绍),其机制尚不清楚。用重组GDF15处理摄食高脂饮食的啮齿动物,可通过GFRAL依赖性机制抑制食物摄入,可减少肥胖并改善血糖。在本文中,作者发现,除了抑制食欲外,GDF15还抵消了能量消耗的代偿性减少,与单独的热量限制相比,GDF15能引起更多的体重减轻和NAFLD减少。而GDF15在限制饮食期间,能依赖GFRAL-β-肾上腺素能信号轴维持能量消耗,该信号轴增加了小鼠骨骼肌中的脂肪酸氧化和钙无效循环。这些数据表明,靶向GDF15-GFRAL治疗通路可能有助于在热量限制期间维持骨骼肌的能量消耗,或有助于解决肥胖治疗中体重反弹这一难题。
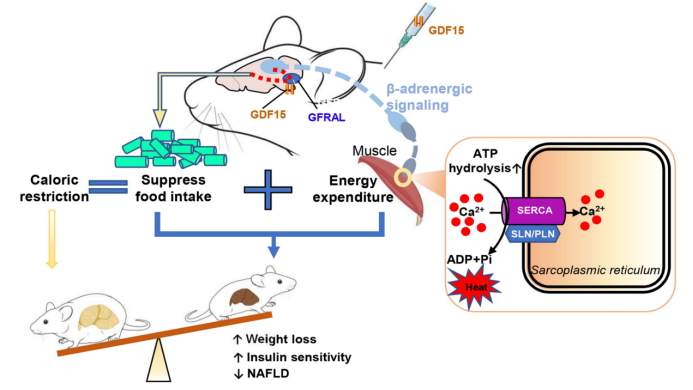
原文链接:https://doi.org/10.1038/s41586-023-06249-4
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1403465.html
上一篇:Cell:线粒体还原应激“守门员”
下一篇:代谢学人 Cell Metabolism :尊嘟假嘟,组蛋白乳酸化促进肝纤维化?